基于生殖系拷贝数变异(CNV)的全基因组关联研究(GWAS)帮你找到癌症相关snoRNA!
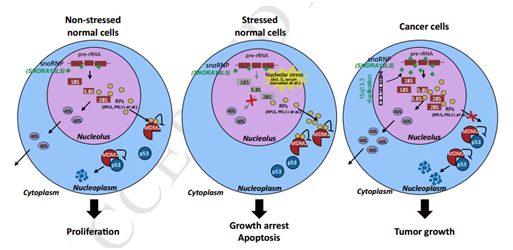
近年来,非编码RNA的研究从miRNA到lncRN到circRNA,而核仁小分子RNA(snoRNA)的研究起源较早,功能单一,之后的很长一段时间,snoRNA的研究陷入低潮。核仁小分子RNA(snoRNA)是一类广泛存在于真核生物细胞核仁的小分子非编码RNA,长度0-300nt, 具有保守的结构元件,并按它们的结构分为三大类:box C/D snoRNA、 box H/ACA snoRNA 和 MRP RNA。其中box C/D 和 box H/ACA主要通过碱基配对的方式分别指导着核糖体RNA的二氧甲基化和假尿嘧啶化修饰。此外,也有研究报道snoRNA参与snRNA、tRNA和mRNA的转录后修饰。近几年,随着测序技术的发展,越来越多的数据表明snoRNA在肿瘤中被异常调控,并发挥着功能。2018年8月,北京蛋白质组学研究中心蛋白质组学国家重点实验室,中国放射医学研究所周钢桥课题组在Gastroenterology (IF=20.773)发表了名为“Germline Duplication of SNORA18L5 Increases Risk for HBV-related Hepatocellular Carcinoma by Altering Localization of Ribosomal Proteins and Decreasing Levels of p53” ,该研究是基于生殖系拷贝数变异(CNV)的全基因组关联分析(GWAS),通过对比1583例乙型肝炎病毒(HBV)相关的肝癌患者与1540例乙型肝炎病毒(HBV)相关的非肝癌患者,发现了一个低频重复染色体15q13.3与乙型肝炎病毒相关的肝癌患病风险密切相关(P=3.17 × 10–8;odds ratio, 12.02)。15q13.3的拷贝数与SNORA18L5在肝组织中的表达相关。过表达SNORA18L5的增加了小鼠肝癌细胞的增殖和移植瘤的生长;干扰SNORA18L5降低了肝癌的增殖和肿瘤的生长。SNORA18L5在HepG2和SMMC-7721细胞中的过表达可抑制p53依赖性细胞周期阻滞和凋亡。SNORA18L5的过表达导致核糖体生物合成活性增强,成熟的18S和28S rRNA水平升高,导致核糖体蛋白RPL5和RPL11停留在核仁中,从而阻止它们与MDM2结合。这导致了MDM2介导的p53泛素化和降解的增加。与非肿瘤肝组织相比,HCC组织中SNORA18L5水平升高,且患者生存时间缩短。该研究深入浅出的从中国人口全基因组的生殖拷贝数的突变入手进一步揭示了CNV的突变通过snoRNA的差异表达来影响乙型肝炎病毒(HBV)相关的肝癌。
机制图
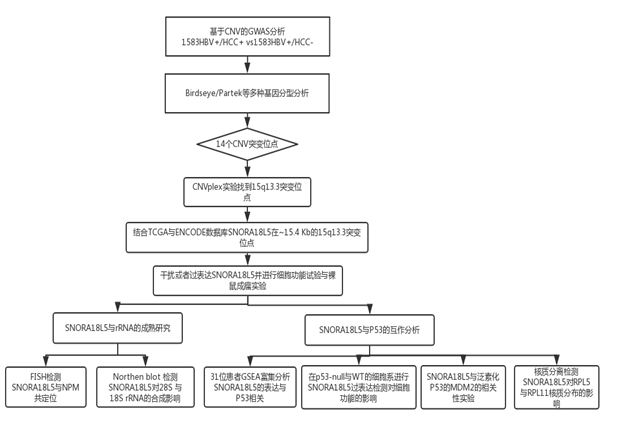
技术路线图
结果
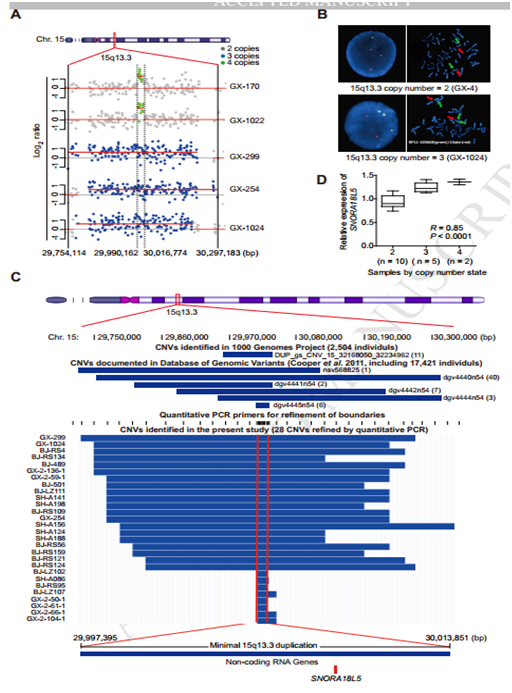
图1
A 通过CNVplex实验对237例病例组与243对照组患者的14个CNV位点进行了基因分型,只有低拷贝数的染色体15q13.3位点存活下来; B 荧光原位杂交(FISH)发现三个拷贝数的CNV确实存在于15q13.3位点;C 多种族数据库分析以及亚洲人的1000个基因组计划的数据库分析,15q13.3重复基于Affymetrix SNP-probe等位基因强度的最大间隔跨度约为614.5 Kb,通过与TCGA数据库中28类肿瘤比较分析,最小重复区间被定义为~15.4 Kb的间隔序列,与ENCODE转录组测序结果对照,发现SNORA18L5刚好在 ~15.4 Kb 的结构域;D RT-PCR结果表明SNORA18L5的表达与拷贝数具有相关性。
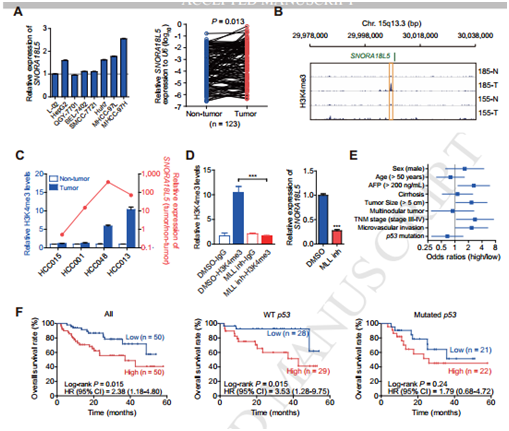
图2
A SNORA18L5在肝癌细胞系高表达; B 在肿瘤组织里SNORA18L5启动子区H3K4me3表达上调; C ChIP-qPCR 实验利用H3K4me3 抗体,检测SNORA18L5的 与H3K4me3 具有相关性; D 加入MLL抑制剂阻碍了H3K4me3富集到SNORA18L5的启动子区; E H3K4me3的上调与AFP等指标正相关; F Kaplan-Meier分析SNORA18L5高表达与肝癌的不良预后有关。
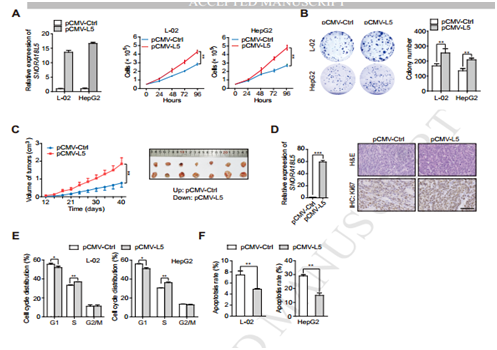
图3
A,B 在L-02 与HepG2过表达SNORA18L5促进细胞增殖与克隆形成; C SNORA18L5过表达促进小鼠体内肿瘤块的生成;D 免疫组化实验SNORA18L5促进ki-67表达;E过表达SNORA18L5促进G1/S期转化;F过表达SNORA18L5抑制细胞凋亡。
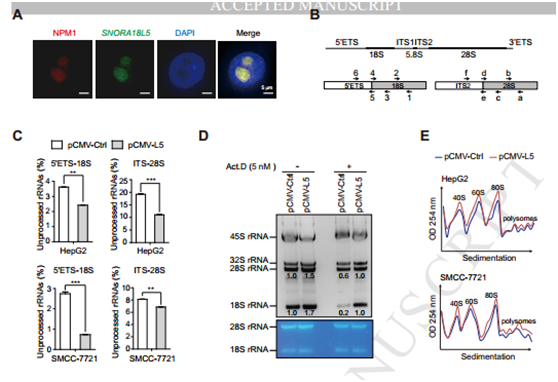
图4
A SNORA18L5与NPM共定位于细胞核;B 前体与成熟rRNA引物设计 C过表达SNORA18L5促进成熟的28S 与18S rRNA的合成;D Northern blotting结果表明过表达SNORA18L5促进rRNA的合成 加入Act.D能逆转这一结果;E 过表达SNORA18L促进单核糖体与多核糖体的合成。

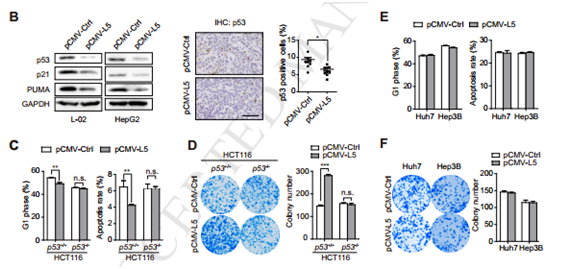
图5
A 31位HBV携带的肝癌患者的GSEA富集分析发现SNORA18L5的表达与P53富集相;B过表达SNORA18L5抑制P53以及相关基因的表达 C 在p53+/+细胞过表达SNORA18L5抑制细胞凋亡,在p53-/-细胞促进了G1/S期转化 D,F p53+/+细胞克隆形成能力增强;并且在Huh7和p53-null HCC细胞系Hep3B证实了SNORA18L5的致瘤性。
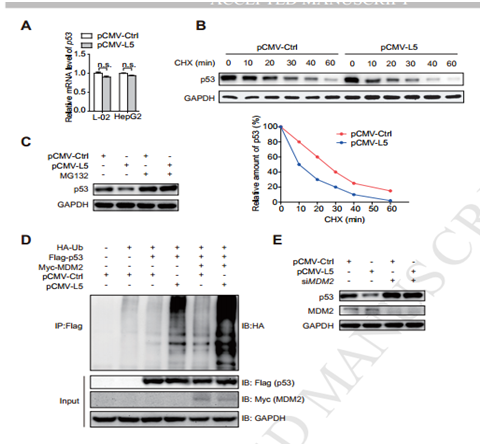
图6
A 过表达或者敲低SNORA18L5,p53 mRNA水平不变;B 放线菌酮(CHX)实验证实过表达SNORA18L5缩短了P53的半衰期; C 蛋白酶体抑制剂MG132能减SNORA18L5所造成的P53的降解;D SNORA18L5干预MDM2所导致的P53的泛素化; E 敲低MDM2后P53的表达不受SNORA18L5的影响
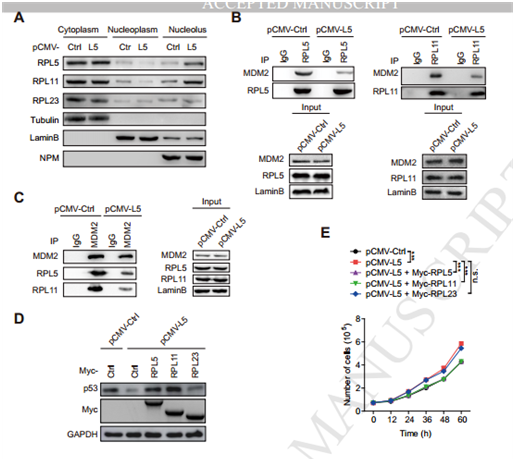
图7
A 在HepG2过表达SNORA18L5使得RPL5与RPL11在胞质中表达降低却在细胞核里表达上调;B,C在HepG2过表达SNORA18L5使得MDM2与RPL5以及RPL11的内源性的结合能力减弱;D,E RPL5与RPL11是P53稳定性与细胞增殖所必须的






