细胞焦亡——下一个研究热点
2017年邵峰院士团队在nature上发表了细胞焦亡的新机制,细胞焦亡开始受到极大的关注。
首先,让我们来科普一下细胞焦亡:
细胞焦亡又称细胞炎性坏死,是一种程序性细胞坏死。表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。主要通过炎症小体介导包含Caspase-1在内的多种Caspase的激活,造成包括GSDMD在内的多种Gasdermin家族成员发生剪切和多聚化,造成细胞穿孔,进而引起细胞死亡。
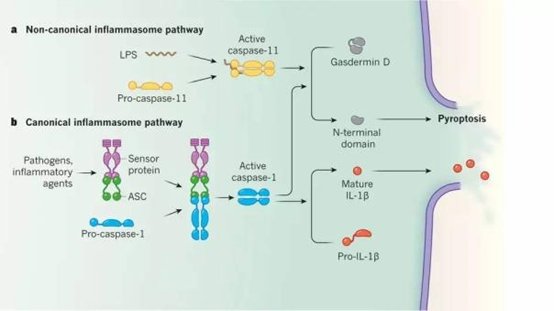
细胞焦亡激活的通路包括依赖Caspase-1的经典途径和依赖Caspase-4、5、11的非经典途径(图1)。
依赖Caspase-1的细胞焦亡经典途径:
在细菌等刺激下,模式识别受体通过接头蛋白ASC与Caspase-1的前体结合,激活 Caspase-1,激活的Caspase-1切割Gasdermin D,生成含氮端活性域的肽段,激活细胞焦亡,同时,活化的Caspase-1对IL-1β和IL-18的前体进行切割,形成有活性的IL-1β和IL-18,并释放到胞外,募集炎症细胞聚集,扩大炎症反应。
依赖Caspase-4、5、11的细胞焦亡非经典途径:
活化的Caspase-4、5、11切割Gasdermin D,形成含有Gasdermin D氮端活性域的肽段,诱导细胞膜穿孔,细胞破裂,释放内容物,引起炎症反应。
接下来看下细胞焦亡的国自然基金情况 :
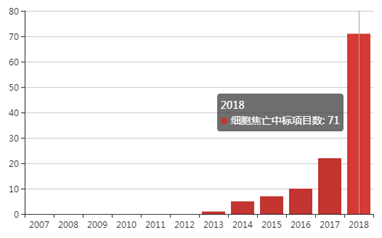
图2 细胞焦亡历年基金情况
由2可看出,细胞焦亡在2018年中标数71个,而且这两年是呈直线上升的趋势。
基金申请竞争激烈,将两个热点结合一块能够加大中标的几率,从下图就能看出很多人利用了这一点,在一个研究中同时引入了lncRNA 和细胞焦亡。

那么如何将这两个热点引入自己的研究呢?下面让我们通过一篇文献来套路一下。

背景:动脉粥样硬化(AS)是一种与内皮功能障碍有关的炎症性疾病。据报道,褪黑素具有显著的抗炎特性,已被证明对AS有效。最新报道表明,细胞焦亡在AS进展过程中起着关键作用。然而,细胞焦亡是否会导致内皮功能障碍,及其潜在的分子机制仍未被开发。本研究旨在探讨褪黑素对动脉粥样硬化内皮细胞的抗焦亡作用,并探讨其可能机制。
结果:本研究以高脂饮食(HFD)治疗ApoE-/-小鼠作为动脉粥样硬化动物模型。我们发现胃内给褪黑素12周明显减少主动脉粥样硬化斑块。同时,还下调焦亡相关基因的表达,包括NLRP3, ASC, cleaved-caspase1, NF-κB/GSDMD, GSDMD-N termini, IL-1β, and IL-18在褪黑素处理动物的主动脉内皮中的表达。在oxl - ldl处理的人主动脉内皮细胞(HAECs)中也观察到一致的抗细胞焦亡作用。我们发现在HAECs中lncRNA MEG3增强了细胞焦亡。此外,MEG3作为内源性spong,通过序列互补作用抑制miR-223的功能,增加NLRP3的表达,增强内皮细胞焦亡。此外,miR-223的下调阻断了oxl - ldl处理过的HAECs中褪黑素的抗焦亡作用。
结论:综上所述,我们的研究结果表明,褪黑素通过MEG3/miR-223/NLRP3轴在动脉粥样硬化中抑制内皮细胞焦亡,因此褪黑素的替代可能被认为是一种新的策略。
思路:
1.验证药物在AS中的治疗作用。
2.验证药物影响细胞焦亡相关基因在AS内皮细胞中的表达
3.筛选受调控的细胞焦亡相关基因为目标基因(这里选择细胞焦亡信号通路上游的NLRP3),研究调控该基因的miRNA(这里是已有报道)。
4.根据miRNA研究调控焦亡的lncRNA.
关键结果图:
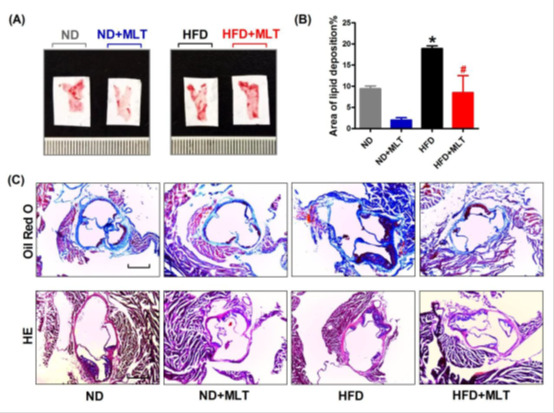
Fig1. Melatonin alleviates atherosclerosis.
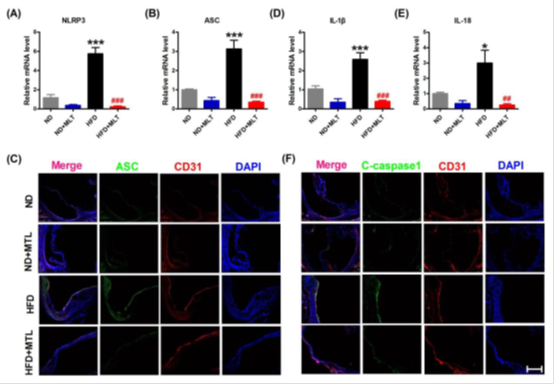
Fig2. Downregulation of pyroptosis in aortic intima of HFD-fed ApoE-/- mice with melatonin treatment.
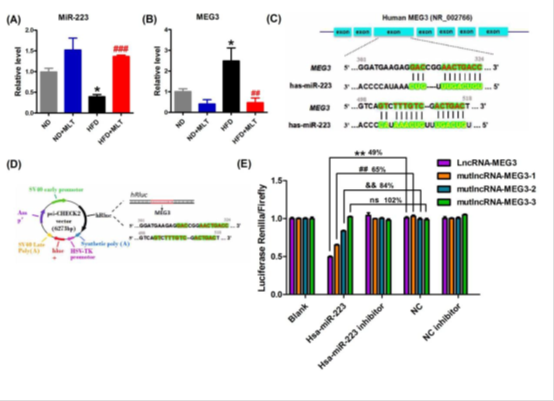
Fig3. Identification of lncRNA-MEG3 as a ceRNA for miR-223.






