巨噬细胞分泌外泌体促进胰腺癌抵抗吉西他滨
吉西他滨通过终止DNA复制来抑制细胞生长的一种抗肿瘤药物,临床上用作晚期胰腺癌患者在氟尿嘧啶类失败后的二线用药,能够改善患者的生活质量,但胰腺导管腺癌会对吉西他滨产生抵抗。肿瘤相关巨噬细胞最近被证明能够促进癌细胞对吉西他滨的抵抗,但是这一过程的确切机制还不明确。
最近来自以色列Rambam医学中心的研究人员对胰腺导管腺癌抵抗抗肿瘤药物吉西他滨的机制进行了深入研究,并将相关研究结果发表在国际学术期刊Cancer Research上(IF=9.130)。在这项研究中,研究人员通过一个胰腺导管腺癌的基因小鼠模型和电镜分析,发现肿瘤相关巨噬细胞通过分泌外泌体与肿瘤微环境交流,并且这些外泌体能够被癌细胞特异性捕获内化。研究人员将合成的dsDNA转入小鼠腹膜巨噬细胞中,再将细胞注射到胰腺导管腺癌荷瘤小鼠体内,发现原位肿瘤和肝转移灶内的dsDNA片段浓度比正常组织中更高。
研究发现巨噬细胞分泌的外泌体能够显著降低胰腺导管腺癌细胞对吉西他滨的敏感性,无论是在体外还是体内实验中均如此。这种效应由外泌体中microRNA-365所介导,miR-365能够通过上调癌细胞内三磷酸核苷酸的水平,诱导胞苷脱氨酶的表达,抵抗吉西他滨的作用。研究结果也证实miR-365能够诱导胰腺导管腺癌荷瘤小鼠抵抗吉西他滨的治疗作用,而miR-365的拮抗剂则可以恢复癌细胞对吉西他滨的敏感性。研究人员还发现缺失Rab27 a/b的小鼠无法分泌外泌体,因此对吉西他滨的应答显著好于野生型小鼠。
综上所述,这些结果表明巨噬细胞分泌的外泌体是胰腺导管腺癌抵抗吉西他滨的关键因素,阻断miR-365的作用可 以增强癌细胞对吉西他滨的应答。
技术路线
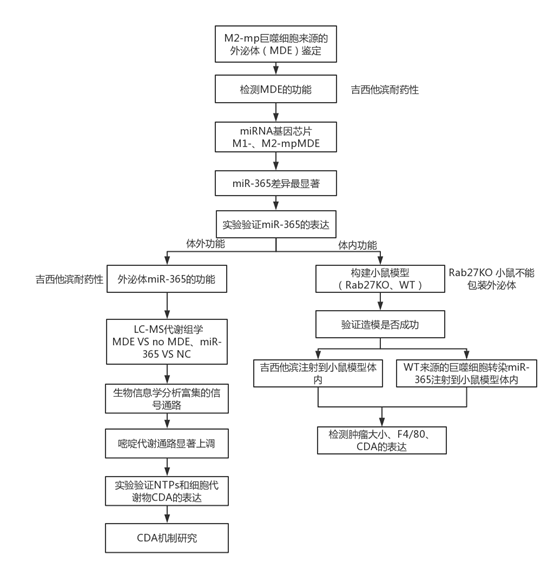
结果
1. mp巨噬细胞分泌外泌体和吉西他滨耐药性检测
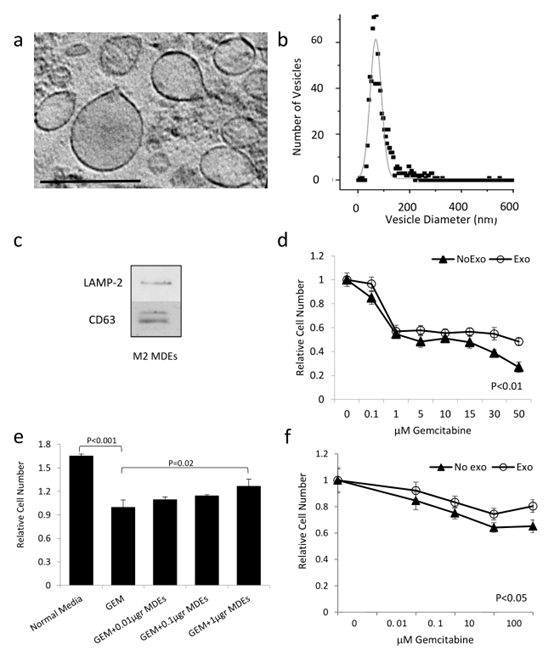
图1
A. 小鼠腹腔巨噬细胞培养基中外泌体的电镜图片。B. 外泌体的电镜分布图。C. WB分析来自M2极性mp巨噬细胞的外泌体。D. K989细胞、外泌体预处理和对照组与不同浓度的吉西他滨共孵育后的增殖情况。E. 不同浓度的吉西他滨处理K989细胞后的增殖情况。F. MiaPaCa-2(胰腺癌细胞系)细胞、THP-1来源的外泌体、对照组与不同浓度的吉西他滨共孵育后的增殖情况。
2. MED的筛选

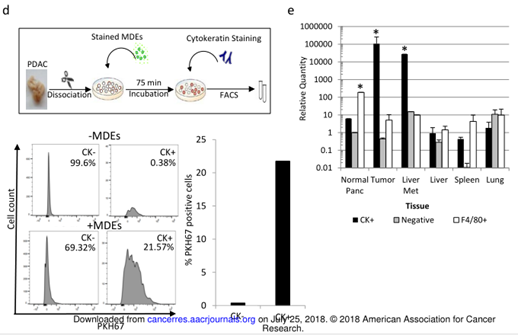
图2
A. 有或没有染色的外泌体(绿色)的K989细胞进行confocal,细胞膜为红色。B. 外泌体在K989细胞内的3D图。C. 来源于质膜或核的外泌体分布情况。D. 外泌体通过K989内在化。实验设计(上),K989细胞(细胞角蛋白阳性)或基质细胞(细胞角蛋白阴性)摄取的外泌体进行FACS分析。E. qPCR检测PDAC细胞(CK+),巨噬细胞(F4/80+)和基质细胞(negative)。
3. 来源于巨噬细胞的外泌体能够将miRNA-365转运到PDAC细胞中,诱导吉西他滨耐药
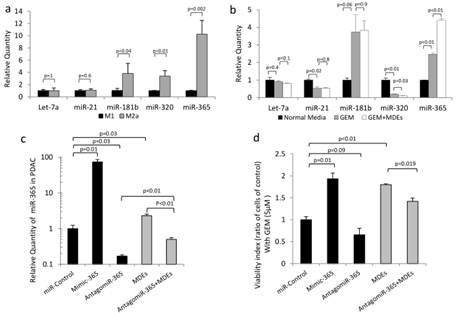
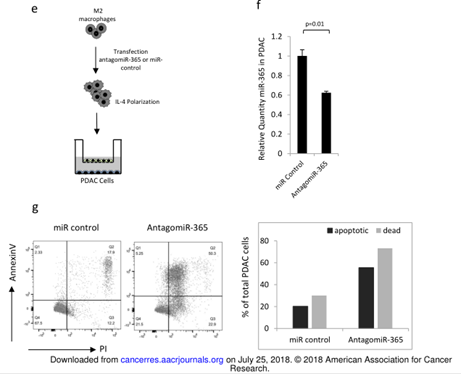
图3
A. qPCR检测M1和M2极性来源的外泌体的miRNAs的富集情况。B. qPCR检测吉西他滨、吉西他滨+MDE、对照组(正常培养基)孵育K989细胞后的miRNA的富集。C. 在K989细胞中,不同处理后miR-365的表达变化情况。D. 不同处理后K989细胞的增殖情况。E.实验设计流程图。F. miR-365在K989细胞中的表达。G. FACS分析过表达miR-365的M2极化的mp巨噬细胞共孵育的K989细胞。
4. 巨噬细胞来源的外泌体和miR-365调节嘧啶的合成和CDA表达
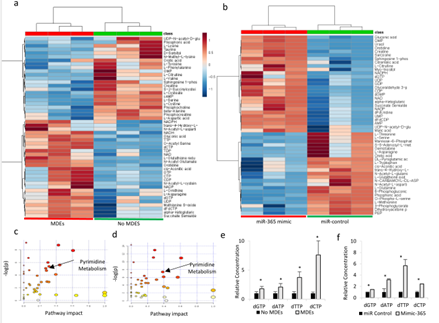
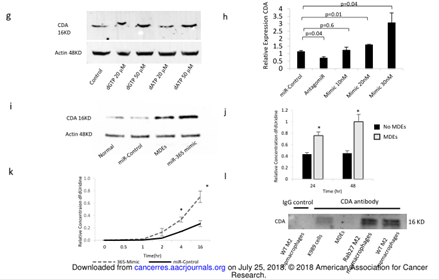
图4
A.MDE或对照组预处理的K989细胞加入吉西他滨后的LC-MS代谢组学的热图。B. 在K989细胞中转染miR-365或NC后,孵育MDE或对照组后的LC-MS代谢组学的热图。C.关于a图的信号通路富集情况。 D.LC/MS 分析加或不加MDE的K989细胞中dNTPs的浓度。E. 关于b图的信号通路富集情况。F. LC/MS 分析转染miR-365或NC的K989细胞中dNTPs的浓度。G. WB检测提高NTPs浓度的K989细胞中的CDA的表达。H. qPCR检测转染寡核苷酸K989细胞中的CDA的表达。I. WB检测K989细胞中的CDA的表达。J. LC/MS 分析K989细胞、加或不加MED后的排泄物中dFdUridine的表达情况。K. MS分析K989细胞的排泄物中dFdUridine的表达情况。L. 来自K989细胞和MDE孵育后的裂解液进行IP。
5. 在体内,巨噬细胞来源的外泌体和吉西他滨耐药性
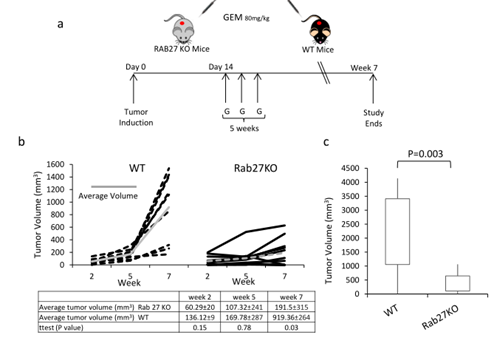
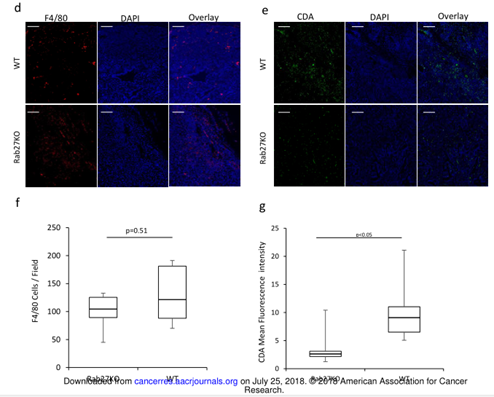
图5
A. 实验步骤。B. 超声测量WT 和Rab27KO小鼠在2-7周的肿瘤体积大小。C. 病理测量WT 和Rab27KO小鼠在2-7周的肿瘤体积大小。D. WT 和Rab27KO小鼠肿瘤的巨噬细胞免疫荧光(F4/80-red)。E. WT 和Rab27KO小鼠肿瘤的CDA免疫荧光。F. F4/80 细胞/体积的定量。G. CDA在e中的荧光密度。
6. 在体内,mp巨噬细胞能够通过携带miR-365加剧免疫应答
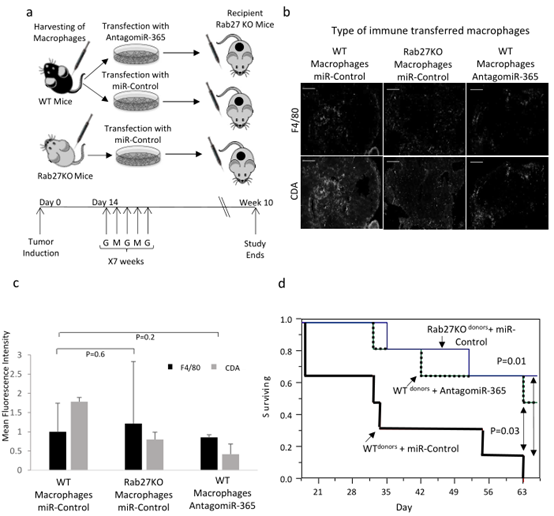
图6
A.将K989细胞移植Rab27KO后两周,WT和Rab27KO小鼠来源的mp巨噬细胞(转染NC或miR-365)注射到小鼠体内。B. 在PDAC 肿瘤中进行Rab27KO和CDA免疫荧光。C. 量化b图。D. Kaplan-Meier分析。
总结
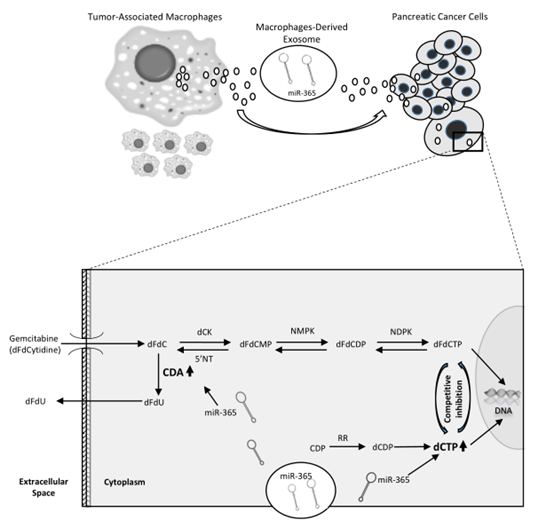
图7. 肿瘤相关的巨噬细胞诱导吉西他滨药物的机制总结。
MDE能够携带转运从PDAC细胞中筛选出的miR-365。吉西他滨被转运到PDAC中,并且被dCK磷酸化后产生dFdCTP或通过CDA脱去氨基到dFdU,这会分泌到细胞外。在PDAC细胞中,miR-365上调,包内NTP的浓度提高,这会竞争dFdCTP对DNA的结合能力。NTPs的提高也会上调CDA的表达,进一步促进dFdC脱氨基。






