致命的肥胖——脂肪组织外泌体促进肝细胞癌发展
肝细胞癌(HCC)是原发性肝癌最常见的病理类型之一,危害大,有多种诱因,肥胖亦被视为导致肝细胞癌的重要危险因素之一,但目前针对肥胖与肝细胞癌之间关系的研究还十分的少。今年4月,Dr. Haiyang Zhang等人在杂志《Oncogene》上发表了一篇题为“Exosome circRNA secreted from adipocytes promotes the growth of hepatocellular carcinoma by targeting deubiquitination-related USP7”的文章,研究者们认为脂肪细胞可以通过分泌外泌体吸收miR-34a并激活USP7/Cyclin A2通路,最终促进肝细胞癌的发生发展,并通过一系列的实验证实了自己的猜想。
摘要:
肝细胞性肝癌(HCC)是肝癌的主要表现形式,其发病率不断上升,且预后较差。脂肪组织能量储存和通过分泌脂肪因子调节代谢的功能已被熟知。环状RNA(circRNA)是一种新型的非编码RNA,近年来被认为是肿瘤发生发展过程中的关进因子,但从脂肪组织中提取的外泌体circRNA的作用尚不明确。在这里,脂肪分泌的circRNA被发现可在HCC中调控去泛素化,从而促进细胞生长。研究发现,在体脂较高的HCC患者中,外泌体环状-去泛素化(circ-DB)表达上调。此外,体外和体内的研究表明exocirc-DB通过抑制miR-34a和激活去泛素化相关USP7促进HCC生长并减少DNA损伤。最终,结果表明,脂肪外泌体对HCC细胞的作用可以通过敲除circ-DB逆转。这些结果显示脂肪细胞分泌的外泌体cirRNAs通过抑制miR-34a和激活USP7/Cyclin A2信号通路促进肿瘤生长并减少DNA损伤慢性乙型肝炎(HBV)或丙型肝炎(HCV)感染、过度饮酒、免疫相关肝炎和肥胖通常被认为是导致HCC的主要危险因素。在肝癌细胞中,miR-34a在β-catenin监管中起着至关重要的作用。然而,miR-34a与circRNA之间的相互作用仍然未知。泛素特异性蛋白酶7 (USP7)是一种去泛素化酶,在细胞周期、增殖、DNA修复等多种细胞过程中发挥重要作用。高水平的USP7常出现在HCC组织中,这与肿瘤的生长和侵袭有关,导致总体生存率较低。USP7抑制剂P5091诱导慢性淋巴细胞白血病(CLL)生长停滞和凋亡。在肝细胞肿瘤发生过程中,泛素特异性蛋白酶驱动细胞周期的发展。 近年来的研究表明,Cyclin A2是USP7的重要下游底物,活跃的USP7/Cyclin A2信号通路可以促进乳腺癌的生长。
一、HCC中exo-circ-DB和USP7的表达模式
从HCC患者和正常受试者(NC)的血浆中分离出外泌体。利用western blot寻找外泌体特异性标志物,将患者分组,检测USP7表达水平,采用RT-qPCR检测外泌体中circ-DB的表达水平,并结合WB和灰色分析对USP7蛋白进行定量。数据表明,体脂比较高的HCC患者外泌体circ-DB上调,且circ-DB与USP7表达呈正相关。
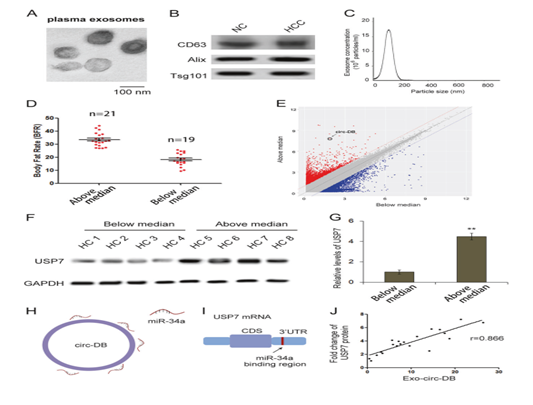
Fig. 1 HCC中exo-circ-DB和USP7的相关性研究。 a 从人血浆中分离的外泌体透射电镜(TEM)图像(比例尺,100 nm)。 b 从正常受试者(NC)和HCC患者中分离血浆外泌体。三种代表性外泌体特异性标志物的Western blotting结果:CD63, Alix和Tsg101。 c 用NAT分析检测血浆外泌体的大小范围。 d 根据HCC患者体脂比例中位数,将HCC患者分为中位以上组(n = 21)和中位以下组(n = 19)。 e 使用安捷伦芯片微阵列扫描仪初步筛选HCC的circ-RNA (n = 21 ,n = 19)。 f, g 中位数以上组和中位数以下组USP7的WB分析(n = 21, n = 19)。 h circ-DB与USP7之间潜在相互作用的代表性图像。 i 预测miR-34a在USP7 mRNA中的结合区域。 j 血浆exo-circ-DB与USP7蛋白的临床相关性(n = 21)。 **p < 0.01
二、exo-circ-DB、miR-34a和USP7的临床相关性
通过免疫组化法(IHC)检测癌旁组织(P)和肿瘤组织(T)中USP7的表达,利用PT-PCR检测各组circ-DB表达量,检测各组中miR-34a和USP7的表达。数据表明,血浆外泌体circ-DB在中位以上组上调,与miR-34a和USP7在HCC中的表达密切相关。

Fig. 2 HCC中exo-circ-DB、miR-34a和USP7的临床相关性. a 应用免疫组织化学染色法(IHC)检测癌旁组织(P)和肿瘤组织(T)中USP7的表达。比例尺,100 μm。 b 根据USP7 mRNA的平均值将HCC患者分为两组。USP7的表达与HCC的生存密切相关(高组中n = 1595,低组中n = 2356)。 c–e 中位以上组和中位以下组中exo-circ-DB、肿瘤组织中miR34a和肿瘤组织中USP7的水平(n = 21,n = 19)。f, g exo-circ-DB与miR-34a呈负相关(n = 21, R = 0.735),miR-34a与USP7呈负相关(n = 21, R = 0.762)。 **p < 0.01
三、miR-34a与USP7的直接相互作用
miR-34a被认为是与细胞周期、细胞增殖和生存相关的癌症相关基因的调控因子。USP7是预测出的高可信靶点之一。研究者使用miRNA模拟物被用来过表达miR-34a, 使用miRNA抑制剂来抑制miR-34a的表达。使用生物素标记的miR-34a进行免疫沉淀,以确定miR-34a是否直接与USP7相互作用。通过荧光素酶报告实验进一步证明miR-34a对 USP7的调控作用。结果表明miR-34a直接抑制USP7, Cyclin A2是USP7的重要下游底物。
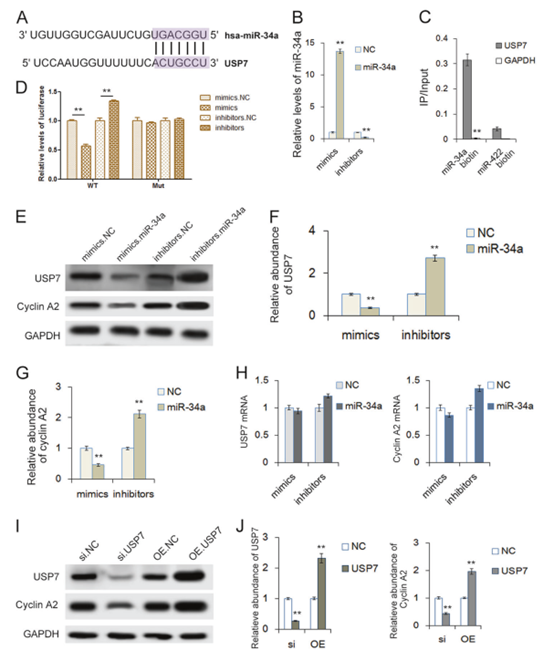
Fig. 3 验证USP7在HCC细胞中作为miR-34a的直接靶点以及Cyclin A2的靶点。a miR-34a和USP7可能的结合位点。 b miR-34a水平的RT-PCR分析(n = 3)。 c 被biotin-miR-34a捕获的USP7 mRNA的RT-qPCR分析 (n = 3)。d miR-34a直接识别USP7(n = 3)。含有野生型(WT)或突变型(Mut) USP7的萤火虫荧光素酶报告基因,将miR-34a模拟物和相关正常对照物共转染293个T细胞。转染后检测相对荧光素酶水平(n = 3)。 e–g WB显示了miR-34a模拟物或miR-34a抑制剂治疗的HCC细胞中USP7和cyclin A2的表达水平(n = 3)。 h RT-PCR定量检测相应的USP7和cyclin A2表达(n = 3)。i, j 当USP7过表达或被siRNA抑制时,Cyclin A2的表达水平(n = 3)。 **p < 0.01
四、脂肪细胞外泌体对肝癌细胞miR-34a、USP7和Cyclin A2的影响
研究者利用透射电镜观察3T3L1细胞外泌体的形态,检测3T3L1细胞中CD63、Alix和tsg10的表达量。用成熟脂肪细胞分泌的外泌体处理HCC细胞,检测miR-34a、USP7和cyclin A2水平。将circ-DB的siRNA转染到3T3L1细胞中以去除外泌体中的circ-DB,转染48小时后收集外泌体。由结果可知,脂肪细胞外泌体作为exo-circ-DB的载体,上调USP7和cyclin A2。
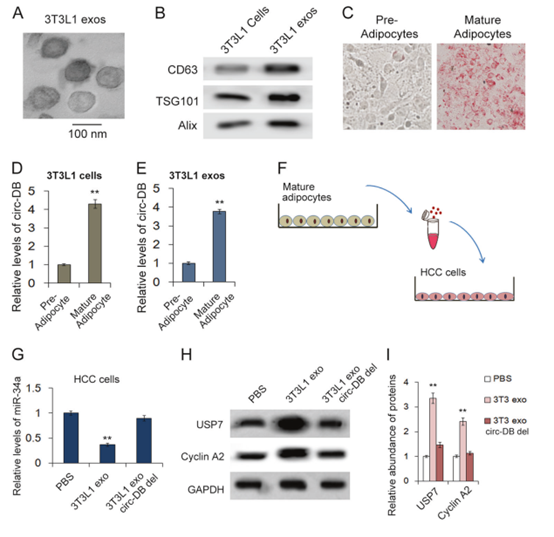
Fig. 4 miR-34a、USP7和Cyclin A2的表达受脂肪细胞外泌体调控。 a 3T3L1外泌体的透射电镜图像(比例尺,100 nm)。b WB检测CD63、Alix、Tsg101表达。c 成熟脂肪细胞和脂肪前体细胞的油红O染色。d, e circ-DB在成熟和前体脂肪细胞(d)以及3T3L1细胞外泌体(e)中的表达差异(n = 3)。f 成熟脂肪细胞外泌体治疗HCC细胞的图示。 g–i miR-34a在成熟脂肪细胞外泌体治疗的HCC细胞中的定量表达以及USP7和cyclin A2的表达水平 (n = 3)。**p < 0.01
五、circ-DB与miR-34a的相关性
通过荧光素酶报告基因实验进一步揭示了circ-DB与miR-34a的直接联系,构建含有mir-34a结合区1或2的荧光素酶报告质粒,每个质粒包含一个mir-34a结合区域。将含有mir-34a结合位点(mut)逆序序列的质粒作为阴性对照。然后使用WB检测USP7和Cyclin A2的表达水平以进一步评价circ-DB对USP7或Cyclin A2的影响。
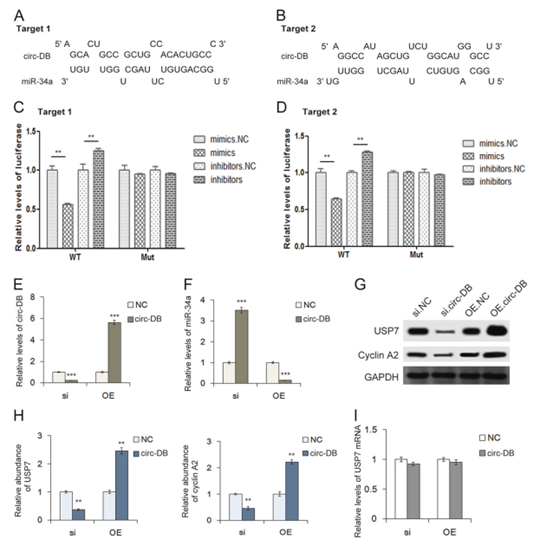
Fig. 5 circ-DB调控miR-34a/USP7/Cyclin A2通路。a, b miR-34a在circ-DB中的两个预测结合区域。c, d 通过荧光素酶实验验证miR-34a与circ-DB之间的相互作用(n = 3)。e circ-DB的RT-PCR定量或circ-DB siRNA的抑制作用。f 细胞经circ-DB-OE质粒和circDB siRNA处理后的miR-34a水平。g, h 用circ-DB-OE质粒和circDB处理的成熟脂肪细胞中USP7和Cyclin A2的表达水平(n = 3)。i 用circ-DB-OE质粒和circ-DB siRNA (f)处理的3T3L1细胞中USP7的定量(n = 3) **p < 0.01,***p < 0.001
六、 脂肪exo-circ-DB促进肝癌细胞的生长,抑制DNA损伤
研究者检测了脂肪来源的外泌体对肝癌细胞生物学行为的影响。随后,将circ-DB过表达质粒和circ-DB siRNA转染HepG2细胞,进一步揭示circ-DB在HCC中的生物学作用。由结果可知脂肪外泌体通过传递circ-DB促进肝癌细胞的增殖和迁移,减少DNA损伤。
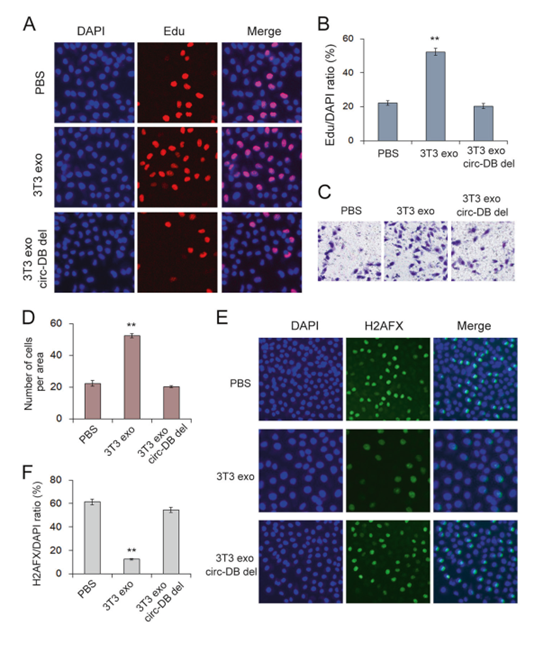
Fig. 6 外泌体circ-DB促进肿瘤生长,减少DNA损伤。用3T3 exo或circDB被circ-DB siRNA去除的3T3 exo预处理HCC细胞。a, b 用Edu实验检测细胞增殖(n = 3)。c, d用transwell法测定细胞迁移(n = 3)。e, f DNA损伤评估(n = 3)。**p < 0.01
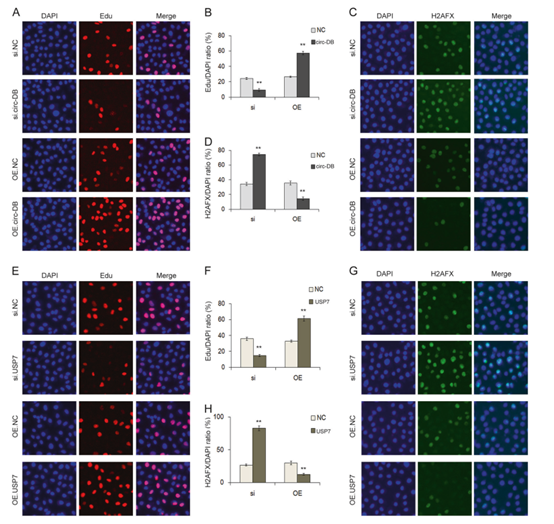
Fig. 7 circ-DB和USP7在肝癌细胞增殖和DNA损伤调控中的作用。用circ-DB过表达质粒(OE.circ-DB)预处理HCC细胞,用circDB siRNA(si.circ-DB)去除circ-DB siRNA。a, b 用DAPI和EdU对细胞进行染色,核成像显示肝癌细胞的增殖(n = 3)。c, d 用DAPI和H2AFX进行细胞染色,然后核成像(n = 3)。用USP7过表达质粒(OE.USP7)和USP7 siRNA (si.USP7)预处理HCC细胞。e, f 用DAPI和EdU对细胞进行染色,然后核成像显示HCC细胞的增殖情况(n = 3)。g, h 用DAPI和H2AFX染色细胞,然后核成像 (n = 3)。**p < 0.01
七、USP7介导HCC中cyclin A2去泛素化
Cyclin A2是Cyclin家族成员之一,在S期促进DNA合成,促进细胞周期从G2期向M期过渡。Cyclin A2功能障碍与细胞错误增殖和染色体不稳定有关。
研究者通过结合cyclin A2免疫沉淀和UB WB,研究USP7在介导cyclin A2去泛素化过程中的作用;加载HCC细胞总蛋白来检测cyclin A2的表达,利用cyclin A2抗体拉低的免疫沉淀分析cyclin A2的泛素化。
总结得到的结果,可知USP7通过降低包括cyclin A2在内的多种蛋白的泛素化而发挥致癌基因的作用。
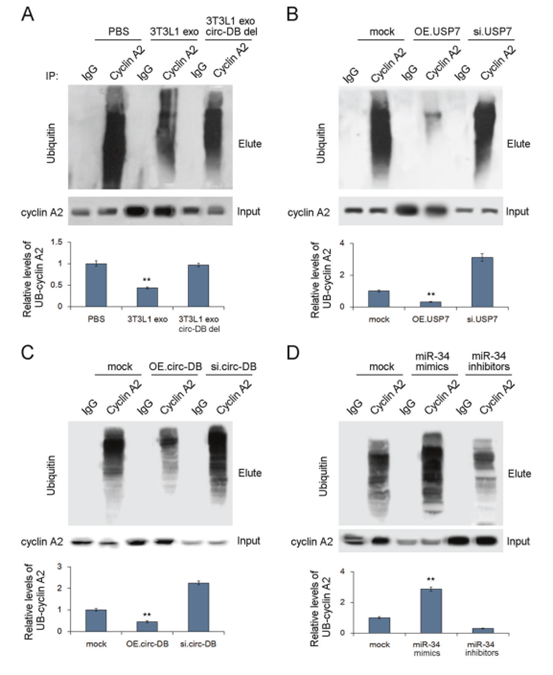
Fig. 8 Exo-circ-DB和USP7调控cyclin A2的去泛素化。按上述方法处理HCC细胞,免疫沉淀法分析其泛素化水平。a 3T3外泌体处理的HCC细胞中Cyclin A2泛素化的WB分析(n = 3)。 b 用USP7质粒或USP7 siRNA处理的肝癌细胞中Cyclin A2泛素化的WB分析(n = 3)。c circ-DB质粒或circ-DB siRNA处理的HCC细胞中Cyclin A2泛素化的WB分析(n = 3)。d miR-34a模拟物或miR-34a抑制剂处理的HCC细胞中Cyclin A2泛素化的WB分析(n = 3)。**p < 0.01
八、 circ-DB在体内增强肿瘤生长,提高体脂比
将肿瘤植入小鼠,观察脂肪细胞分泌的外泌体circRNA对体内肿瘤生长的影响。用慢病毒转染小鼠肝细胞癌细胞(Hepa1-6细胞),转染序列为circDB过表达(circ-DB-OE)或circ-DB shRNA (circ-DB-KD)。C57小鼠和ob/ob小鼠皮下植入肝细胞肿瘤细胞,PBS作为阴性对照。第28天处死小鼠,并对数据进行分析。
分析数据可知脂肪来源的外泌体可以在体内将circ-DB导入HCC肿瘤,脂肪分泌的circ-DB促进了肿瘤的生长和转移。
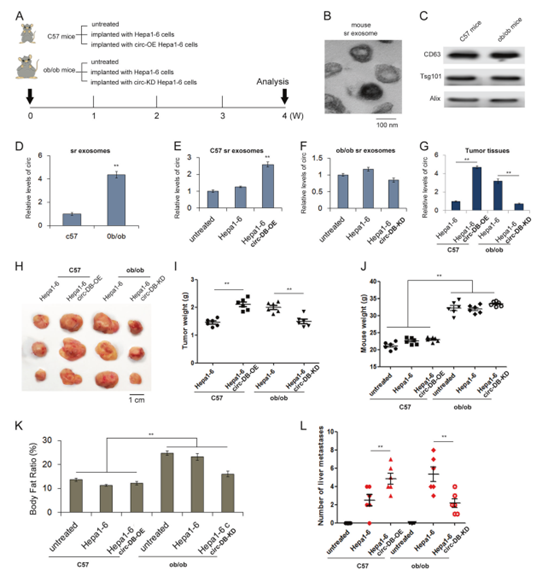
Fig. 9 a 外泌体circ-DB对小鼠肝癌模型的影响。按原理图描述的实验设计构建动物模型。 b 从小鼠血浆中分离的外泌体TEM照片。c 外泌体标记物的WB分析。d 未经处理的C57和ob/ob小鼠的血清外泌体中circ-DB的定量(n = 6)。e f C57小鼠(e)或ob/ob小鼠(f)血清外泌体中circ-DB的相对水平(n = 6)。g 肿瘤组织中circ-DB的相对水平(n = 6)。h 6组肿瘤照片(n = 6)。i–l 各组的肿瘤重量、小鼠体重、体脂比、肝转移数(n = 6)。 **p < 0.01
九、 circ-DB/miR-34a/USP7轴在小鼠肿瘤组织中的表达模式
这些数据进一步说明circ-DB在HCC肿瘤中作为miR-34a海绵发挥作用,miR-34a下调激活USP7/cyclin A2,导致肿瘤生长和转移增强。
结果:
综上所述,本研究证实脂肪细胞分泌的外泌体circRNA通过吸收miR-34a并激活USP7/Cyclin A2通路,在促进HCC肿瘤生长方面发挥重要作用。这些发现为理解脂肪组织和肝细胞癌之间的关系提供了深入的见解。






