单细胞测序首次揭示老年Neurogenic Niche的T细胞浸润
单细胞转录组测序技术发展迅速,在各个研究领域尤其是在发育、免疫和肿瘤方面的应用广泛,相关高水平文章也层出不穷。这里小编给大家分享一篇最近发表在Nature上的一篇关于在神经源龛(neurogenic niche)在衰老过程中运用单细胞测序技术检测其复杂细胞组成变化的文章(DOI: 10.1038/s41586-019-1362-5)。
在衰老过程中,各类组织的功能衰退是众所周知的事情。但这个过程中组织内的细胞组成变化却鲜为人知。作者提出这一问题后,选取了脑室下区(subventricular zone, SVZ) neurogenic niche部位为研究对象。这里是神经形成的地方,而且细胞类型众多,在衰老过程中功能逐渐衰退。下面是文章的技术路线。
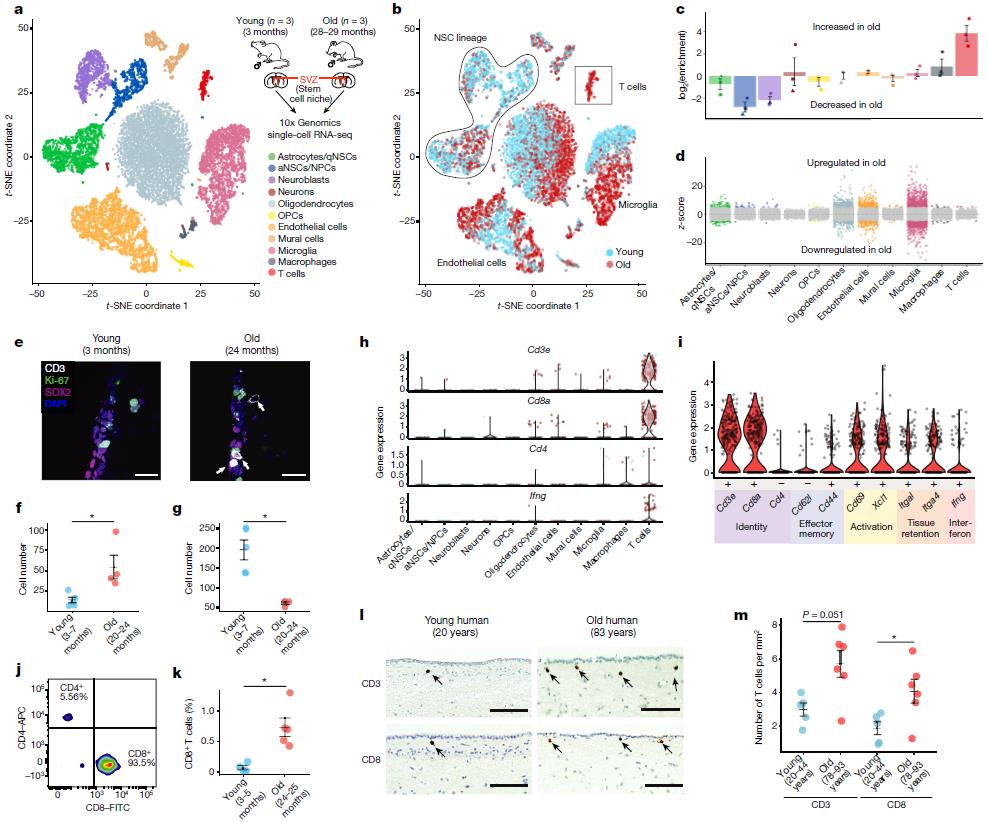
图1 单细胞测序揭示老年neurogenic niches中细胞组成变化并鉴定增加的T细胞类群
作者首先对3只3个月和3只28-29个月的小鼠该部位进行灌流后取材,流式分选去除破碎细胞后使用10X Genomics Chromium platform进行单细胞测序。他们得到了14,685个高质量的单细胞转录组数据。通过t-SNE分析,两组样品中一共发现了11种不同的细胞类型(星形胶质细胞、静息神经干细胞、活化神经干细胞、神经祖细胞、成神经细胞、神经元、少突细胞祖细胞、少突细胞、内皮细胞、周皮细胞、小胶质细胞、巨噬细胞和T细胞)。(图1 a)通过两组样品间比较,作者发现活化神经干细胞和神经祖细胞类群数量在老年组中显著减少;这与之前报道的结果一致。同时,他们发现T细胞类群基本只在老年组小鼠中出现(图1 b)。接下来作者对这些增加的T细胞进行深入研究。
作者首先通过CD3的免疫荧光染色检测了T细胞在该组织中的定位。通过与CD31(内皮细胞)、SOX2(神经干细胞)、Ki-67(增殖细胞)共染发现这些T细胞没有分布在血管中,而是在脑实质中,并且更靠近神经干细胞(图1 e)。那么这些T细胞的分子标志是怎样的呢?流式和测序结果分析发现这些细胞属于CD3+CD8+CD4− T细胞(图1 j),而且也表达CD44、Itgal、CD69和IFN-γ等(图1 i)。为了验证在人和小鼠中是否有同样的现象,作者在人脑切片样品中通过免疫组化检测了CD3和CD8的表达,发现老年人脑中对应的T细胞也显著多于年轻人(图1 l m)。
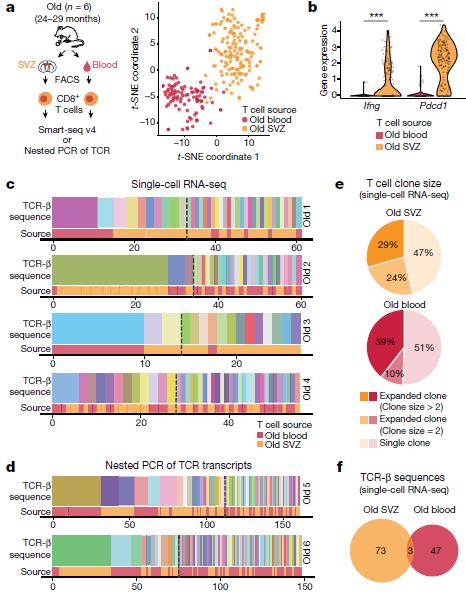
图2 单细胞测序和巢式PCR鉴定血液和脑中T细胞的克隆差异
那么脑中出现的T细胞来源于哪呢?是否是因衰老过程中血脑屏障功能减弱而从血液中被动扩散而来呢?作者对老年小鼠血液中的CD8+T细胞和neurogenic niches中的T细胞进行了Smart-seq V4单细胞测序和TCR Nested PCR。结果发现同一老年小鼠血液和脑中的CD8+T细胞类群差异很大(图2 a),例如neurogenic niches中的T细胞高表达IFN-γ和PD-1(图2 b)。而TCR-β的序列分析显示它们多数经克隆扩增而来,但血液和neurogenic niches中T细胞克隆并不相同(图2 f)。因此作者认为neurogenic niches中的T细胞并不是血液中的T细胞简单的被动扩散而来,有可能是识别了老年小鼠脑中的某种抗原。
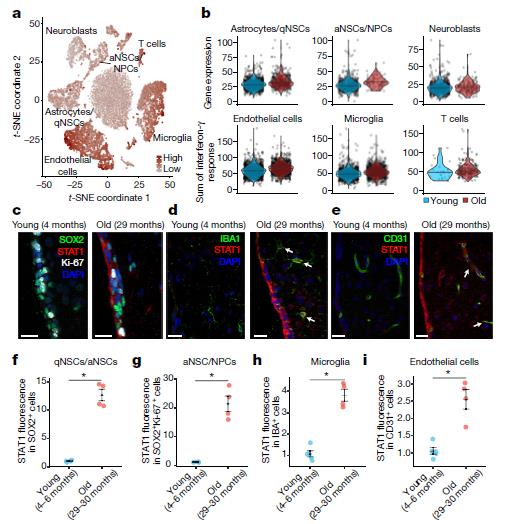
图3 Neurogenic niche有干扰素信号通路激活
接下来,作者进一步研究了这个T细胞类群对neurogenic niche的影响。有报道检测了干扰素对大脑发育和neurogenic niche的影响,但仍没有结果。作者根据单细胞测序结果找出表达IFN-γ受体的细胞类群(星形胶质细胞、静息神经干细胞、活化神经干细胞、神经祖细胞、内皮细胞和小胶质细胞),发现了在这些细胞类群中IFN-γ通路相关基因的表达量更高(图3 a),而且在老年组中也显著高于年轻组(图3 f g h i)。通过数据分析并实验验证,作者找到BST2作为IFN-γ反应的分子标志。通过分选BST2阳性和阴性的细胞分别进行常规转录组测序分析发现BST2阳性的细胞富集的信号通路主要是干扰素反应通路,而BST2阴性的细胞富集通路主要与细胞周期相关(图4 b)。接下来,作者通过T细胞和神经干细胞的共培养验证了这一调节作用。T细胞处理后的神经干细胞BST2表达量显著上升,增殖能力也显著下降(图4 g h i)。
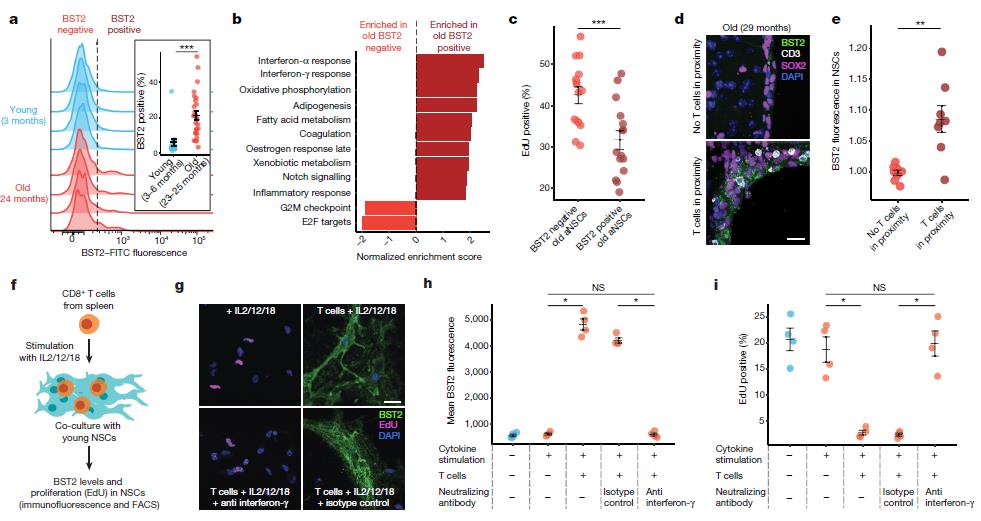
图4 T细胞通过IFN-γ信号通路抑制神经干细胞增殖
这是一篇通过单细胞转录组测序发现新的细胞类群并深入研究其功能的代表性文章,值得大家学习参考。其中细胞类群检测采用了10X Genomics Chromium platform的方法,属于mRNA 3’端测序,商业化体系已非常完善;而另一种Smart-seq V4单细胞测序则是针对全长mRNA。






