条条大路通罗马,这条回路向肝癌
LncRNA与癌症的捆绑研究已不算少见,最近,Cancer Research (IF=8.378)上发表了一篇名为“LncRNA SNHG10 Facilitates Hepatocarcinogenesis and Metastasis by Modulating Its Homolog SCARNA13 via a Positive Feedback Loop”的文章,文章的作者们通过一系列的实验,发现了在肝癌发生和转移过程中存在的一个复杂回路,揭示了LncRNA SNHG10是如何通过正反馈环调节其同源SCARNA13,以促进肝癌的发生和转移的,为肝癌的治疗提供了一条新的清晰思路。
![说明: C:\Users\y505\Desktop\LncRNA SNHG10 Facilitates Hepatocarcinogenesis and Metastasis by Modulating Its Homolog SCARNA13 via a Positive Feedback Loop\8HG]K@)W8Y`[KTEFX4P}~`3.png](https://img1.dxycdn.com/2019/0826/209/3364637808052036261-14.jpg)
摘要:
弄清非编码RNA(ncRNA)在肿瘤发生和转移过程中的作用可以为疾病诊断和靶向治疗开辟新的途径。本次研究以鉴别肝细胞癌(HCC)特异性ncRNA并研究其在肝癌发生和转移过程中的作用为目标。肺转移引起的异种移植物的RNA-seq鉴定出的长链非编码RNA小核仁RNA宿主基因10(SNHG10)及其同源SCARNA13,是HCC发展和转移的新驱动因子。在64例HCC中,SNHG10的表达与SCARNA13的表达程正相关,且SNHG10或SCARNA13的高表达与总生存期差有关。在过表达或敲除SNHG10后,SCARNA13分别表现出明显的升高和下降,我们猜测SNHG10可能是SCARNA13的上游调控因子。SNHG10和SCARNA13协同促进HCC细胞的恶性表型,其中SNHG10充当miR-150-5p的海绵,并与RPL4 mRNA相互作用,以增强c-Myb的表达和活性。反之,c-Myb的上调和超激活通过调控SNHG10启动子活性,形成正反馈环,持续刺激SCARNA13表达,从而增强SNHG10和SCARNA13的表达。SCARNA13介导SNHG10驱动的HCC细胞增殖、侵袭和迁移,并通过调节SOX9促进HCC细胞的细胞周期和上皮-间质转化。总体而言,我们发现在肝癌发生和转移过程中,SNHG10及其同源物SCARNA13的伴随上调背后的一个复杂回路。
意义:这些发现揭示了非编码RNA在肝细胞癌发生和转移中的作用。
结果:
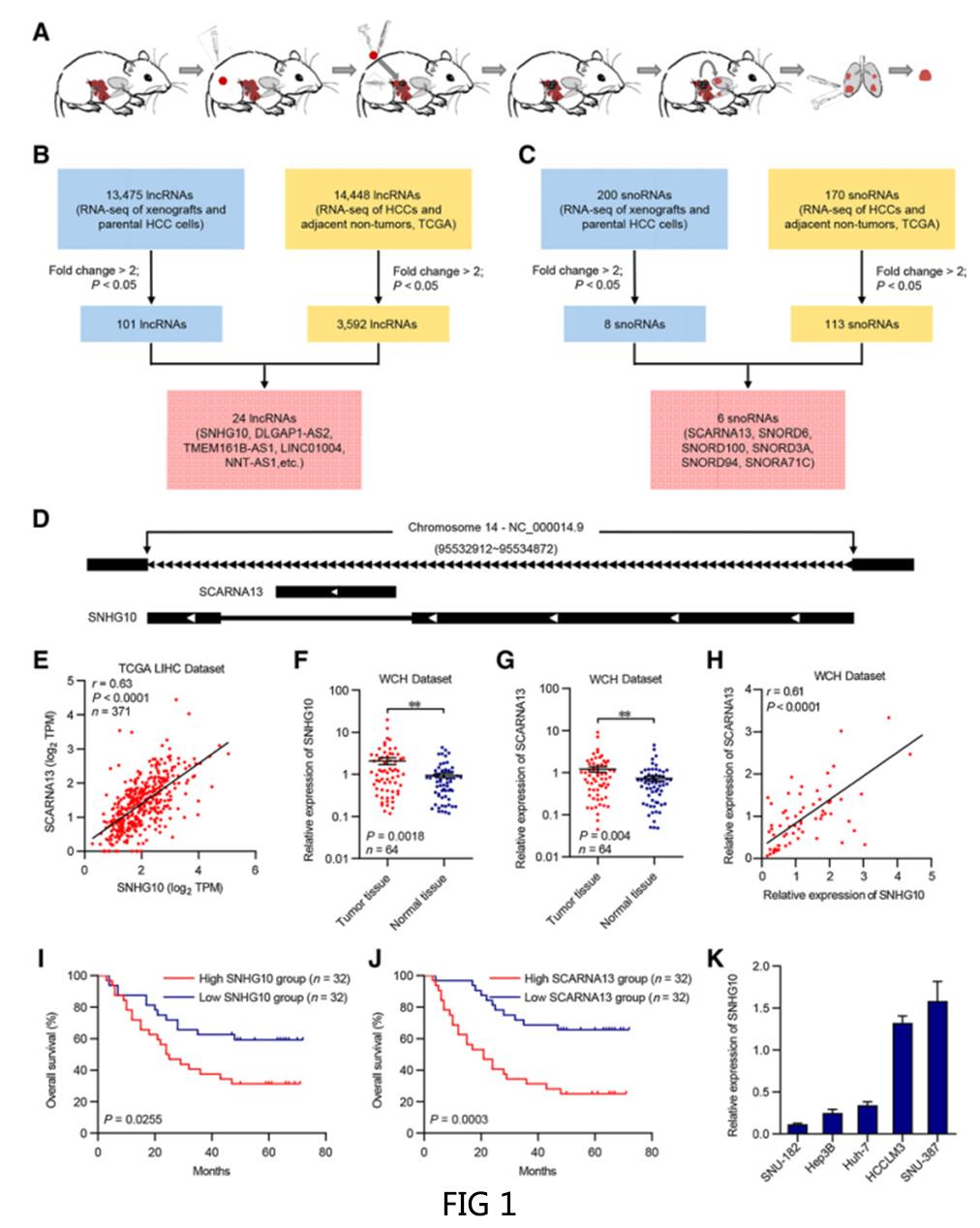
一.SNHG10和SCARNA13在肺转移灶和HCC组织中升高,并且与HCC患者的不良预后相关
为鉴定参与HCC转移的ncRNAs,研究者首先建立肺转移筛查小鼠模型(图1A),通过RNA-seq结果与TCGA LIHC数据存储库的交集选择候选lncRNA和snoRNA (图1B,1C)。通过交叉,24个lncRNAs和6个snoRNAs被认为可能在HCC的形成和转移中起重要作用。研究者发现在这些异常表达的基因中有SNHG10和SCARNA13,它们是同一初级RNA转录本的不同产物,SCARNA13是从SNHG10基因的初级RNA转录本的内含子加工而成的,而外显子被剪接到SNHG10转录本中(图1D)。SCARNA13的表达与SNHG10的表达具有统计学相关性(图1E)。采用qPCR方法检测64对HCC组织及癌旁正常组织中SNHG10和SCARNA13的表达,HCC组织中SNHG10和SCARNA13水平均高于癌旁正常组织(图1F和G),并且二者之间存在统计学上的正相关关系(图1H)。Kaplan-Meier分析显示SNHG10或SCARNA13的高表达与较差的总生存率显著相关(图1I和J)。用qPCR方法检测SNHG10在5种不同肝癌细胞系中的表达,与其他细胞相比,HCCLM3和SNU-387细胞的SNHG10表达相对较高(图1K)。这些结果表明SNHG10可能是SCARNA13的上游调控因子。(数据采用Mean±SEM表示。** , P < 0.01.)
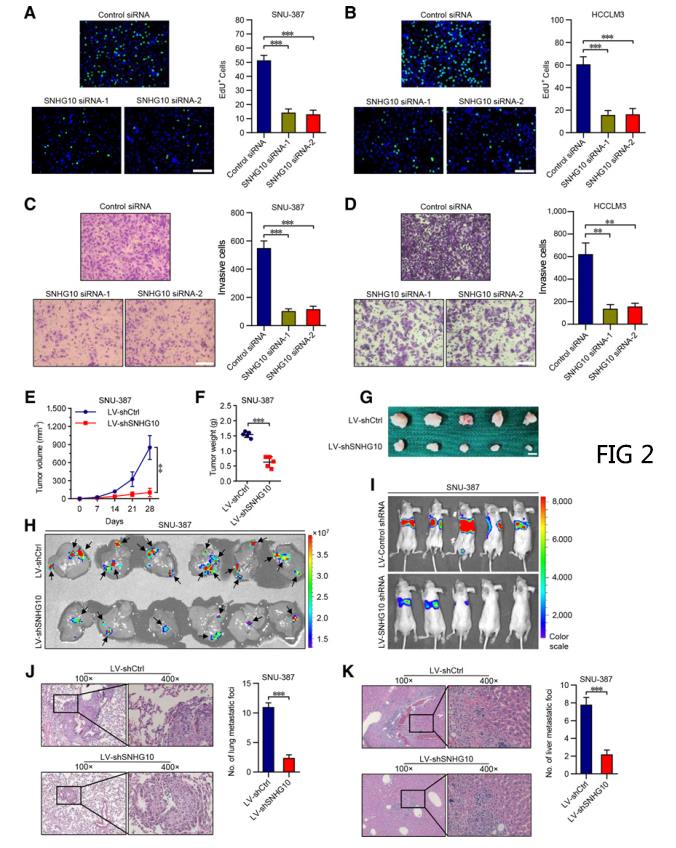
二.SNHG10促进HCC细胞的形成和转移
EDU免疫荧光染色分析结果显示,SNHG10的损耗显著抑制SNU-387和HCCLM3细胞周期和增殖,并诱导凋亡(图2A和B)。Transwell侵袭试验结果显示SNHG10沉默极大地削弱了SNU-387和HCCLM3细胞的侵袭和迁移能力(图2C和D)。为进一步研究SNHG10对肝癌细胞的体内致瘤作用,研究者将SNU-387和HCCLM3细胞皮下注射到裸鼠体内。LV-shSNHG10组肿瘤的体积和重量均显著低于LV-shCtrl组(图2E-G)。构建用于肝转移检测的原位移植模型以评估SNHG10对肝癌细胞转移的促进作用,与LV-shCtrl组相比,LV-shSNHG10组肝转移结节的荧光素酶信号强度显着降低(图2H),证明SNHG10增强了HCC细胞的肝内转移能力。最后,用萤火虫荧光素酶标记SNU-387和HCCLM3细胞,直接接种裸鼠尾静脉进行肺转移检测,LV-shSNHG10组小鼠的荧光素酶信号强度明显低于LV-shCtrl组(图2I),说明SNHG10可促进HCC细胞的肺转移潜能。H&E染色显示LV-shSNHG10组肺和肝脏组织切片中的转移灶显着减少(图2J和K)。(数据采用Mean±SEM表示。** , P < 0.01; *** , P < 0.001.)
三.SCARNA13促进HCC细胞的肿瘤发生和转移
由于SCARNA13和SNHG10在HCC组织中同时上调,研究者们评估了SCARNA13对HCC细胞恶性表型的影响。与SNHG10相似,敲除SCARNA13极大地抑制了细胞周期和增殖,并诱导SNU-387和HCCLM3凋亡(图3A-H)。此外,SCARNA13的下调大大削弱了SNU-387和HCCLM3细胞的侵袭和迁移能力(图3I-L)。这些结果表明SCARNA13是HCC中的致癌启动子。
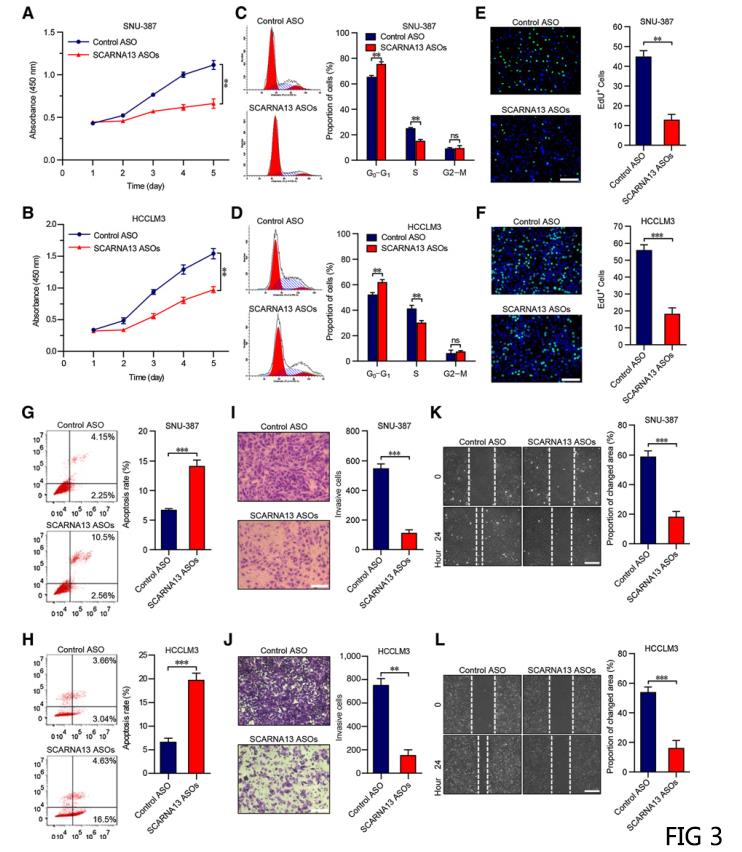
Figure 3.抑制SCARNA13阻碍HCC细胞在体外的增殖和转移。A and B, CCK-8检测转染SCARNA13 ASOs或对照组的SNU-387和HCCLM3细胞。C and D, 用碘化丙啶染色检测转染SCARNA13 ASOs或对照组的SNU-387和HCCLM3细胞的细胞周期分布,并进行流式细胞术分析。E and F, 对转染SCARNA13 ASOS或对照组的SNU-387和HCCLM3细胞进行EDU免疫荧光染色分析。比例尺,100μm。G and H, 采用FITC-Annexin V和碘化丙钠染色法检测转染SCARNA13 ASOs或对照组的SNU-387和HCCLM3细胞的凋亡情况,并进行流式细胞术分析。 I and J, 转染SCARNA13 ASOS或对照组的SNU-387和HCCLM3细胞的Transwell侵袭试验。比例尺,100μm. K and L, 转染SCARNA13 ASOS或对照组的SNU-387和HCCLM3细胞的伤口愈合迁移试验。比例尺,100μm。数据采用Mean±SEM表示。ns,不显著;** , P < 0.01; *** , P < 0.001。
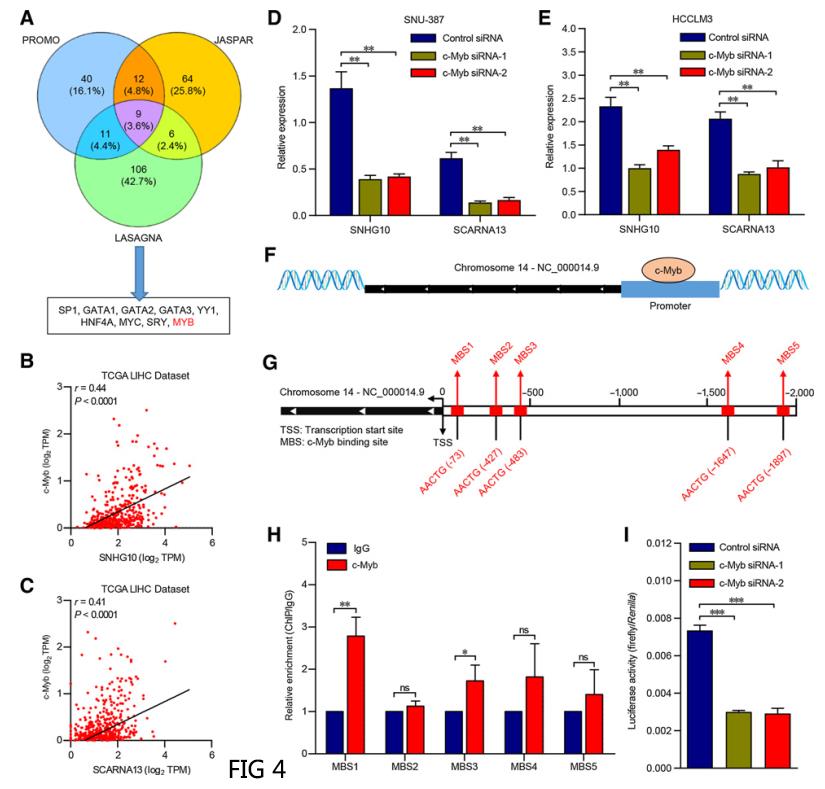
四、转录因子c-Myb上调SNHG10和SCARNA13水平
转录因子(TF)在识别和动态结合位于启动子的简并序列基序中的作用在转录中起着关键作用。研究者推测某些TF是否导致SNHG10和SCARNA13的异常表达。通过Jaspar、PROMO和LASAGNA数据库的交集确定了9个可能与SNHG10基因的启动子区域结合的TFs(图4A)。对TCGA LIHC数据集的分析表明,在9个TF中,c-Myb表达与SNHG10和SCARNA13表达相关性最高(图4B和C)。c-Myb的敲除显著降低了SNU-387和HCCLM3细胞中SNHG10和SCARNA13的表达(图4D和E),c-Myb是SNHG10和SCARNA13的上游调节因子。生物信息学分析预测SNHG10的启动子区域中有5个c-Myb结合位点(MBS)(图4F和G)。ChIP分析证实c-Myb在SNHG10启动子区域的MBS1和MBS3上显著高富集(图4H)。为了进一步确定c-Myb在SNHG10基因启动子上的转录激活,将SNHG10启动子荧光素酶报告基因(pEZX-PL01-SNHG10)和靶向c-Myb的siRNA共转染细胞。c-Myb的缺失显着降低了HEK293T细胞中SNHG10启动子的活性(图4I)(数据采用Mean±SEM表示。ns,不显著;* ,P < 0.05; *** , P < 0.01; *** , P < 0.001)。这些数据表明c-Myb可以直接与SNHG10的启动子区域结合,导致SNHG10和SCARNA13在HCC细胞中的上调。
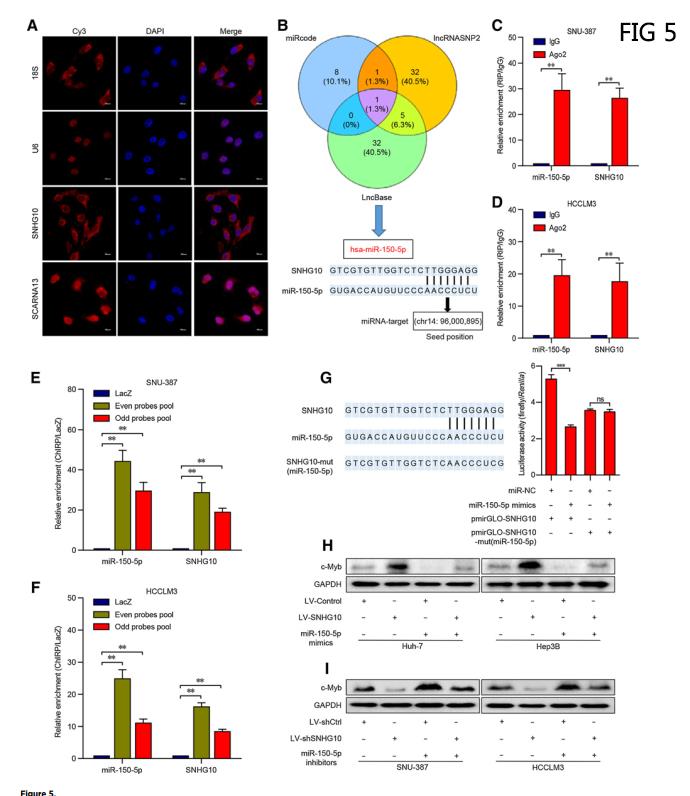
五、SNHG10作为miR-150-5p的海绵增加c-Myb的表达
使用RNA FISH以确认SNHG10和SCARNA13的定位,发现SNHG10主要定位于细胞质,而SCARNA13优先位于细胞核(图5A)。细胞质lncRNAs可以作为竞争内源性RNA(ceRNA)来隔离miRNAs,导致相应的miRNA靶向mRNAs的释放。利用生物信息学分析预测SNHG10与miR-150-5p之间的结合位点。(图5B)。RIP检测SNU-387和HCCLM3细胞中SNHG10和miR-150-5p在Ago2上相对于IgG的富集情况,以验证SNHG10和miR-150-5p是否参与RNA诱导的沉默复合物(RISC) (图5C和D)。ChiRP分析在SNU-387和HCCLM3细胞中SNHG10和miR-150-5p在偶数和奇数探针池中相对于设置的对照LacZ探针的富集情况,以确定SNHG10与miR-150-5p之间的直接相互作用 (图5E和F)。miR-150-5p mimics的转染显著抑制了含有全长SNHG10的pmirGLO-SNHG10在Rluc的30个UTR处的荧光素酶活性。相反,pmirGLO-SNHG10-mut(miR-150-5p)对miR-150-5p(图5G)没有反应。Western blot分析在miR-150-5p模拟物或抑制剂作用下的HCC细胞中的c-Myb (图5H ,5I)。这些发现表明SNHG10作为miR-150-5p的海绵,可以降低其对c-Myb的抑制作用,从而增强c-Myb的表达。
六、SNHG10通过miR-150-5p/RPL4-c-Myb-正反馈环调节SCARNA13的表达
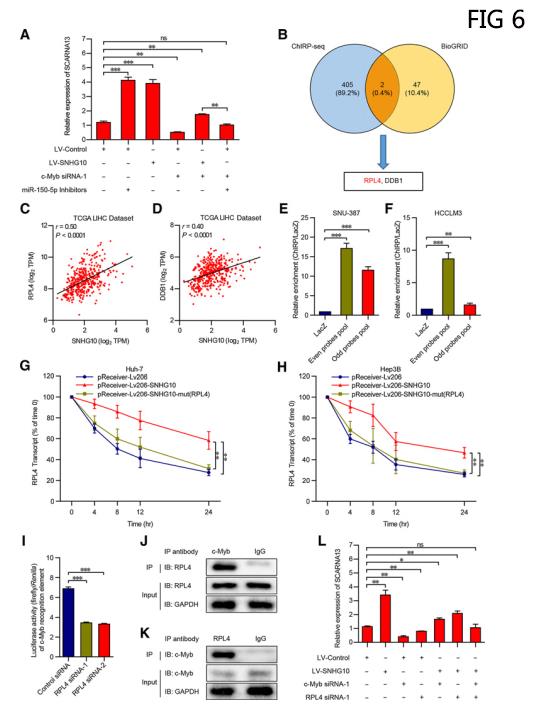
CARNA13是由SNHG10,miR-150-5p和c-Myb组成的正反馈环的下游效应器。
当c-Myb siRNA在RNA和蛋白质水平上完全逆转LV-SNHG10细胞中的c-Myb上调时,SCARNA13的表达在统计学上仍高于以前,这暗示SNHG10可能不仅仅通过调节c-Myb的表达来调节SCARNA13,此后,通过进一步的挽救实验发现,当与miR-150-5p抑制剂和c-Myb siRNA共转染后,LV-Control细胞中c-Myb的表达在RNA和蛋白质水平上保持稳定,SCARNA13的表达没有明显变化(图6A),由此可见,c-Myb的表达水平是SNHG10过表达导致SCARNA13表达上调的部分原因。研究者推测SNHG10结合的某些mRNAs可能调节c-Myb的功能活性,因此从chirp-seq结果与BioGRID交互数据库的交叉点中筛选出RPL4和DDB1。(图6B)。与DDB1相比,在TCGA LIHC数据集中,RPL4与SNHG10显示出明显更高的相关性(图6C和D)。Chirp法检测在SNU-387和HCCLM3细胞中RPL4 mRNA在偶数和奇数探针池中相对于设置的对照LacZ探针的富集程度(图6E和F)。用Dactinomycin处理SNU-387和HCCLM3细胞,以阻断新RNA的合成,并在24小时内测量RPL4的丢失百分比。研究结果表明,SNHG10的过度表达延长了RPL4 mRNA的半衰期(图6G和H)。研究者构建含有c-Myb识别元件(MRE)的荧光素酶报告基因以评价RPL4对肝癌细胞中c-Myb功能活性的正向调控作用。荧光素酶报告分析显示RPL4可以增强MRE的活性(图6I)。共免疫沉淀试验以确定RPL4与c-Myb之间的相互作用,验证了RPL4在抗c-Myb组中的富集程度显著高于IgG组(图6J)。反之,与IgG组相比,抗RPL4组的c-Myb丰度显著增加(图6k)。进一步的抢救实验表明,在与c-Myb siRNA和RPL4 siRNA共转染后,SCARNA13的表达在LV-SNHG10细胞中没有任何统计学变化(图6L)。这些数据表明,SNHG10一方面通过吸收miR-150-5p促进c-Myb的表达,另一方面通过与RPL4相互作用增强c-Myb的转录活性,从而调节SCARNA13的表达。(数据采用Mean±SEM表示。ns,不显著;* , P < 0.05; ** , P < 0.01; *** , P < 0.001.)
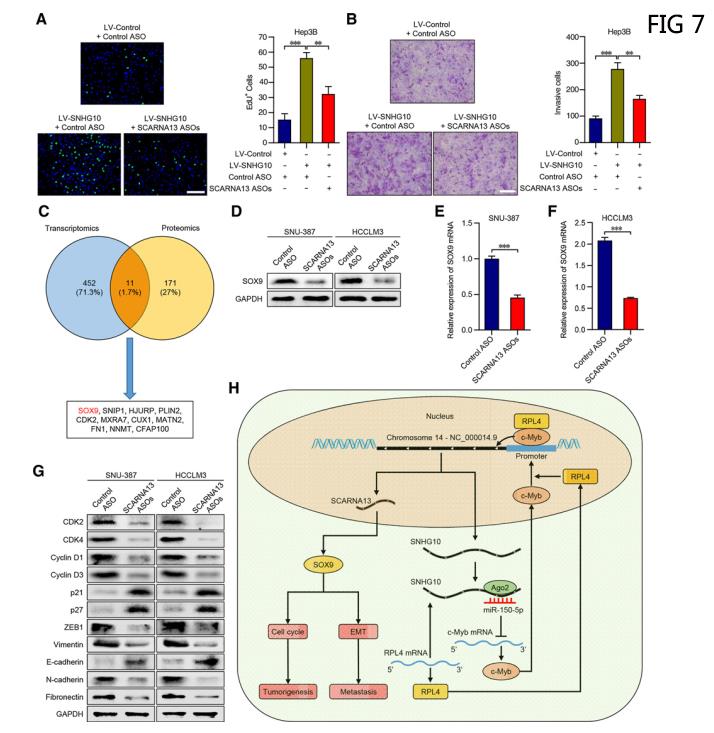
七、SCARNA13通过调节SOX9介导SNHG10驱动的HCC细胞增殖、侵袭和迁移
将SCARNA13 ASO转染到LV-SNHG10细胞,EDU免疫荧光染色检测和Transwell侵袭实验发现敲除SCARNA13显著挽救了SNHG10过表达对细胞增殖、侵袭和迁移的影响(图7A和B)。通过转录学和蛋白质组学的交叉鉴定了11个SCARNA13的下游基因。(图7C)。其中SOX9的表达在SCARNA13敲除后在蛋白质水平上表现出最显著的下降。SCAR转染SCARNA13 ASOs或对照组的SNU-387和HCCLM3细胞中,SOX9在RNA和蛋白水平上的表达显著降低(图7D-F)。Western blot分析转染SCARNA13 ASOs或对照组的SNU-387和HCCLM3细胞的细胞周期和EMT的分子标记(图7G)。这些发现说明SNHG10对肿瘤发生和转移的促进作用是通过SCARNA13介导的,SCARNA13通过上调HCC细胞中的SOX9来促进细胞周期和EMT。
(图7H)肝癌细胞中SNHG10和SCARNA13同时上调的复杂电路的示意图模型。(数据采用Mean±SEM表示。** , P < 0.01; *** , P < 0.001)
结论:
研究者在HCC中发现了一个复杂的回路,它与肝癌中SNHG10及其同源SCARNA13的上调有关。SNHG10通过海绵miR-150-5p并与RPL4 mRNA相互作用调节c-Myb,调节HCC细胞中SCARNA13及其下游效应子SOX9的表达。






