科研者必带武器-pull down 技术
作为生命活动的主要承担者,蛋白质参与各类生命现象,大部分蛋白质在行使功能的时候并不是单打独斗的,蛋白质们相互联系一起工作,彼此形成了复杂的生化网络。因此,研究蛋白质的相互作用成为研究蛋白质功能和作用机制的最为重要的环节之一。蛋白-蛋白互作的各类研究技术方法层出不穷。这里,小编来浅谈下蛋白质相互作用技术中一种比较经典的实验技术- pull down 实验。
pull down 实验又叫做蛋白质体外结合实验(binding assay in vitro),是一个行之有效的验证酵母双杂交系统的体外试验技术。用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。带标签的诱饵蛋白能被特异结合该标签的固相亲和配基捕获,形成次级亲和支持物”,用于纯化与诱饵蛋白相互作用的其他蛋白。纯化产物洗脱后,经Western blot验证或LC-MS/MS,即可证明或鉴定与诱饵蛋白互作的蛋白。
这里,小编重点介绍下应用最广泛的GST - pull down。其利用了GST(Glutathione S transferase)对GTH(Glutathione)的亲和性,将靶蛋白-GST融合蛋白亲和固化在GTH亲和树脂上,作为与目的蛋白亲和的支撑物,充当一种“诱饵蛋白”,当蛋白溶液通过层析柱或与此固相复合物混合时,可从中捕获与之相互作用的“捕获蛋白”,洗脱结合物后可通过SDS-PAGE电泳分析,从而证实两种蛋白间的相互作用或筛选相应的目的蛋白。“诱饵蛋白”一般采用原核表达获得,“捕获蛋白”可通过细胞裂解物、纯化的蛋白、表达系统以及体外转录翻译系统等方法获得。
实验流程:
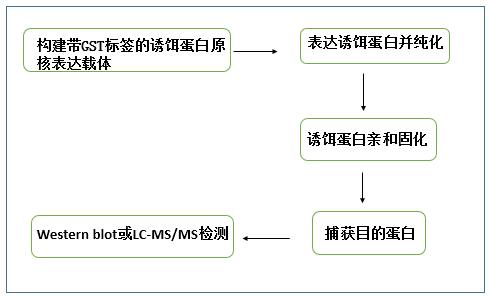
应用:通过GST融合蛋白pull-down技术一是鉴定能与已知融合蛋白相互作用的未知蛋白质;二是鉴定两个已知蛋白质之间是否存在相互作用。
高准确性,高灵敏度。适合中度复杂的蛋白质样品,如相互作用的蛋白质条带和洗脱液;
Tips:
1.若要验证某蛋白X与诱饵蛋白的相互作用,可将蛋白复合物与X蛋白的抗体孵育,做Western blot验证即可;如要寻找诱饵蛋白可能的互作蛋白,则需将蛋白复合物做LC-MS/MS鉴定。
2.高纯度的GST融合蛋白能够减少实验的假阳性。为了能够最大程度的保证融合蛋白原有的生物学活性,一般在获取融合蛋白时倾向于获取可溶性融合蛋白。(获得条件主要有:载体的选择、可溶性蛋白表达条件的选择、诱导温度、诱导时间、诱导物的浓度)
3.内源性蛋白的干扰使得实验出现的假阳性结果较多。关于实验设计,需要严谨,对照的设计,实验重现性,bait-prey 的互换等等都需要在做实验之前认真探讨和考虑。
4. 实验一般用于体外转录或翻译体系,如酵母双杂交系统中检测蛋白质之间的相互作用。但并不一定能真实的反应蛋白质之间的相互作用,因为在体内它们不一定空间上有碰到,所以并不意味着在生理条件下一定结合。
Pull down技术研究蛋白互作的方法不仅强大,而且高效快速,操作简便,可直接检测是否具有相互作用。这项实验技术有利有弊,但不可否认的是,它一定是科研者必带武器,权衡使用一定能帮助大家的科研之路越来越顺利。






