疟疾?不可怕,先来看看m6A甲基化演个什么角
参考文献:
Baumgarten Sebastian., Bryant Jessica M., Sinha Ameya., Reyser Thibaud., Preiser Peter R., Dedon Peter C., Scherf Artur., (2019). Transcriptome-wide dynamics of extensive mA mRNA methylation during Plasmodium falciparum blood-stage development. Nat Microbiol, 08. IF:14.3
导语:
疟疾夺去了许多人的生病,它的发病机理是由于恶性疟原虫在人体红细胞内的无性繁殖造成的,这个过程发生在疟疾虫短暂的48小时生命中,并需要精确的基因表达级联才能完成。虽然目前已经在转录后水平观察到这种反应,但是在转录组范围的介导机制并不清楚。因此作者在恶性疟原虫转录组中鉴定了mRNA修饰,并在血液阶段发育过程中对N6-甲基腺苷(m6A)进行了全面表征。该研究展示了疟疾寄生虫中广泛的m6A mRNA甲基化程序的独特特征,并揭示其在动态微调单细胞真核生物的转录级联中的关键作用。
结果分析:
1、鉴定恶性疟原虫在blood-stage阶段的动态m6A甲基化程序
图示恶性疟原虫在人红细胞内的无性繁殖周期,包括红细胞侵入、宿主细胞重构、分裂复制和红细胞排出(图1a)。在分析红细胞内的发展周期(IDC)中鉴定出10个在mRNA的修饰(图1b,c,d)。虽然m6A甲基化的程度总体都很高,但是在疟原虫中更高(图1e)。
恶性疟原虫基因组编码m6A mRNA甲基转移酶的高度保守(图2a),这个保守去编码的蛋白命名为PfMT-A70,构建了包含HA标签的PfMT-A70蛋白表达细胞系(图1b)。对PfMT-A70-HA进行免疫沉淀,然后进行LC-MS,鉴定出16种特异性蛋白(图2c,d)。三种恶性疟原虫的转录水平都在12和24h.p.i时达到高峰,比m6A/A比率最高时早一点(图1e,2e)。
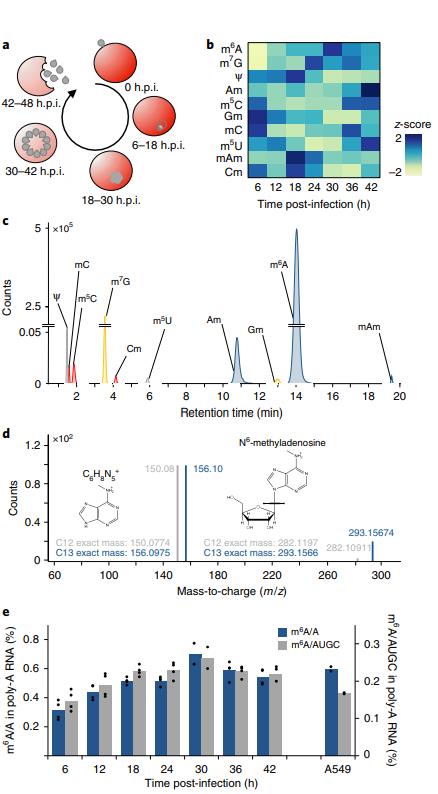
图1恶性疟原虫红细胞内部(IDC)发mRNA修饰全局动态
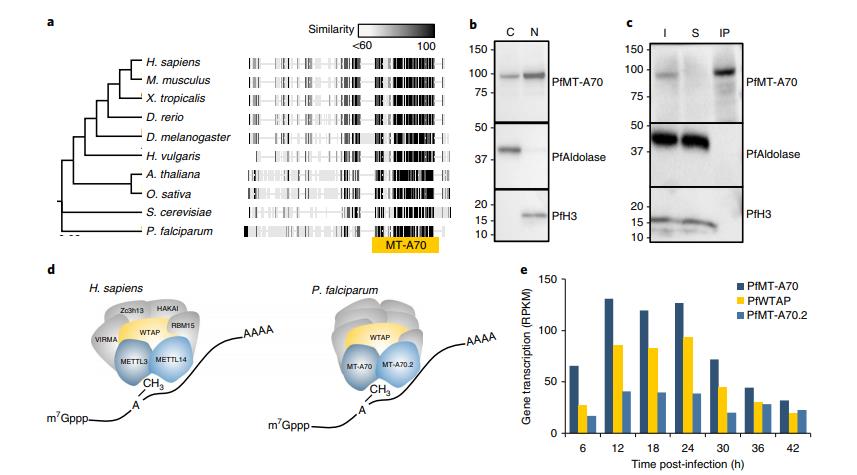
图2 恶性疟原虫m6A书写复合体的特征
2、PfMT-A70的CRISPR干扰降低了整体m6A mRNA甲基化
对于PfMT-A70的CRISPRi,我们将其启动子定位于转录起始位点下游和翻译起始位点上游~100bp,gRNA与非模板链互补,非特异性的gRNA表达细胞系作为阴性对照(图3a)。gPfMT-A70靶向dCas9染色质免疫沉淀,然后测序(ChIPseq)在靶点显示出强大且高度特异性的富集,其与富含H3K9ac5和H2A.Z33的核小体缺失区域(FAIRE)重叠(即标志恶性疟原虫启动子区域;图3b,c)。RT-qPCR表明整个IDC中PfMT-A70转录水平显著下调,在12h.p.i时敲低水平为~15%,在24和36h.p.i时达到40% (图3d,顶部)。 虽然PfMT-A70 CRISPRi对寄生虫生长没有明显的影响,但LC-MS / MS显示在所有三个时间点m6A / A整体水平显著下降10-30%(图3d, 底部),进一步确定PfMT-A70是恶性疟原虫m6A书写复合体的组成部分。
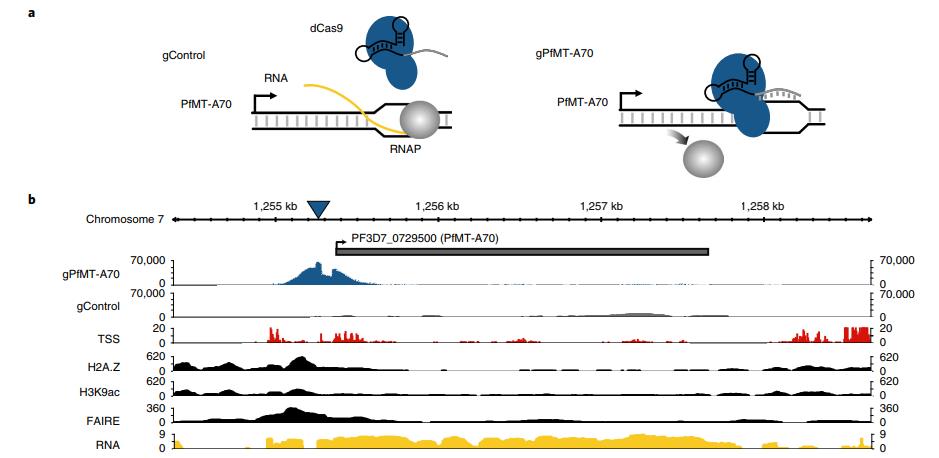
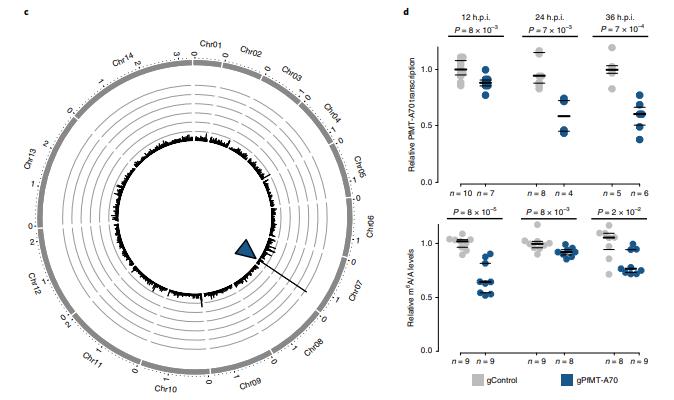
图3通过CRISPRi敲低PfMT-A70 m6A甲基转移酶
3、在IDC期间,mRNA转录物差异地m6A-甲基化
作者使用m6A-甲基化mRNA免疫沉淀(IP)和m6A-seq测定了IDC的转录物特异性水平上m6A mRNA甲基化的动态。 m6A-IP及LC-MS / MS显示抗体特异性高(图4a)。与后生动物和植物中m6A位点的拓扑结构相反,恶性疟原虫中的m6A峰不会在终止密码子和3'UTR附近富集,而表现出向5'末端定位的趋势(图4b,c)。作者搜索了与m6A峰相关的序列,发现GGACA基序最显著富集,该基序类似于在酵母和人m6A位点处鉴定的RGAC和DRACH(D = G / A / U,R = G / A,H = C / A / U)基序(图4d)。GAC基序集中在m6A峰顶周围的±20nt区域(图4e),表明特定m6A甲基化的某些背景依赖性。
在整个IDC中,具有至少一个m6A峰的转录基因总数略有增加(图4f)。 然而,m6A富集(即m6A-IP / m6A-输入),或来自含有特定m6A峰的一个基因的转录物的部分,在整个IDC中发生了广泛的变化(图4g)。 大多数m6A峰仅在一个时间点达到最大m6A富集,表明转录特异性甲基化确实是一种主动调节机制。
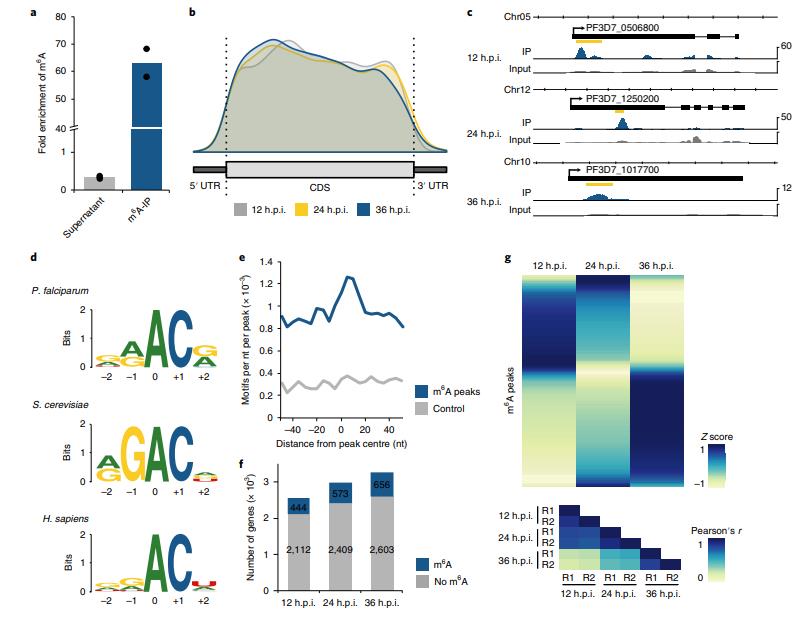
图4 恶性疟原虫IDC期间的差异m6A甲基化
4、m6A与mRNA稳定性和翻译效率成反比关系
为了确定m6A对个体转录本的影响,首先比较gControl和gPfMT-A70寄生虫之间各个m6A峰的m6A富集,并发现gPfMT-A70细胞系中所有时间点的富集都显著减少(图5a,b,顶部)。通过LC-MS / MS测量的gPfMTA70寄生虫中全局m6A / A水平的降低来反映。(图3d,底部)。 gControl和gPfMT-A70在每个时间点显示高度相关性(图5b,底部)。
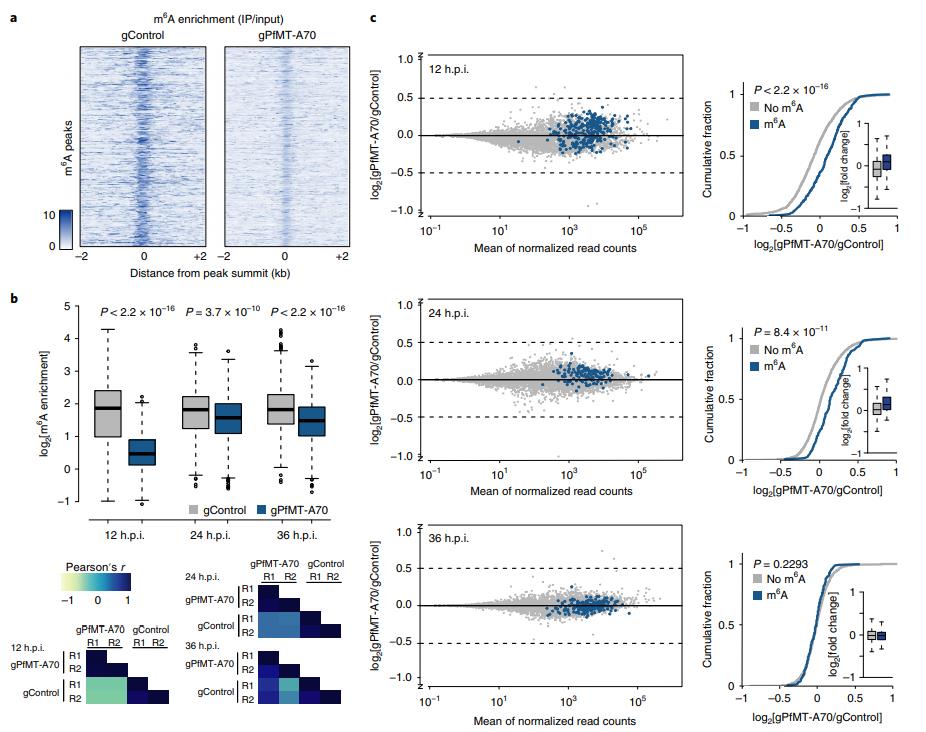
图5 PfMT-A70基因敲除导致m6A甲基化转录本的上调
m6A-甲基化转录物具有比非甲基化转录物显著更低的mRNA稳定性(图6a,左)。 这些差异在12和24h.p.i显著,但在36h.p.i时不显著。在12和24h.p.i时,‘m6A敏感’转录物的mRNA稳定性甚至更低(m6A富集减少两倍,转录本丰度增加(图6a,右)。比较整个IDC中m6A-甲基化和非甲基化转录物之间的翻译效率(TE)。在每个发育阶段,m6A甲基化与转录物的翻译效率显著降低相关(图6b,左)。这种相关性在12和24h.p.i时最为明显,但在36h.p.i时仍然显著。 与mRNA稳定性所见的模式类似,在12和24h.p.i时m6A甲基化和‘m6A敏感’转录物子集之间的翻译效率的显著降低(图6b,右)。
5、恶性疟原虫编码进化上保守的,多样化的m6A结合蛋白
恶性疟原虫基因组编码含有YTH结构域的两种不同蛋白质:PfYTH.1(PF3D7_1419900,此前注释为‘切割和多聚腺苷酸化特异性因子亚基4’,CPSF4)和PfYTH.2(PF3D7_0309800,图6c)。PfYTH.2与其他已知m6A读取蛋白的没有总体相似性。两种蛋白质在IDC早期高度表达(图6d),并且PfYTH.1的异位表达揭示了蛋白质在细胞核和细胞质中的定位(图6e)。与IDC期间的动态表达相比,PfYTH.2在寄生虫的传播阶段表现出甚至更高的表达,即配子体和唾液腺子孢子,后者也高度表达PfMT-A70(图6d)。
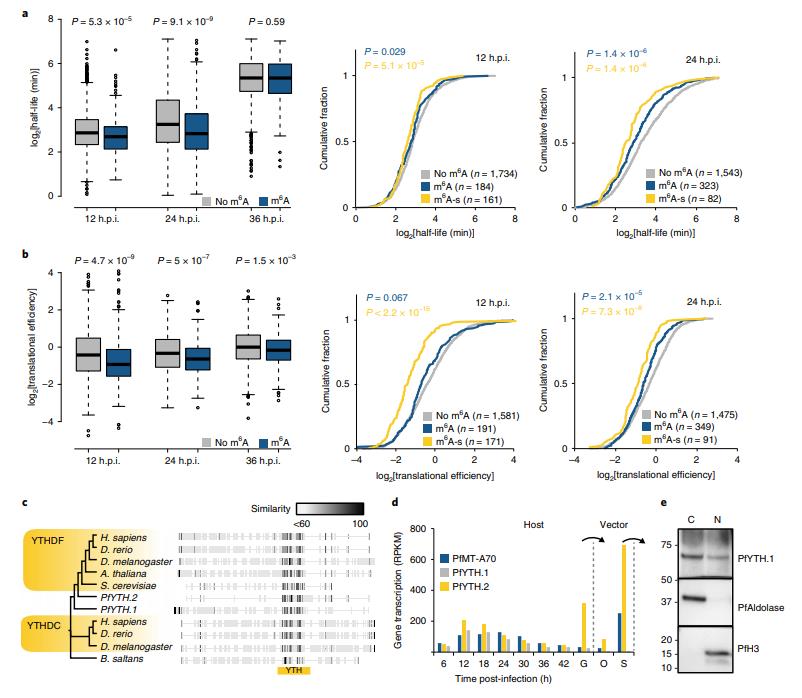
图6 m6A与mRNA稳定性及翻译效率的关系
结语:
该研究揭示了恶性疟原虫中基因表达的另一层动态和广泛的转录后调节。 m6A mRNA甲基化的核心特征的保守性使恶性疟原虫成为研究m6A甲基化和基因转录之间相互作用的优良系统。此外,该研究将m6A作为疟疾寄生虫“上皮转录组”代码的主要参与者并为疟疾寄生虫的药物的发展开辟了新的途径。






