m6A甲基转移酶ZCCHC4介导核糖体RNA甲基化
RNA修饰几乎普遍存在于所有细胞RNA中,甲基化是人类最普遍的RNA修饰类型之一。m6A RNA甲基化修饰广泛存在于人类的mRNA、rRNA、snRNA中。尽管mRNA m6 A修饰在众多生物系统中起关键作用,但对于rRNA的m6A甲基转移酶和rRNA m6A修饰的功能尚不清楚。近日Nature子刊Nature Chemical Biology发表了一篇题名为:N6-Methyladenosine methyltransferase ZCCHC4 mediates ribosomal RNA methylation的文章。文章发现新的m6A甲基转移酶ZCCHC4,它主要甲基化人类28S rRNA,并且还与一部分mRNA相互作用。ZCCHC4基因敲除可消除28S rRNA中的m6A修饰,减少整体翻译,并抑制细胞增殖。作者还发现ZCCHC4蛋白在肝细胞癌肿瘤中过表达,而ZCCHC4敲除显着降低了异种移植小鼠模型中的肿瘤大小。

一、ZCCHC4是一种m6A甲基转移酶,在体外将28S rRNA甲基化
为了确定ZCCHC4在体外是否具有甲基化活性,纯化了全长重组ZCCHC4蛋白,并使用野生型(ZCCHC4 WT)和突变体(ZCCHC4 4A)蛋白进行了体外酶促测定催化活性。用三种带有不同序列的RNA(GGACU, GAACU 和AAACU)探针底物孵育了重组蛋白。使用液相色谱-串联质谱(LC-MS / MS)监测反应。发现ZCCHC4专门在含AAC序列的探针上安装了一个甲基基团,但对含GAC-序列的探针未显示可见的活性,带有GAACU序列的探针比含AAACU的探针更适合作为底物。WB和免疫荧光结果表明,ZCCHC4存在于细胞质和细胞核中,进一步显示在核仁中积累。合成了两个12-mer RNA探针,分别代表m6携带18 S和28S rRNA。在将这些探针与纯化的ZCCHC4蛋白和辅因子d3-SAM孵育后,通过MALDI质谱检测到一个新峰,该峰代表具有添加的甲基的28S rRNA探针。当使用具有催化活性的ZCCHC4时,未观察到这个新峰。当测试18 S rRNA探针时,检测到明显较弱的活性。通过LC-MS / MS进一步消化和定量反应产物,结果表明,ZCCHC4的28S rRNA探针的酶活性比18 S rRNA探针的酶活性高约24倍。这些结果表明ZCCHC4可能是28S rRNA的人RNA m6 A甲基转移酶。

二、ZCCHC4催化细胞中的28S rRNA甲基化
采用了紫外交联和免疫沉淀技术(PAR-CLIP),鉴定ZCCHC4的RNA底物。提取结合ZCCHC4的RNA进行RNA测序,以鉴定细胞中ZCCHC4的RNA底物。结果表明,ZCCHC4的主要结合靶标是28S rRNA,而在28S rRNA上ZCCHC4 PAR-CLIP峰中测序覆盖率最高的区域是1854–1913残基。在60 S大核糖体亚基的三维结构中,残基1854–1913靠近m6 A 4220残基。并且28S rRNA中所有与ZCCHC4结合的区域都紧密相连。与m6 A 4220站点特别接近,支持ZCCHC4结合并甲基化该站点的观点。
为了验证ZCCHC4在28S rRNA上的甲基化活性,使用CRISPR–Cas9敲除了HepG2和HeLa细胞中的ZCCHC4。在人类中,ZCCHC4有两种同工型,一个长的带有所有外显子,一个短的带有甲基转移酶结构域。设计了针对外显子1的不同sgRNA,外显子1仅影响长同种型(称为KO1),外显子4影响了两个同种型(称为KO4)或外显子7缺失了甲基转移酶结构域(称为KO7)。使用与包含A4220位点的甲基化区域互补的特定40核苷酸(nt)生物素标记的DNA寡核苷酸,从不同的KO和WT细胞中提取了28S rRNA。将RNA片段消化成单核苷酸,并通过LC-MS / MS定量m6 A的量。与WT细胞相比,具有靶向外显子1的sgRNA的细胞仍具有20%的m6 A,这表明短同工型也有助于残留的m6 A甲基化。相反,具有靶向外显子4或外显子7的sgRNA的细胞中,m6 A几乎消失我们还在体外用重组ZCCHC4蛋白和辅因子d3-SAM孵育了WT和KO细胞的总RNA,然后pulldown包含28S rRNA m6 A4220的片段,消化成单核苷并进行了LC-MS / MS分析测量d3m6 A水平。我们的结果表明,重组ZCCHC4蛋白还在体外在28S rRNA上安装了m6 A。
为了确定28S rRNA中m6 A的缺失是否由ZCCHC4的缺失所致,进行了基因拯救实验。提取来自HepG2细胞的单个RNA种类(28S rRNA,18 S rRNA和mRNA),通过LC-MS / MS测量m6 A的水平。ZCCHC4敲除后,对28S rRNA的m6 A修饰几乎完全消失,而18 S rRNA或mRNA在KO细胞中未显示出明显变化。过表达ZCCHC4 WT可以完全恢复28S rRNA中m6 A的丢失,但通过突变体ZCCHC4(DPPF变为AAAA)组蛋白或对照载体组来不能恢复。这些结果表明ZCCHC4是负责人28S rRNA中m6 A4220甲基化的主要甲基转移酶

三、ZCCHC4影响细胞翻译
rRNA的修饰影响核糖体结构,组装和动力学等方面作用。那么ZCCHC4介导的rRNA甲基化是否与成熟的rRNA水平相关吗?对从WT和ZCCHC4 KO细胞提取的总RNA进行变性凝胶电泳和qRT-PCR分析,以比较WT和KO细胞中18S和28S rRNA的水平。结果表明,ZCCHC4基因敲除不会显着改变成熟rRNA的水平。28S rRNA中约55%的A4220残基被ZCCHC4甲基化,ZCCHC4基本上不会影响rRNA之前的加工。
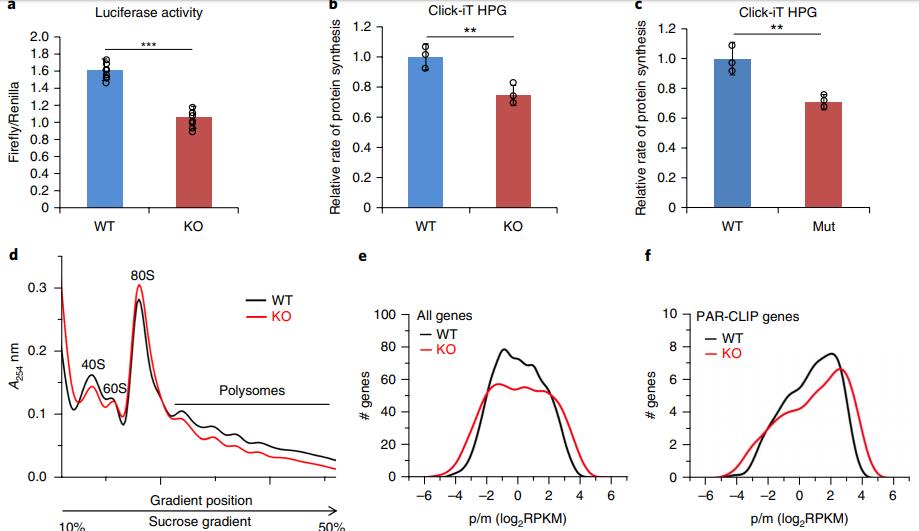
为了验证ZCCHC4是否影响蛋白质翻译。以两种方式测量了WT和ZCCHC4 KO细胞之间翻译活性的差异。首先,使用荧光素酶实验,结果显示WT细胞产生的荧光素酶水平高于KO细胞。我们还使用新合成蛋白质的l-高炔丙基甘氨酸衍生代谢标记来测量整体蛋白质合成活性。结果发现,与WT细胞相比,KO细胞的整体翻译水平降低了约25%,并且ZCCHC4 KO细胞的整体翻译活性可以通过转染WT flag-ZCCHC4质粒而得以恢复。这些结果支持了前期的假设,即ZCCHC4可能通过其28S rRNA m6 A甲基化活性影响整体翻译。
为了进一步研究ZCCHC4对翻译的影响,通过SDG和多核糖体相关mRNA测序对WT和ZCCHC4 KO细胞进行了多核糖体分析。SDG谱图显示,与野生型细胞相比,ZCCHC4 KO细胞中与80S单核糖体峰相比的多核糖体数量显着减少。多核糖体相关的mRNA测序表明,28S rRNA m6 A修饰的缺失降低了对mRNA群体的翻译的严格控制。GO分析进一步表明,ZCCHC4可能通过与mRNA的一部分结合而影响翻译。
四、ZCCHC4表达影响癌症进展
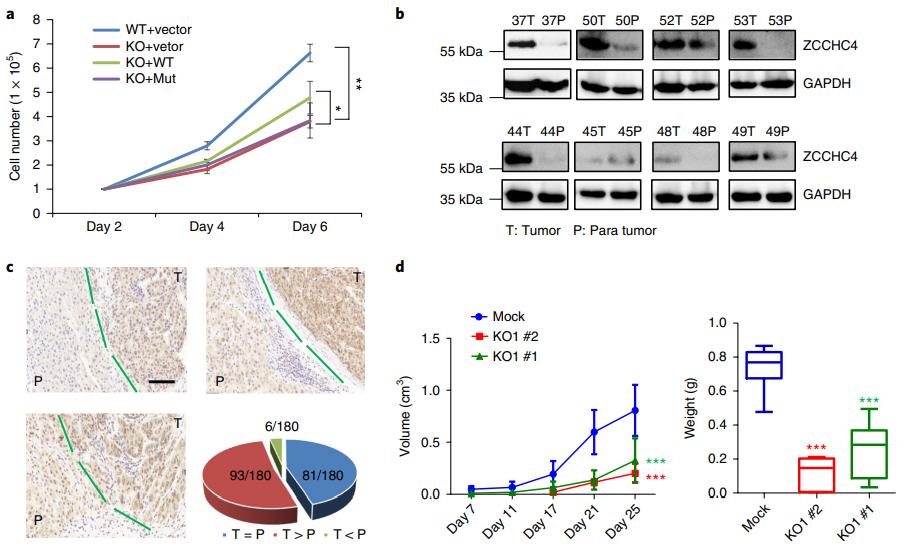
接下来,观察ZCCHC4介导的rRNA甲基化是否影响细胞增殖。与WT对照相比,在三个独立构建的ZCCHC4基因敲除的HepG2细胞系中,细胞增殖显着降低。KO细胞的增殖减少可被转染的野生型ZCCHC4质粒拯救。为了进一步研究ZCCHC4在细胞增殖中的作用,观察ZCCHC4在癌症中的潜在作用。测量了ZCCHC4蛋白在肝细胞癌肿瘤(HCT)组织中与癌旁组织的表达水平,HCT肿瘤组织中ZCCHC4蛋白过表达。在180例患者的中癌和癌旁组织中IHC测量了ZCCHC4的表达。在180对肿瘤组织中,ZCCHC4表达水平更高有93个(52%),只有6个(3%)降低的ZCCHC4表达水平。从6例患者的癌和癌旁组织中提取了28S rRNA,并通过LC-MS / MS分析了它们的m6 A水平。其中五名患者肿瘤组织28S rRNA中的m6 A水平高于癌旁组织。最后,进行动物实验验证ZCCHC4介导的m6 A甲基化与肿瘤进展之间的关系。在裸鼠肿瘤模型中,与WT细胞相比,ZCCHC4 KO细胞肿瘤体积和重量明显减少。这些结果支持ZCCHC4催化的rRNA甲基化在癌细胞生长和肿瘤进展中的作用。
结论:
文章发现了一种新的人类RNA m6 A甲基转移酶ZCCHC4,它介导了28S rRNA 内AAC的甲基化。ZCCHC4的rRNA甲基化在细胞增殖调节和肿瘤发生中起作用。






