lncRNA LINC00673-v4通过激活WNT/β-catenin信号传导促进肺腺癌的侵袭性
肺癌是最常见的癌症类型,非小细胞肺癌占肺癌的比例约为85%,肺腺癌(LAD)占非小细胞肺癌50%左右。转移可在LAD早期阶段发生,但驱动这种快速转移能力的分子机制仍未完全了解。最近来自广东中山大学的团队在期刊PNAS上发表了一篇题名为:Long noncoding RNA LINC00673-v4 promotes aggressiveness of lung adenocarcinoma via activating WNT/β-catenin signaling的文章。该文章主要讲述了lncRNA LINC00673-v4表达在LAD中上调并且与肿瘤侵袭进展的关系。

一、LINC00673-v4表达在LAD中上调并与淋巴结转移和预后不良相关
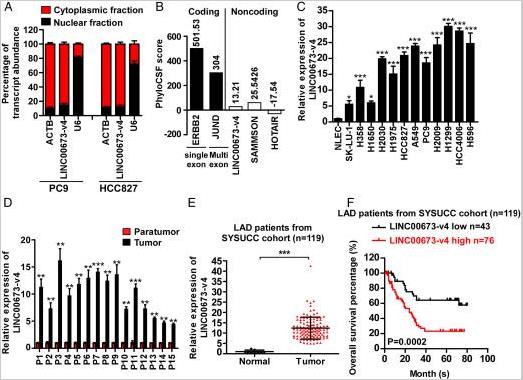
通过他人在TCGA转录组测序数据的整合分析,确定了关于WNT /β-连环蛋白信号传导10种最高表达的lncRNA。使用荧光素酶测定法,评估了10种高表达的lncRNA转录物在LAD中的作用。沉默ENST00000457958.6导致LAD细胞中TCF / LEF活性的显着抑制,而ENST00000457958.6与LINC00673-v4(NCBA)序列100%相同。使用FISH和细胞分离分析,在LAD细胞的细胞质中发现了LINC00673-v4大量存在。分析编码潜力表示LINC00673-V4可能显著缺乏蛋白质编码能力。与原发性正常肺上皮细胞相比,LAD细胞系中LINC00673-v4的表达升高。通过qRT-PCR验证分析LAD和癌旁组织中的LINC00673-v4水平,发现LAD LINC00673-v4表达显著高于癌旁组织。大组织样本量qRT-PCR验证LAD和正常肺组织中的LINC00673-v4表达,结果同上。生存曲线分析显示LINC00673-v4低表达较高表达生存率有显著提升。
二、LINC00673-v4促进LAD细胞入侵,迁移和转移
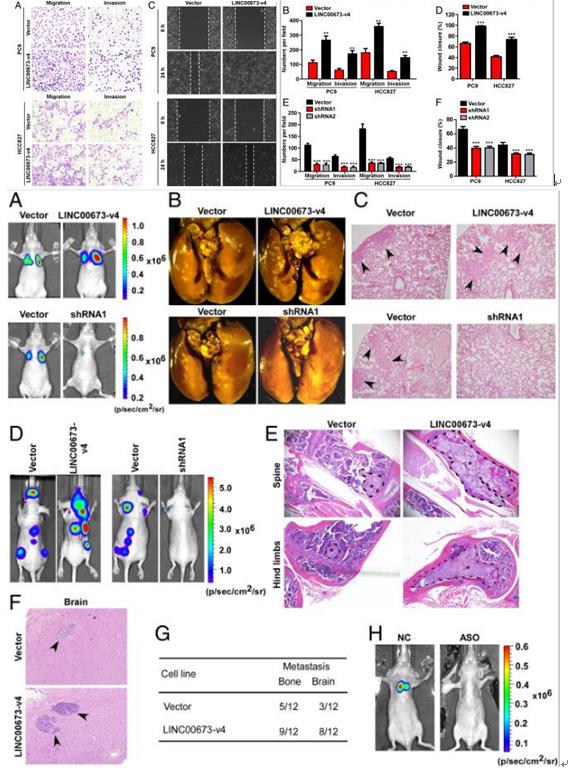
LINC00673-v4表达与LN转移和LAD预后不良的强烈关联,那么LINC00673-v4是否能够促进LAD细胞的侵袭和迁移。在体外细胞系验证中,transwell结果显示LINC00673-v4的过表达显著增加了LAD细胞的侵袭和迁移能力,划痕实验结果同上;当敲低LINC00673-v4是抑制细胞侵袭和迁移。
利用裸鼠肺癌转移实验模型在体内检查LINC00673-v4的功能,体内实验结果与体内实验结果一致。为了进一步证实LINC00673-v4在LAD转移中的功能,采用心内注射转移模型。LINC00673-V4过表达的PC9细胞接种的小鼠中显著增加骨和脑转移,但敲低LINC00673-V4 PC9细胞降低。还利用LINC00673-v4的反义RNA链(LINC00673-v4 GapmeRs)直接注射到裸鼠尾静脉来治疗LAD转移模型,治疗组肿瘤转移性明显下降。结果表明LINC00673-v4 GapmeRs代表了LAD转移的潜在治疗方法。这些数据表明LINC00673-v4是LAD细胞侵袭,迁移和转移的强启动子分子。
三、LINC00673-v4激活WNT /β-连环蛋白信号
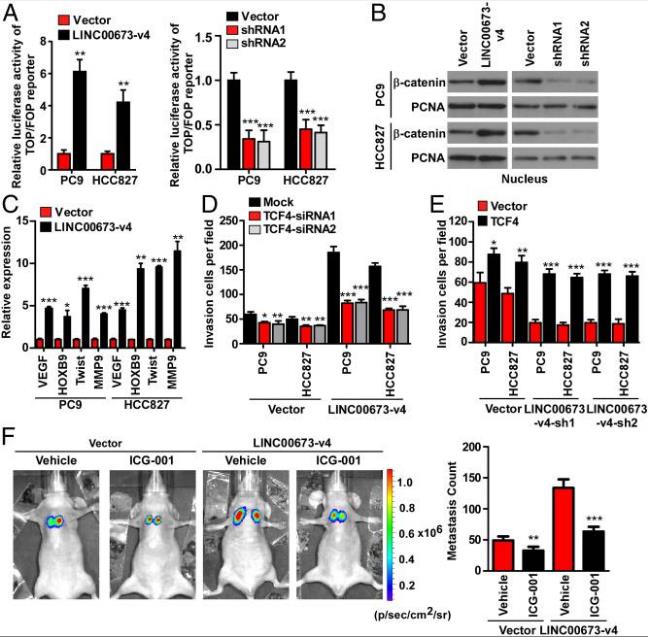
为了进一步阐明LINC00673-v4在WNT /β-连环蛋白信号传导中的作用,分别在LINC00673-v4过表达和敲低的LAD细胞中进行荧光素酶测定实验。TCF / LEF活性过表达LINC00673-V4细胞中显著增加,并且在敲低LINC00673-V4细胞中显著降低。LINC00673-V4的过表达促进β连环蛋白的细胞核积聚,而敲低LINC00673-V4抑制β连环蛋白细胞核积聚。接下来检查了LINC00673-v4对WNT /β-连环蛋白信号传导下游入侵相关基因表达的影响。VEGF、HOXB9、Twist和MMP9表达水平,在过表达LINC00673-V4细胞中显著增加,并且在敲低LINC00673-V4细胞中显著降低。
接下来研究了WNT /β-连环蛋白激活是否在介导LINC00673-v4诱导的细胞侵袭中发挥作用。首先,通过敲低TCF4或LEF1抑制WNT /β-连环蛋白信号传导对LINC00673-v4过表达细胞侵袭的影响,LINC00673-V4过表达的细胞侵袭时因TCF4或LEF1被敲低而减弱。TCF4或LEF1敲低导致细胞侵袭减少,但不如过表达LINC00673-v4的LAD细胞显著。其次,在LINC00673-v4敲除的细胞系中验证TCF4或LEF1过表达拯救LAD细胞侵袭的能力。在过表达TCF4或LEF1空载体转染的LAD细胞中,增加了LAD细胞侵袭,并且这些影响可能在LINC00673-V4-沉默LAD细胞中进一步增强。最后通过使用WNT /β-连环蛋白信号转导抑制剂进一步确定活化的WNT /β-连环蛋白信号是否在小鼠模型中在LINC00673-v4介导的前期转移作用中发挥作用。体内实验显示Wnt信号传导抑制剂ICG-001对PC9-LINC00673-v4和PC9-Vector转移能力下降明显。但ICG-001对PC9载体细胞肺接种成瘤的抑制作用不如过表达LIN900673-v4的PC9细胞。这些结果表明,LINC00673-v4可促进WNT /β-连环蛋白信号传导的活性,从而增强LAD细胞的侵袭和转移。
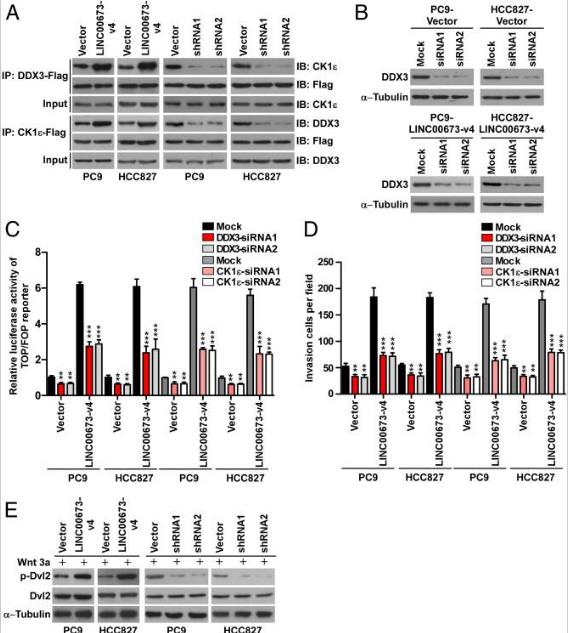
四、LINC00673-v4与DDX3和CK1ε互作
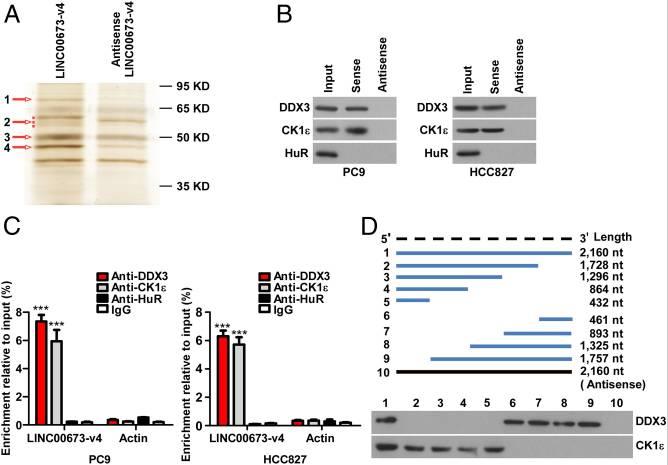
许多lncRNA通过与蛋白质分子的物理相互作用发挥其生物学功能。为了研究LINC00673-v4在调节WNT /β-连环蛋白信号传导中的作用的分子机制,通过鉴定LINC00673-v4的细胞内结合蛋白开始研究。将生物素化的LINC00673-v4或其反义RNA与PC9细胞裂解物一起温育,然后进行pull-down实验。对差异条带进行质谱分析, CK1ε是4个差异条带中排名靠前的LINC00673-v4相互作用蛋白,也在WNT /β-连环蛋白信号传导中起重要作用。为了证实LINC00673-v4与CK1ε相互作用,我们使用CK1ε抗体进行RNA pull-down和免疫印迹,结果显示在LINC00673-v4蛋白复合物中检测到CK1ε,但在对照样品中未检测到CK1ε。而且,在UV交联后通过RIP测定进一步验证了直接相互作用。进行RNA pull-down之后进行后UV交联免疫印迹和RIP测定,结果表明,LINC00673-V4也直接与DDX3相互作用。
为了确定LINC00673-v4的分子内区域与相互作用中涉及的两种蛋白质相互作用,LINC00673-v4的八个片段(1-1728 nt,1-1296 nt,1-864 nt,1-432 nt,1729-2189 nt ,1297-2189 nt,865-2189 nt和433-2189 nt体外转录和生物素化,并用于来自PC9细胞的总蛋白质提取物的pull-down测定。发现LINC00673-V4的1729-2160个核苷酸段与DDX3相互作用,而LINC00673-V4的1-432 NT段与CK1ε相互作用。这些数据表明LINC00673-v4是DDX3和CK1ε的直接交互结合配偶体。
五、LINC00673-v4在WNT /β-Catenin信号通路中作为模块化支架起作用
为了进一步了解LINC00673-v4与DDX3和CK1ε的结合是否加强了DDX3和CK1ε之间的相互作用,进行了o-IP实验,发现DDX3和CK1ε可以相互作用并且过表达LINC00673- V4增强DDX3和CK1ε的相互作用,而LINC00673-v4敲低减弱了LAD细胞系中的这种相互作用,表明LINC00673-v4直接结合DDX3和CK1ε并加强它们的相互作用。
为了验证LINC00673-v4是否与DDX3和CK1ε相互作用是激活WNT /β-连环蛋白信号传导所必需的。在过表达LINC00673-v4的LAD细胞中敲除了DDX3或CK1ε,发现通过敲除DDX3或CK1ε可以抑制LINC00673-v4诱导的WNT /β-连环蛋白激活和LAD细胞侵袭能力的增加。还研究了敲低DDX3或CK1ε对对照载体转导细胞的影响。DDX3或CK1ε敲低导致对照载体转导的细胞中WNT /β-连环蛋白激活和细胞侵袭减少,但不如过表达LINC00673-v4的LAD细胞显着。还观察到DVL的磷酸化在LINC00673-V4过表达LAD细胞增加,而沉默LINC00673-V4表达降低DVL磷酸化。总之,这些数据表明LINC00673-v4可能确实充当DDX3和CK1ε复合物的模块化支架以激活WNT /β-连环蛋白信号传导。
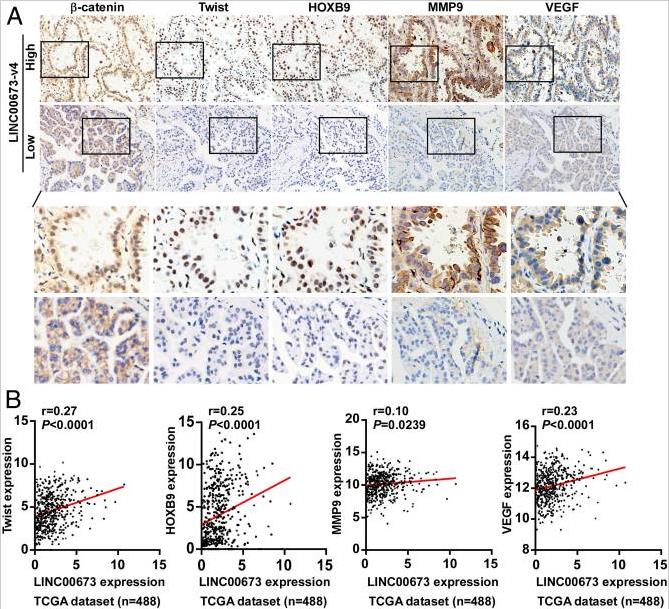
六、LINC00673-v4与LAD中的WNT /β-连环蛋白信号临床相关
进一步研究上述发现是否与临床相关,我们采用LAD临床标本检查LINC00673-v4的表达及其与WNT /β-连环蛋白激活标志的相关性。LINC00673-V4水平和核β连环蛋白(R = 0.238,P = 0.009)、Twist (r = 0.205, P = 0.025)、HOXB9 (r = 0.197, P = 0.032)、MMP9 (r = 0.191, P = 0.038)和 VEGF (r = 0.202, P = 0.028) 的表达正相关。此外,分析了在TANRIC数据库中收集的LAD患者的数据,LINC00673-v4高表达与Twist 、HOXB9、MMP9和 VEGF 成正相关。这表明在LAD病人,LINC00673-V4临床有助于WNT的激活/ β-连环蛋白信号通路,导致核β-连环蛋白,VEGF,Twist,HOXB9和MMP9的表达增加。
结论
NC00673-v4在LAD中的临床,功能和机制意义,LINC00673-v4及其在WNT /β-连环蛋白信号传导中的调节作用对于LAD的侵袭性行为至关重要,而LINC00673-v4可能是一种LAD治疗潜在的有效目标。






