BICD1在低氧适应过程中介导间充质干细胞中的HIF1α核易位
缺氧诱导因子1α(HIF1α)是导致代谢适应的主要调节因子,这是维持缺氧条件下干细胞存活的重要生理过程。然而,人们对HIF1α如何在缺氧条件下如何进入干细胞的核内了解甚少。近期,来自首尔大学的研究团队在Cell Death Differentitation期刊报道了BICD1在动力蛋白介导的HIF1α核转位中的作用以及BICD1调节对低氧适应的影响。文章题目为BICD1 mediates HIF1α nuclear translocation in mesenchymal stem cells during hypoxia adaptation。文章证明了BICD1诱导的HIF1α核易位对于缺氧适应至关重要,这决定了人脐带血间充质干细胞(UCB-MSC)的再生潜力。

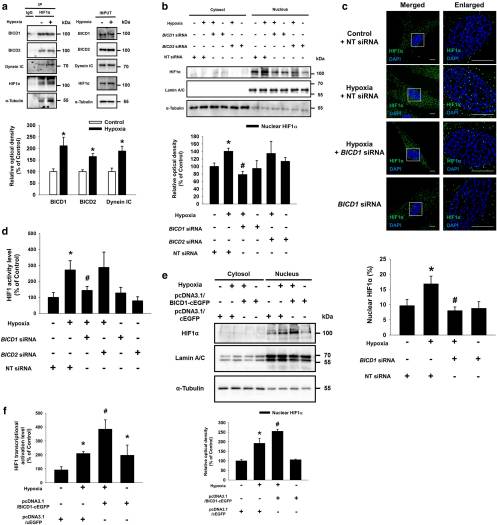
1.缺氧刺激的HIF1α核易位依赖于BICD1
作者研究了低氧条件下UCB-MSCs中HIF1α的核易位中微管和胞质动力蛋白的作用。数据显示,缺氧诱导的HIF1α核易位被Nocodazole和ciliobrevin D预处理抑制。并且,与单独的低氧治疗相比,低氧的ciliobrevin D预处理增加了裂解的caspase-9蛋白表达和膜联蛋白V阳性细胞的百分比。这些结果表明,低氧诱导的HIF1α核易位依赖于微管稳定性和胞质动力蛋白的活性,这对于低氧条件下UCB-MSC的存活至关重要。接下来,发现缺氧刺激了HIF1α与BICD1,BICD2,Dynein IC和α-Tubulin的结合。同时,ciliobrevin D预处理不影响α-微管蛋白与BICD1和BICD2的结合。siRNA转染BICD1而不抑制BICD2抑制了HIF1α核转运和活性。而且,通过pcDNA3.1 / BICD1-cEGFP质粒转染进一步降低了缺氧诱导的HIF1α核易位和活性。为了检测HIF1α的脯氨酸羟基化形式(Hyp402和Hyp564),在常氧或低氧条件下将MG132处理为UCB-MSC,结果表明,BICD1沉默或过表达不会影响低氧降低的HIF1α水平的Hyp402和Hyp564。非MSC细胞模型研究了BICD1或BICD2沉默对SK-N-MC神经母细胞瘤细胞系中HIF1α核易位的影响。缺氧增加了BICD1和BICD2与SK-N-MC中HIF1α的结合。在低氧治疗的实验组中,BICD1和BICD2 siRNA共转染的SK-N-MC中的HIF1α核水平最低。BICD2沉默显着抑制了缺氧诱导的BICD1 KO SK-N-MC细胞系中的HIF1α核易位。这些结果表明,BICD1和BICD2都具有介导缺氧条件下SK-N-MCs中HIF1α核易位的能力。
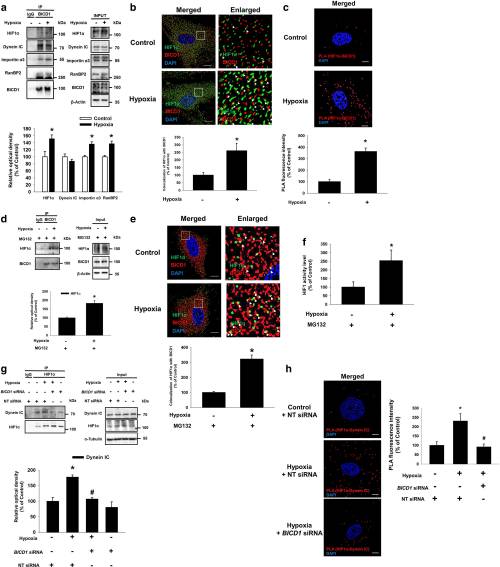
2.低氧刺激BICD1和HIF1α之间的相互作用是将HIF1α募集到动力蛋白所必需的
接下来,作者确定了缺氧对HIF1α和BICD1之间相互作用的影响。结果表明,低氧刺激了BICD1与HIF1α,Importinα3和RanBP2的结合。缺氧显着增加了HIF1α与BICD1在细胞质区域的共定位,这也与对照组相比通过HIF1α/ BICD1邻近结扎测定(PLA)信号得以显示。因为缺氧诱导的HIF1α蛋白水平可能有助于HIF1α与BICD1的相互作用,所以用蛋白酶体抑制剂MG132进行了预处理,以抑制缺氧引起的HIF1α蛋白水平的进一步诱导。在MG132预处理条件下,低氧刺激HIF1α与BICD1的结合,尽管在有氧或无氧的UCB-MSC中总HIF1α蛋白水平相似。因为缺氧诱导的HIF1α蛋白水平可能有助于HIF1α与BICD1的相互作用,所以我们用蛋白酶体抑制剂MG132进行了预处理,以抑制缺氧引起的HIF1α蛋白水平的进一步诱导。在MG132预处理条件下,低氧刺激HIF1α与BICD1的结合,尽管在有氧或无氧的UCB-MSC中总HIF1α蛋白水平相似。此外,BICD1 siRNA转染抑制了缺氧诱导的HIF1α与Dynein IC的结合。HIF1α/动力蛋白IC的缺氧诱导的PLA信号由被显著废除BICD1 siRNA转染。此外,CoCl 2处理诱导了HIF1α与Dynein IC的结合和HIF1α核易位,这被BICD1沉默所消除。
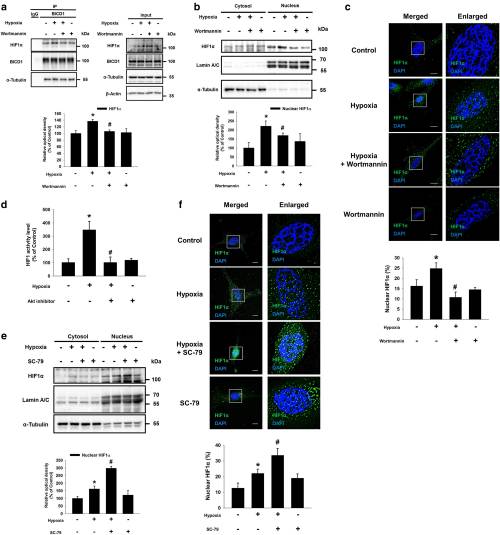
3.AKT失活GSK3β增加BICD1和HIF1α的相互作用,导致缺氧下HIF1α核易位
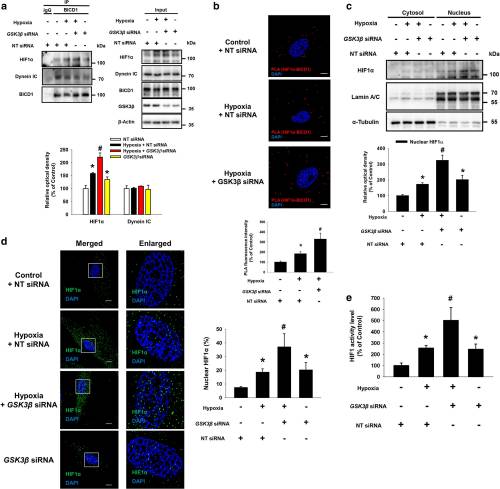
实验研究了BICD1如何刺激缺氧诱导的HIF1α核易位的机制。数据表明,缺氧抑制了BICD1与Akt和GSK3β的结合。然而,在常氧和低氧之间,未观察到BICD1,BICD2,DYNC1H1和DYNC2H1的mRNA表达水平的差异,这表明由低氧调节的BICD1与其蛋白水平无关。PI3K / Akt抑制剂渥曼青霉素的预处理可抑制低氧刺激的BICD1与HIF1α的结合以及HIF1α的核易位。此外,双重荧光素酶报告基因测定结果还表明,Akt抑制剂预处理抑制了缺氧增加的HIF1活性。相反,用Akt激活剂SC-79进行的预处理显着增强了缺氧刺激的HIF1α核易位。用Akt抑制剂进行的预处理减少了缺氧诱导的Ser9残基上GSK3β的抑制性磷酸化,表明缺氧可通过Akt使GSK3β失活。因此,进一步研究GSK3β沉默对低氧诱导的BICD1和HIF1α之间相互作用的影响。GSK3β siRNA转染废除BICD1的低氧刺激的结合HIF1α。此外,与低氧的非靶向(NT)siRNA转染的UCB-MSC相比,在缺氧的 GSK3βsiRNA转染的UCB-MSC中HIF1α核易位和活性增加。而且,与经常氧的NT siRNA转染的UCB-MSC相比,常氧的GSK3βsiRNA转染的UCB-MSC刺激了HIF1α核易位和活性。
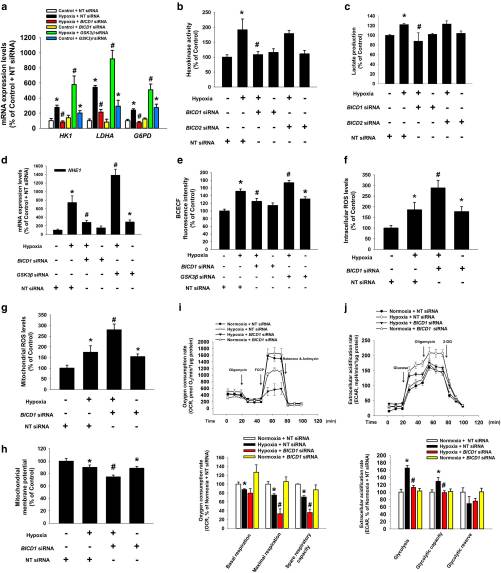
4.BICD1沉默诱导糖酵解开关抑制和线粒体ROS积累,导致线粒体损伤
实验研究了BICD1调节对UCB-MSCs中糖酵解和细胞内ROS积累的影响。数据显示,低氧增加了HIF1靶向的糖酵解酶(包括HK1,LDHA和G6PD)的mRNA表达水平,而BICD1 siRNA转染抑制了其他HIF1靶基因(包括EPO和BNIP3);然而,它们通过GSK3βsiRNA转染得到增强。通过转染BICD1 siRNA 消除了缺氧刺激的己糖激酶活性和乳酸的产生,而BICD2 siRNA则没有消除。NHE1 mRNA表达和BCECF-AM的荧光强度被废除BICD1 siRNA转染; 然而,它们通过GSK3βsiRNA转染进一步增加。缺氧的NT siRNA转染的UCB-MSC的总和线粒体ROS水平高于缺氧的BICD1 siRNA转染的UCB-MSC。在缺氧条件下, BICD1 siRNA转染降低了UCB-MSC的线粒体膜电位。OCR数据显示,低氧会降低基础呼吸,最大呼吸和备用呼吸能力。BICD1沉默进一步降低了最大呼吸和备用呼吸能力。此外,ECAR数据显示,低氧增加了糖酵解和糖酵解能力,被 BICD1沉默所抑制。这些数据表明,BICD1在缺氧刺激的UCB-MSC糖酵解重编程中起着重要作用。
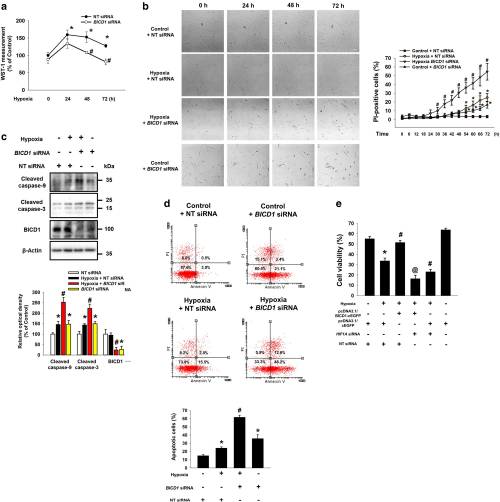
5.缺氧调节的BICD1对于UCB-MSC的存活很重要
细胞增殖和活力测定数据表明,在缺氧的48–72小时内,BICD1 siRNA转染的UCB-MSC 的增殖和活力显着低于NT siRNA转染的UCB-MSC。活细胞成像结果表明,在缺氧条件下,BICD1 siRNA转染的UCB-MSC在30-72 h内的PI阳性细胞显着高于在NT siRNA转染的UCB-MSC在缺氧的情况下。此外,在缺氧条件下,NT siRNA转染的UCB-MSC中的PI阳性细胞和在常氧下,在54–72 h内,BICD1 siRNA转染的UCB-MSC高于常氧下NT siRNA转染的UCB-MSC。BICD1 siRNA转染增加了常氧和低氧的UCB-MSC中裂解的caspase-9和-3的表达。缺氧的BICD1 siRNA转染的UCB-MSC 的凋亡明显高于缺氧的NT siRNA转染的UCB-MSC 的凋亡。此外,BICD1的过表达增加了缺氧条件下UCB-MSC的存活率,这完全被HIF1α沉默所消除。
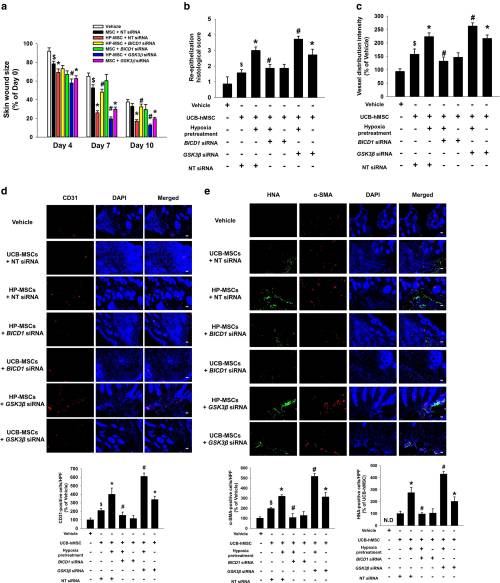
6.GSK3β沉默对BICD1的调节增强了缺氧预处理的UCB-MSC的再生潜力
在7天和10天的皮肤伤口手术后,在给出的缺氧预处理UCB-MSC的小鼠的伤口面积BICD1的siRNA比给出的缺氧预处理UCB-MSC的与NT的siRNA小鼠更大。缺氧预处理的UCB-MSC或带有NT siRNA的UCB-MSC的伤口愈合效果通过GSK3βsiRNA转染进一步增强。在皮肤伤口手术后第10天用haematine和曙红染色的皮肤样品进行组织学评估时,缺氧预处理的UCB-MSC的再上皮组织学评分高于含BICD1 siRNA 的缺氧预处理的UCB-MSC,但较低。比低氧预处理的UCB-MSC的GSK3βsiRNA。在所有实验组中,缺氧预处理的含GSK3βsiRNA的 UCB-MSC的组织学评分最高。此外,还评估是否BICD1或GSK3β siRNA转染调节在伤口愈合过程中诱导MSCs移植新生血管形成。给予缺氧预处理的UCB-MSC和NT siRNA的小鼠伤口部位的血管分布强度和泛内皮标记CD31阳性细胞的数量显着高于低氧预处理的UCB-MSC的BICD1 siRNA和比缺氧预处理UCB-MSC的具有较低GSK3β的siRNA。成肌纤维细胞标记物的量α平滑肌肌动蛋白(α-SMA)和人核抗原(HNA),用于移植的UCB-MSC的一个标记,在伤口部位阳性细胞具有给出的缺氧预处理UCB在小鼠中类似的模式-MSCs与NT,BICD1或GSK3β的siRNA。
结论:
实验证明了缺氧刺激BICD1和HIF1α之间的相互作用,导致BICD1通过Akt /GSK3β途径介导的HIF1α核易位。通过GSK3β抑制作用激活BICD1增强了缺氧适应糖酵解的能力和UCB-MSC的存活,从而导致缺氧预处理移植的UCB-MSC的再生潜力增加。作者的研究是对BICD1作为导致缺氧适应的HIF1α核易位的调节因子的首次鉴定。尽管需要进一步研究HIF1α与BICD1相互作用的结合序列以找到其他BICD1调控的转录因子,但研究为基于MSC的治疗提供了HIF1α特异性治疗策略的新见识。






