CAF分泌的miR-522可抑制铁死亡并促进胃癌获得性耐药
栏目:最新研究动态
发布时间:2020-07-21
铁死亡(Ferroptosis)是一种调控细胞死亡的新形式,涉及铁依赖性脂质过氧化物(脂质-ROS)的积累,并导致细胞致命性损害...
铁死亡(Ferroptosis)是一种调控细胞死亡的新形式,涉及铁依赖性脂质过氧化物(脂质-ROS)的积累,并导致细胞致命性损害。最近的研究已经确定铁死亡在介导肿瘤的发展和耐药性在某些类型的癌症中的重要作用,但其具体分子机制仍然知之甚少。今年2月,来自天津医科大学的研究团队在Molecular Cancer上发表了一篇题名为:CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemo-resistance in gastric cancer的文章。该文章主要讲述了CAF通过靶向ALOX15并阻断脂质ROS的积累,分泌外泌体miR-522来抑制癌细胞的铁死亡。包括USP7,hnRNPA1,exo-miR-522和ALOX15在内的细胞间途径揭示了胃癌(GC)获得化疗耐药性的新机制。

结 果:
1.GC中与铁死亡相关的关键基因的筛选
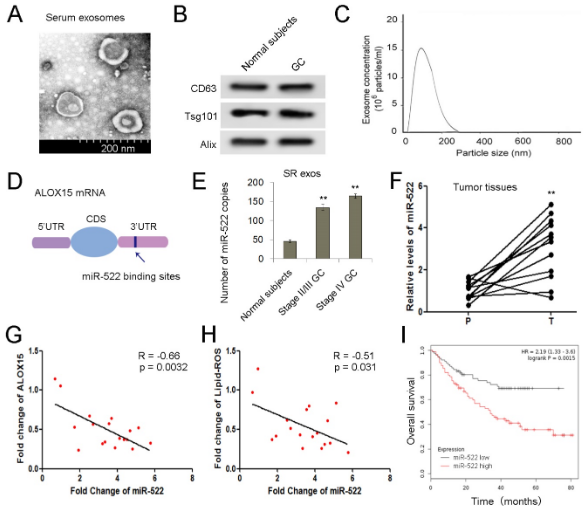
首先使用质谱比较GC特异性蛋白,与癌旁组织(P)相比,一组蛋白在GC肿瘤组织(T)中明显失调。 ALOX15是导致ferroptosis的关键基因之一,显示出急剧下降,而肿瘤组织中USP7和hnRNPA1的水平明显升高。随后,在12例胃癌患者中通过WB和RT-qPCR分析测量ALOX15蛋白和mRNA表达ALXO15蛋白总体呈下降趋势,但ALOX15 mRNA没有明显变化。因此,ALOX15主要在转录后水平受GC细胞的调节。通过IHC分析检查了ALOX15的分布,并且ALOX15主要在癌旁组织的腺细胞中表达,并在腺瘤细胞中少量表达。根据ALOX15蛋白水平的平均值,将GC患者分为ALOX15高组(n = 77)和ALOX15低组(n = 86)。 高水平的ALOX15蛋白还与胃癌患者更好的总体生存率(OS)相关,这表明ALOX15可以作为GC中的一种抗癌因子。由于脂质ROS是ALOX15产生的重要代谢产物,因此,肿瘤组织中的脂质ROS水平明显降低(图与ALOX15正相关。这些数据表明,ALOX15在介导胃肿瘤中脂质-ROS产生中起关键作用。
通过超速离心分离正常受试者和GC患者的血清外泌体,经鉴定具有外泌体特征。由于在ALOX15蛋白和ALOX15 mRNA之间未发现明显的相关性,推断ALOX15在转录后水平受miRNA调控。预测miR-522与ALOX15 mRNA相互作用。据报道,miR-522促进非小细胞肺癌,结肠直肠癌和肝细胞癌的肿瘤进展,但尚未明确miR-522在胃癌中的作用。我们的数据显示,GC患者的血清外泌体和肿瘤组织中的miR-522均上调,并且exo-miR-522与肿瘤等级呈正相关。 此外,发现miR-522与ALOX5表达以及脂质ROS负相关。根据miR-522的平均值,将GC患者分为miR-522高组(n = 184)和miR-522低组(n = 162)。生存曲线是从在线数据库生成的,并且高水平的miR-522预测GC的存活率很差。 因此,这些结果表明miR-522,ALOX15和脂质-ROS积累之间潜在的临床相关性。
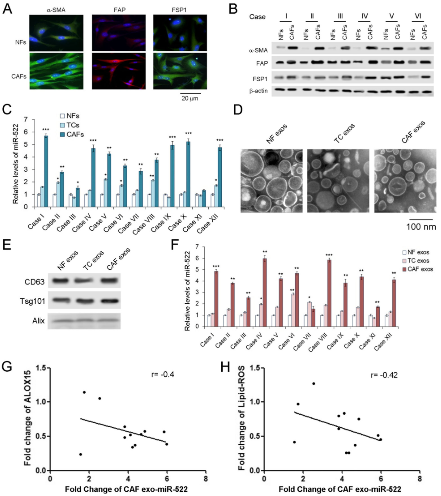
尽管证明外泌体miR-522在GC中明显上调,但miR-522的起源仍不清楚。分离肿瘤组织中的CAFs和癌旁组织中的正常成纤维细胞(NFs),并在原代细胞和外泌体中测量miR-522的水平。CAF中的标记α-SMA,FAP和FSP1表达量明显高于NF。GC细胞的标志物CEA和CK-18在NF和CAF中不表达,肿瘤细胞不表达α-SMA,FAP和FSP1。CAF 在三种细胞中miR-522表达最高,提取外泌体并鉴定,CAF外泌体中miR-522的含量在这三种外泌体中占主导地位。不出所料,源自CAF的外泌体miR-522也显示与ALOX15和脂质ROS呈负相关。这些数据表明,GC肿瘤微环境中的exo-miR-522主要由CAF分泌。
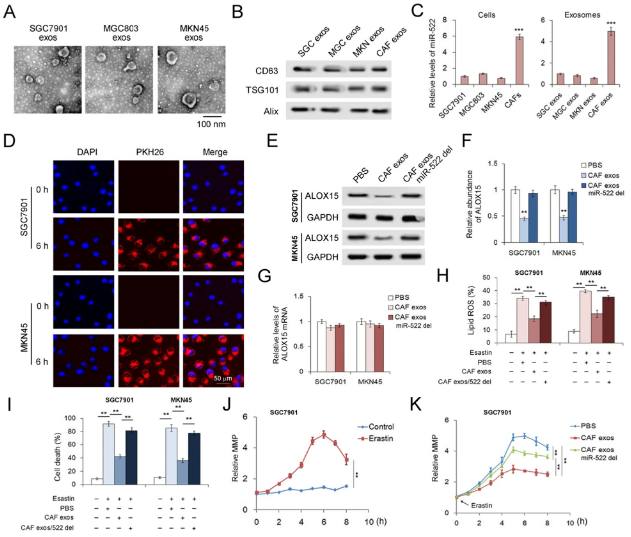
为了测试源自CAF的exo-miR-522在调节癌细胞的肥大性中的功能,分离了CAF外泌体并与人胃癌细胞系共培养。CAF中miR-522的量是GC细胞系的6倍,外泌体中也观察到了相同的趋势。将CAF外泌体与GC细胞共培养,并在6 h时在SGC7901细胞和MKN45细胞中均检测到PKH-26标记的CAF外泌体,表明CAF衍生的外泌体可以与GC细胞有效融合。CAF外泌体miR-522可显着抑制GC细胞中ALOX15的表达,而不会影响ALOX15 mRNA的含量。此外,已证明exo-miR-522可有效抑制GC细胞中蛋白激酶诱导的脂质ROS积累和铁死亡。 经过Eaststin处理的SGC7901细胞显示出明显的线粒体膜电位(MMP)升高,并且CAF外泌体部分逆转了Eaststin对线粒体的损伤。总而言之,CAF分泌的exo-miR-522抑制了ALOX15的表达并下调了GC细胞中铁死亡的水平。
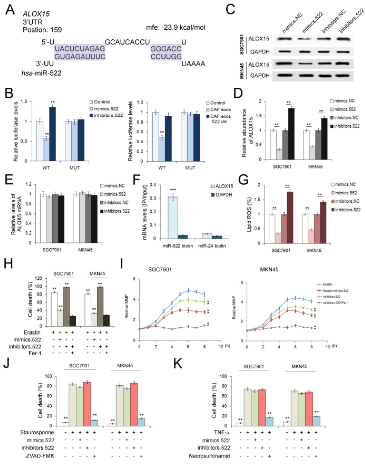
预测将三种miRNA,miR-522,miR-106a和miR-125b作为ALOX15的上游调节子,但是,miR-106a和miR-125b在CAF和NF之间显示出很小的差异。因此,选择了miR-522作为ALOX15的潜在调节剂。随后,进行荧光素酶报告基因检测,进一步揭示了miR-522和ALOX15 mRNA的直接接触。构建了含有miR-522结合区的荧光素酶报告质粒,并将含有miR-522结合位点(mut)的反向序列的质粒用作阴性对照。miR-522模拟物的转染或CAF外泌体的治疗会导致萤光素酶活性的显着抑制。而敲除miR-522则相对增加了萤光素酶的水平。过表达的miR-522显着降低了ALOX15的水平,而转染miR-522抑制剂促进了SGC7901和MKN45细胞中ALOX15的表达。但是在miR-522处理下ALOX15的mRNA几乎没有变化,这表明miR-522在转录后水平上负调控ALOX15的表达。在SGC7901细胞中使用生物素标记的miR-522进行免疫沉淀,并将生物素miR-24用作阴性对照。仅在生物素标记的miR-522组中检测到ALOX15 mRNA。不出所料,miR-522的过度表达与CAF外泌体在阻断脂质ROS的积累,抑制蛋白激酶诱导的细胞死亡和逆转蛋白激酶诱导的MMP升高方面具有相同的作用。抑制剂对miR-522的抑制作用显示出完全相反的功能。 为了研究miR-522是否与其他类型的细胞死亡有关,我们分别用凋亡激活剂(stauroporine)和抑制剂(ZVAD-FMK),坏死激活剂(TNF-α)和抑制剂(necrosulfonamid)处理了GC细胞。stauroporine和TNF-α均导致GC细胞的细胞死亡显着增加,但是miR-522无法降低细胞死亡的比例。因此,miR-522通过直接靶向GC细胞中的ALOX15有效地抑制了脂质ROS的产生和铁死亡。
据报道,hnRNP家族是将一系列mRNA和非编码RNA包装到外泌体中所必需的。在当前研究中,hnRNPA1已被MS筛选出其在胃肿瘤组织中的上调作用。IHC分析显示了USP7,hnRNPA1和ALOX15之间的相关性。接下来,我们检查了从上述12种肿瘤组织分离出的原发性CAF中hnRNPA1和USP7在中高表达。此外,hnRNPA1和USP7的水平都与外泌体miR-522正相关,这暗示USP7和hnRNPA1参与了CAFs的miR-522分泌。 有趣的是,与去泛素化相关的USP7似乎在增加hnRNPA1水平方面起着重要作用。
为了进一步研究USP7,hnRNPA1和miR-522之间的内部联系,构建了包含hnRNPA1或USP7编码序列以及这两个基因的siRNA的质粒。质粒的转染显着上调了hnRNPA1和USP7的表达,而siRNA的应用导致这两个基因的急剧减少。 hnRNPA1或USP7在CAFs中的过表达促进了miR-522向外泌体的包装。 然而,两个基因的敲除相对降低了exo-miR-522的水平。回复实验表明,过度表达的hnRNPA1或USP7部分抵消了各自siRNA对exo-miR-522的作用。接下来,可以使用抗hnRNPA1抗体在免疫沉淀测定的产物中检测到USP7,反之亦然。此外,USP7还显示与hnRNA1泛素化水平呈负相关。总体而言,这些结果表明,USP7通过去泛素化作用使CAF中的hnRNPA1稳定下来,导致外泌体miR-522的分泌增加。
为了进一步验证hnRNPA1在将miR-522选择性包装入外泌体中的作用,使用RBPDB预测了潜在的miR-522结合蛋白。我们还为PABPC1和ACO1设计了siRNA,并且PABPC1和ACO1都明显被siRNA抑制。这些siRNA的转染对CAF中miR-522的表达影响很小,是hnRNPA1而不是PABPC1和ACO1的下调显着降低了CAF外泌体中miR-522的水平。用生物素标记野生型和突变的miR-522,并将其转染到CAF中,然后进行免疫沉淀。结果表明,使用野生型生物素-miR-522在co-IP生产中仅检测到hnRNPA1。通过使用0.4μm的聚酯膜共培养原代CAF和SGC7901细胞。简而言之,将Cy3标记的miR-522转染到CAF中,并且来自CAF的外泌体通过膜与较低的GC细胞融合。在SGC7901细胞和MKN45细胞中都可以清楚地检测到Cys-miR-522,并且CAF中hnRNPA1的沉默可阻止cys-miR-522从CAF转移至GC细胞。因此,这些数据提供了直接的证据,表明hnRNPA1在介导miR-522到CAF外泌体的包装中起着重要的作用。
为了获得CAF中由化疗引起的损伤反应,我们检查了用亚致死剂量的顺铂或紫杉醇处理过的GC细胞。顺铂和紫杉醇对CAFs细胞活力的抑制作用。,顺铂或紫杉醇均能促进CAF中USP7和hnRNPA1的表达;药物毒性还增强了hnRNPA1的去泛素化作用。该结果表明,化疗诱导的损伤可通过增加USP7的表达并减少hnRNPA1的泛素化来促进miR-522包装入外泌体。将从顺铂(Cis-CAF外泌体)或紫杉醇(Pac-CAF外泌体)处理的CAF中分离出的外泌体与GC细胞共培养,它们显示出比对照CAF外泌体更大的抑制ALOX15蛋白表达的能力,而不会影响ALOX15转录。Cis-CAF外泌体和Pac-CAF外泌体在SGC7901细胞和MKN45细胞中均能更有效地减少脂质ROS的产生,并抑制蛋白抑制素引起的肥大症。在培养基中添加顺铂极大地导致了GC细胞的高死亡率,而顺式CAF外泌体和Pac-CAF外泌体则降低了死亡率。这些体外实验提供了证据,证明CAF外泌体有助于降低化疗期间的药物敏感性。
最后,在体内评估了USP7 / hnRNPA1 / miR-522轴在影响肿瘤生长和化学治疗功效中的作用。通过使用shRNA的慢病毒,分别产生了USP7,hnRNPA1和miR-522敲低的三种胃CAF株,并将这些胞株与SGC7901细胞混合用于小鼠皮下肿瘤植入。从第10天起每5天向这些荷瘤小鼠注入顺铂(5μg/ g)或生理盐水,并在第30天收获肿瘤。在CAF中敲除USP7,hnRNPA1或miR-522可明显抑制肿瘤生长并增强对顺铂的敏感性,但上调了脂质ROS的水平。敲除USP7会降低hnRNPA1蛋白质水平。而CAF中三个基因的抑制都会导致癌细胞中ALOX15的上调。进行了使用抗α-SMA抗体的IHC分析,显示慢病毒转导不会影响CAF在体内的增殖。顺铂的处理相对促进了CAFs中USP7 / hnRNPA1以及癌细胞中ALOX15的表达,但ALOX15的mRNA几乎没有变化。从这些小鼠中分离出血浆外泌体,外泌体miR-522的水平在USP7-KD和hnRNPA1-KD组中急剧下降,在miR-522-KD组中最低。铁死亡标志物PYGS2明显上调,而凋亡的标志物CASP3随着CAF中USP7,hnRNPA1和miR-522的敲低而略有增加。
USP7,hnRNPA1和miR-522的表达受抑制延长了荷瘤小鼠的生存期,顺铂组的小鼠比用盐水治疗的小鼠具有更好的生存期。
该研究阐明了TME衍生的外泌体通过转运特殊的信号传递信息在调节癌细胞的铁死亡中的新作用。这项研究还提供了一种新的想法,即通过阻止特定的miRNA包装到外泌体中来触发肿瘤中的细胞死亡。
1.GC中与铁死亡相关的关键基因的筛选
首先使用质谱比较GC特异性蛋白,与癌旁组织(P)相比,一组蛋白在GC肿瘤组织(T)中明显失调。 ALOX15是导致ferroptosis的关键基因之一,显示出急剧下降,而肿瘤组织中USP7和hnRNPA1的水平明显升高。随后,在12例胃癌患者中通过WB和RT-qPCR分析测量ALOX15蛋白和mRNA表达ALXO15蛋白总体呈下降趋势,但ALOX15 mRNA没有明显变化。因此,ALOX15主要在转录后水平受GC细胞的调节。通过IHC分析检查了ALOX15的分布,并且ALOX15主要在癌旁组织的腺细胞中表达,并在腺瘤细胞中少量表达。根据ALOX15蛋白水平的平均值,将GC患者分为ALOX15高组(n = 77)和ALOX15低组(n = 86)。 高水平的ALOX15蛋白还与胃癌患者更好的总体生存率(OS)相关,这表明ALOX15可以作为GC中的一种抗癌因子。由于脂质ROS是ALOX15产生的重要代谢产物,因此,肿瘤组织中的脂质ROS水平明显降低(图与ALOX15正相关。这些数据表明,ALOX15在介导胃肿瘤中脂质-ROS产生中起关键作用。

通过超速离心分离正常受试者和GC患者的血清外泌体,经鉴定具有外泌体特征。由于在ALOX15蛋白和ALOX15 mRNA之间未发现明显的相关性,推断ALOX15在转录后水平受miRNA调控。预测miR-522与ALOX15 mRNA相互作用。据报道,miR-522促进非小细胞肺癌,结肠直肠癌和肝细胞癌的肿瘤进展,但尚未明确miR-522在胃癌中的作用。我们的数据显示,GC患者的血清外泌体和肿瘤组织中的miR-522均上调,并且exo-miR-522与肿瘤等级呈正相关。 此外,发现miR-522与ALOX5表达以及脂质ROS负相关。根据miR-522的平均值,将GC患者分为miR-522高组(n = 184)和miR-522低组(n = 162)。生存曲线是从在线数据库生成的,并且高水平的miR-522预测GC的存活率很差。 因此,这些结果表明miR-522,ALOX15和脂质-ROS积累之间潜在的临床相关性。
尽管证明外泌体miR-522在GC中明显上调,但miR-522的起源仍不清楚。分离肿瘤组织中的CAFs和癌旁组织中的正常成纤维细胞(NFs),并在原代细胞和外泌体中测量miR-522的水平。CAF中的标记α-SMA,FAP和FSP1表达量明显高于NF。GC细胞的标志物CEA和CK-18在NF和CAF中不表达,肿瘤细胞不表达α-SMA,FAP和FSP1。CAF 在三种细胞中miR-522表达最高,提取外泌体并鉴定,CAF外泌体中miR-522的含量在这三种外泌体中占主导地位。不出所料,源自CAF的外泌体miR-522也显示与ALOX15和脂质ROS呈负相关。这些数据表明,GC肿瘤微环境中的exo-miR-522主要由CAF分泌。
为了测试源自CAF的exo-miR-522在调节癌细胞的肥大性中的功能,分离了CAF外泌体并与人胃癌细胞系共培养。CAF中miR-522的量是GC细胞系的6倍,外泌体中也观察到了相同的趋势。将CAF外泌体与GC细胞共培养,并在6 h时在SGC7901细胞和MKN45细胞中均检测到PKH-26标记的CAF外泌体,表明CAF衍生的外泌体可以与GC细胞有效融合。CAF外泌体miR-522可显着抑制GC细胞中ALOX15的表达,而不会影响ALOX15 mRNA的含量。此外,已证明exo-miR-522可有效抑制GC细胞中蛋白激酶诱导的脂质ROS积累和铁死亡。 经过Eaststin处理的SGC7901细胞显示出明显的线粒体膜电位(MMP)升高,并且CAF外泌体部分逆转了Eaststin对线粒体的损伤。总而言之,CAF分泌的exo-miR-522抑制了ALOX15的表达并下调了GC细胞中铁死亡的水平。
预测将三种miRNA,miR-522,miR-106a和miR-125b作为ALOX15的上游调节子,但是,miR-106a和miR-125b在CAF和NF之间显示出很小的差异。因此,选择了miR-522作为ALOX15的潜在调节剂。随后,进行荧光素酶报告基因检测,进一步揭示了miR-522和ALOX15 mRNA的直接接触。构建了含有miR-522结合区的荧光素酶报告质粒,并将含有miR-522结合位点(mut)的反向序列的质粒用作阴性对照。miR-522模拟物的转染或CAF外泌体的治疗会导致萤光素酶活性的显着抑制。而敲除miR-522则相对增加了萤光素酶的水平。过表达的miR-522显着降低了ALOX15的水平,而转染miR-522抑制剂促进了SGC7901和MKN45细胞中ALOX15的表达。但是在miR-522处理下ALOX15的mRNA几乎没有变化,这表明miR-522在转录后水平上负调控ALOX15的表达。在SGC7901细胞中使用生物素标记的miR-522进行免疫沉淀,并将生物素miR-24用作阴性对照。仅在生物素标记的miR-522组中检测到ALOX15 mRNA。不出所料,miR-522的过度表达与CAF外泌体在阻断脂质ROS的积累,抑制蛋白激酶诱导的细胞死亡和逆转蛋白激酶诱导的MMP升高方面具有相同的作用。抑制剂对miR-522的抑制作用显示出完全相反的功能。 为了研究miR-522是否与其他类型的细胞死亡有关,我们分别用凋亡激活剂(stauroporine)和抑制剂(ZVAD-FMK),坏死激活剂(TNF-α)和抑制剂(necrosulfonamid)处理了GC细胞。stauroporine和TNF-α均导致GC细胞的细胞死亡显着增加,但是miR-522无法降低细胞死亡的比例。因此,miR-522通过直接靶向GC细胞中的ALOX15有效地抑制了脂质ROS的产生和铁死亡。
据报道,hnRNP家族是将一系列mRNA和非编码RNA包装到外泌体中所必需的。在当前研究中,hnRNPA1已被MS筛选出其在胃肿瘤组织中的上调作用。IHC分析显示了USP7,hnRNPA1和ALOX15之间的相关性。接下来,我们检查了从上述12种肿瘤组织分离出的原发性CAF中hnRNPA1和USP7在中高表达。此外,hnRNPA1和USP7的水平都与外泌体miR-522正相关,这暗示USP7和hnRNPA1参与了CAFs的miR-522分泌。 有趣的是,与去泛素化相关的USP7似乎在增加hnRNPA1水平方面起着重要作用。
为了进一步研究USP7,hnRNPA1和miR-522之间的内部联系,构建了包含hnRNPA1或USP7编码序列以及这两个基因的siRNA的质粒。质粒的转染显着上调了hnRNPA1和USP7的表达,而siRNA的应用导致这两个基因的急剧减少。 hnRNPA1或USP7在CAFs中的过表达促进了miR-522向外泌体的包装。 然而,两个基因的敲除相对降低了exo-miR-522的水平。回复实验表明,过度表达的hnRNPA1或USP7部分抵消了各自siRNA对exo-miR-522的作用。接下来,可以使用抗hnRNPA1抗体在免疫沉淀测定的产物中检测到USP7,反之亦然。此外,USP7还显示与hnRNA1泛素化水平呈负相关。总体而言,这些结果表明,USP7通过去泛素化作用使CAF中的hnRNPA1稳定下来,导致外泌体miR-522的分泌增加。

为了进一步验证hnRNPA1在将miR-522选择性包装入外泌体中的作用,使用RBPDB预测了潜在的miR-522结合蛋白。我们还为PABPC1和ACO1设计了siRNA,并且PABPC1和ACO1都明显被siRNA抑制。这些siRNA的转染对CAF中miR-522的表达影响很小,是hnRNPA1而不是PABPC1和ACO1的下调显着降低了CAF外泌体中miR-522的水平。用生物素标记野生型和突变的miR-522,并将其转染到CAF中,然后进行免疫沉淀。结果表明,使用野生型生物素-miR-522在co-IP生产中仅检测到hnRNPA1。通过使用0.4μm的聚酯膜共培养原代CAF和SGC7901细胞。简而言之,将Cy3标记的miR-522转染到CAF中,并且来自CAF的外泌体通过膜与较低的GC细胞融合。在SGC7901细胞和MKN45细胞中都可以清楚地检测到Cys-miR-522,并且CAF中hnRNPA1的沉默可阻止cys-miR-522从CAF转移至GC细胞。因此,这些数据提供了直接的证据,表明hnRNPA1在介导miR-522到CAF外泌体的包装中起着重要的作用。

为了获得CAF中由化疗引起的损伤反应,我们检查了用亚致死剂量的顺铂或紫杉醇处理过的GC细胞。顺铂和紫杉醇对CAFs细胞活力的抑制作用。,顺铂或紫杉醇均能促进CAF中USP7和hnRNPA1的表达;药物毒性还增强了hnRNPA1的去泛素化作用。该结果表明,化疗诱导的损伤可通过增加USP7的表达并减少hnRNPA1的泛素化来促进miR-522包装入外泌体。将从顺铂(Cis-CAF外泌体)或紫杉醇(Pac-CAF外泌体)处理的CAF中分离出的外泌体与GC细胞共培养,它们显示出比对照CAF外泌体更大的抑制ALOX15蛋白表达的能力,而不会影响ALOX15转录。Cis-CAF外泌体和Pac-CAF外泌体在SGC7901细胞和MKN45细胞中均能更有效地减少脂质ROS的产生,并抑制蛋白抑制素引起的肥大症。在培养基中添加顺铂极大地导致了GC细胞的高死亡率,而顺式CAF外泌体和Pac-CAF外泌体则降低了死亡率。这些体外实验提供了证据,证明CAF外泌体有助于降低化疗期间的药物敏感性。

最后,在体内评估了USP7 / hnRNPA1 / miR-522轴在影响肿瘤生长和化学治疗功效中的作用。通过使用shRNA的慢病毒,分别产生了USP7,hnRNPA1和miR-522敲低的三种胃CAF株,并将这些胞株与SGC7901细胞混合用于小鼠皮下肿瘤植入。从第10天起每5天向这些荷瘤小鼠注入顺铂(5μg/ g)或生理盐水,并在第30天收获肿瘤。在CAF中敲除USP7,hnRNPA1或miR-522可明显抑制肿瘤生长并增强对顺铂的敏感性,但上调了脂质ROS的水平。敲除USP7会降低hnRNPA1蛋白质水平。而CAF中三个基因的抑制都会导致癌细胞中ALOX15的上调。进行了使用抗α-SMA抗体的IHC分析,显示慢病毒转导不会影响CAF在体内的增殖。顺铂的处理相对促进了CAFs中USP7 / hnRNPA1以及癌细胞中ALOX15的表达,但ALOX15的mRNA几乎没有变化。从这些小鼠中分离出血浆外泌体,外泌体miR-522的水平在USP7-KD和hnRNPA1-KD组中急剧下降,在miR-522-KD组中最低。铁死亡标志物PYGS2明显上调,而凋亡的标志物CASP3随着CAF中USP7,hnRNPA1和miR-522的敲低而略有增加。
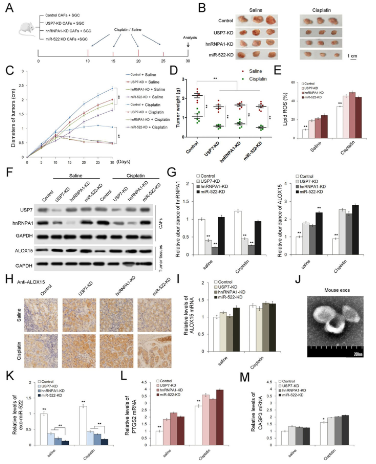
USP7,hnRNPA1和miR-522的表达受抑制延长了荷瘤小鼠的生存期,顺铂组的小鼠比用盐水治疗的小鼠具有更好的生存期。
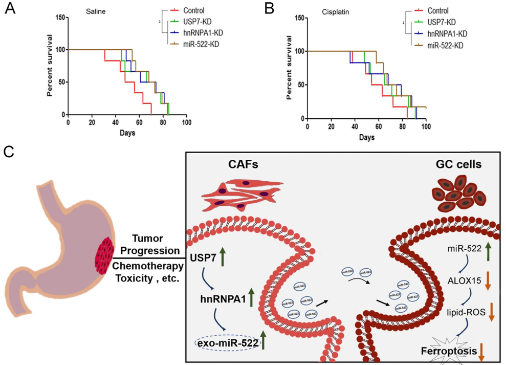
该研究阐明了TME衍生的外泌体通过转运特殊的信号传递信息在调节癌细胞的铁死亡中的新作用。这项研究还提供了一种新的想法,即通过阻止特定的miRNA包装到外泌体中来触发肿瘤中的细胞死亡。
上一篇:
外泌体、tRF研究解决方案与免费课题设计
下一篇:
外泌体circRNA参与肿瘤免疫治疗






