一样的研究,不一样的高分!!!
研究背景:
1. LncRNA参与了各种生理和病理过程,在也肿瘤进展中起关键作用,并在各种癌症中异常表达。
2. LncRNA可能起竞争内源性RNA(ceRNA)的作用,从而调节miRNA的生物学功能或表达。
3. 具有M2表型的肿瘤相关巨噬细胞(TAM)是肿瘤微环境中最丰富的免疫相关细胞,并通过介导血管生成、转移和免疫参与肿瘤发展。
4. 缺氧是肿瘤微环境(TME)的主要特征,它与许多实体瘤的进展和转移有关。
5. HIF-1α是一个广泛研究的缺氧诱导因子(HIF),它通过下游靶基因的反式激活介导细胞对缺氧的反应。 在常氧条件下,HIF-1α受到蛋白酶体降解,而低氧条件则保护HIF-1α不被降解,从而使HIF-1α易位到细胞核中以启动基因表达。

该研究基于公共数据库并结合生物信息学分析,检测了lncRNA BCRT1在乳腺癌组织中的过表达,并在一组乳腺癌组织中进行了进一步的验证。通过体外和体内实验确定了lncRNA BCRT1对增殖,迁移,侵袭和巨噬细胞极化的影响。进行了荧光素酶报告基因测定和RNA免疫沉淀(RIP),以揭示lncRNA BCRT1,miR-1303和PTBP3之间的相互作用。染色质免疫沉淀(ChIP)和RT-PCR用于评估缺氧诱导因子1α(HIF-1α)对lncRNA BCRT1的调节作用。最终,揭示了一种新的HIF-1α/ lncRNA BCRT1 / miR-1303 / PTBP3通路,可促进乳腺癌的进展,并提示lncRNA BCRT1可能是乳腺癌的潜在生物标志物和治疗靶标。
M1检测marker(CD80,MCP-1,iNOS和IL-6)
M2检测marker(CD206和MRC-2)
外泌体检测marker(CD63,HSP70和HSP90)
上皮检测biomarker(E-cadherin)
间充质检测biomarker(Fibronectin,N-cadherin和Vimentin)
技术路线:
1.通过比对数据库中的测序结果发现差异表达LncRNA BCRT1
2.组织和细胞系对LncRNA BCRT1的表达进行检测
3.对LncRNA BCRT1在乳腺癌中的功能和机制进行研究
4.通过数据库发现LncRNA BCRT1的潜在靶点miR-1303
5.荧光素酶实验对LncRNA BCRT1和miR-1303结合位点进行验证
6.miR-1303的功能验证,及LncRNA BCRT1和miR-1303见的机制研究
7.通过数据库发现miR-1303的潜在靶点PTBP3
8.荧光素酶实验对miR-1303和PTBP3结合位点进行验证
9.数据库分析PTBP3表达量
10.PTBP3的机制和功能的检测
11.lncRNA BCRT1是否经过外泌体促进肿瘤转移
12.外泌体lncRNA BCRT1对巨噬细胞极化的影响
13.LncRNA BCRT1和缺氧的关系验证
14.LncRNA BCRT1的靶基因PTBP3与缺氧诱导因子HIF-1α的关系
研究结果:
一、LncRNA BCRT1表达在乳腺癌中上调并与不良预后相关
lncRNA BCRT1在乳腺癌中被上调,而lncRNA BCRT1的高表达与乳腺癌预后不良有关。

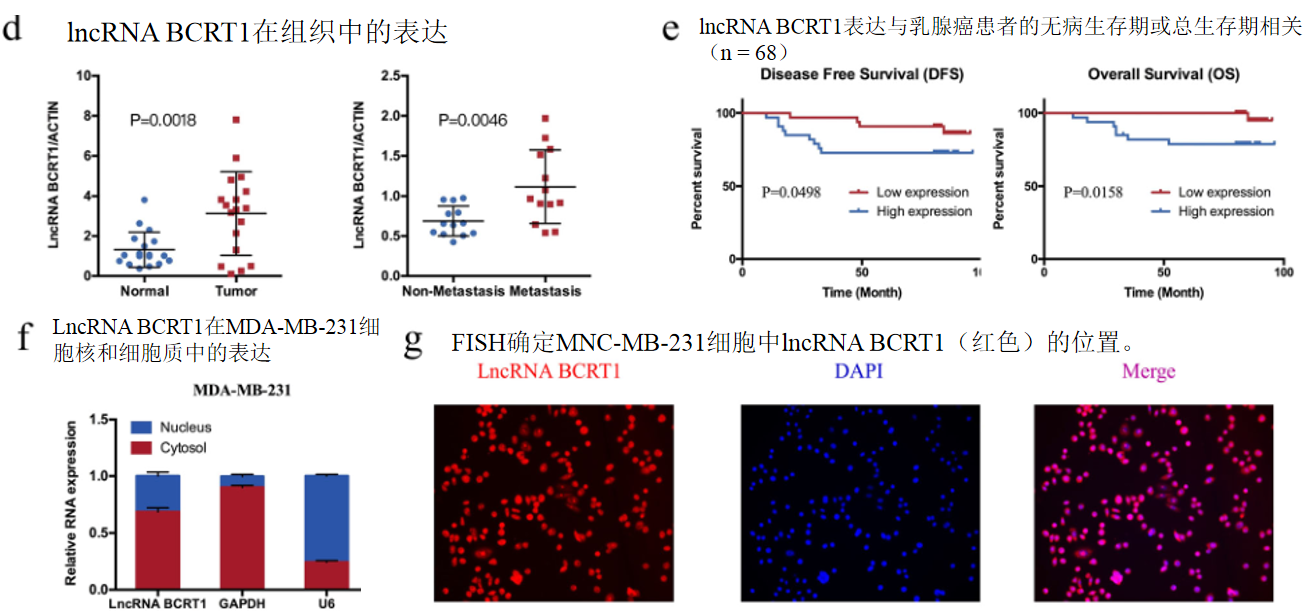
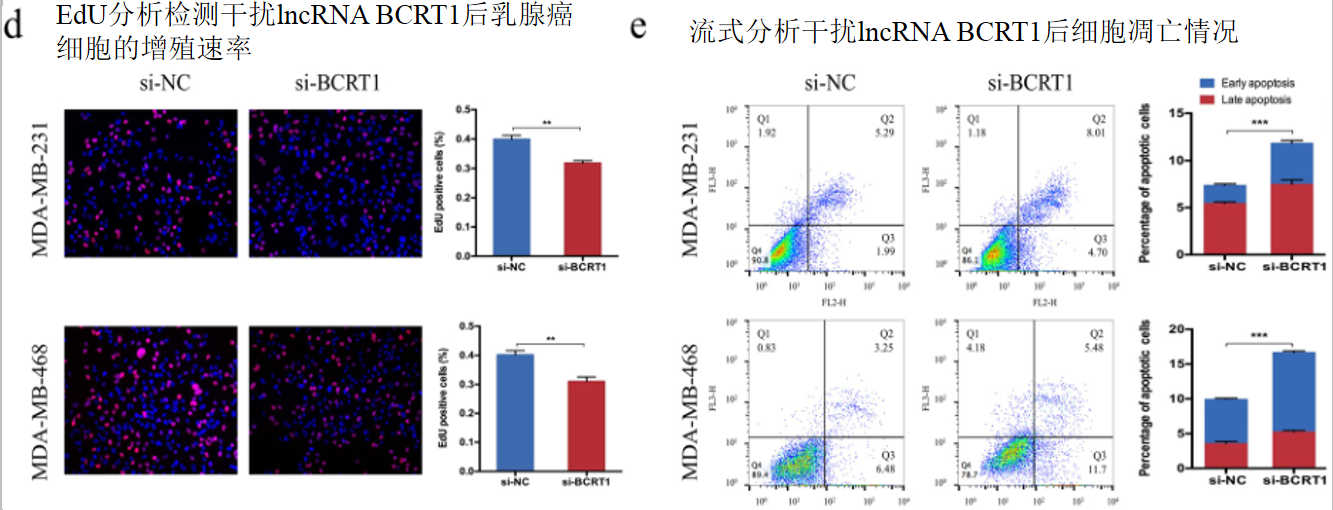
二、LncRNA BCRT1促进乳腺癌细胞增殖和肿瘤生长
lncRNA BCRT1可以在体外和体内促进乳腺癌细胞的增殖。
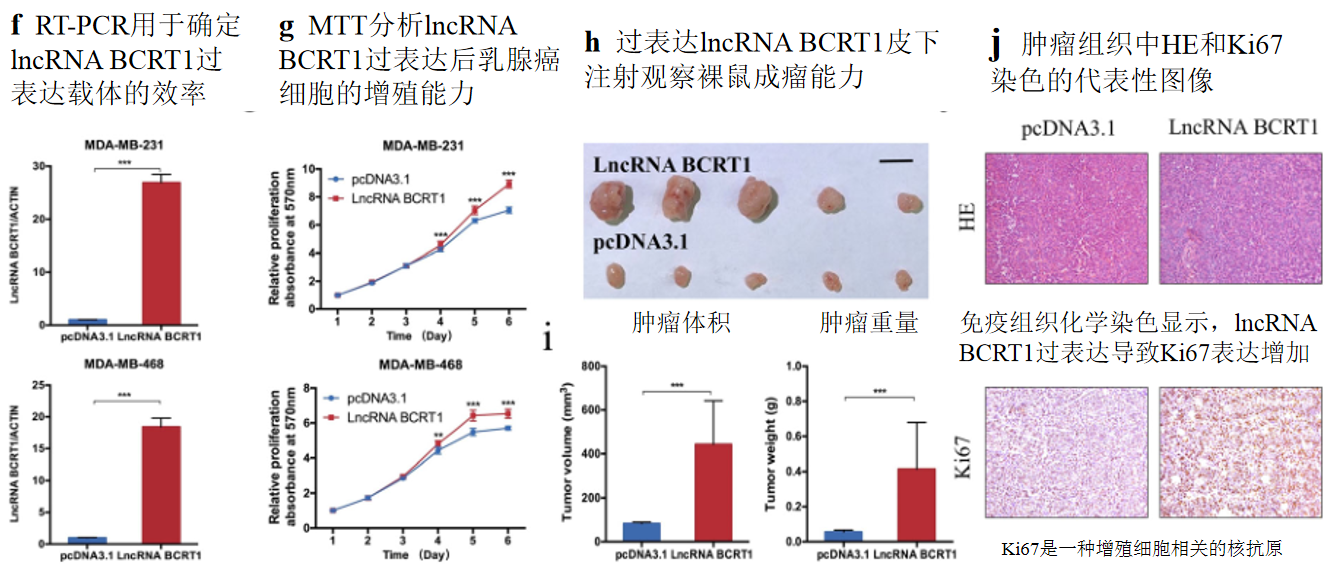
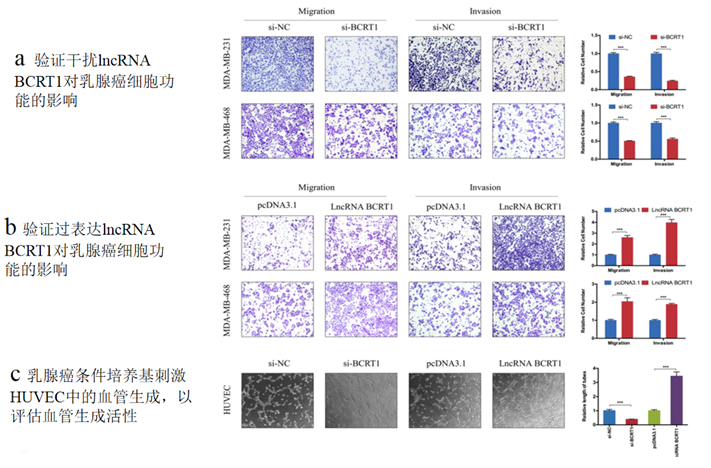
三、LncRNA BCRT1促进乳腺癌细胞的移动性和肿瘤转移
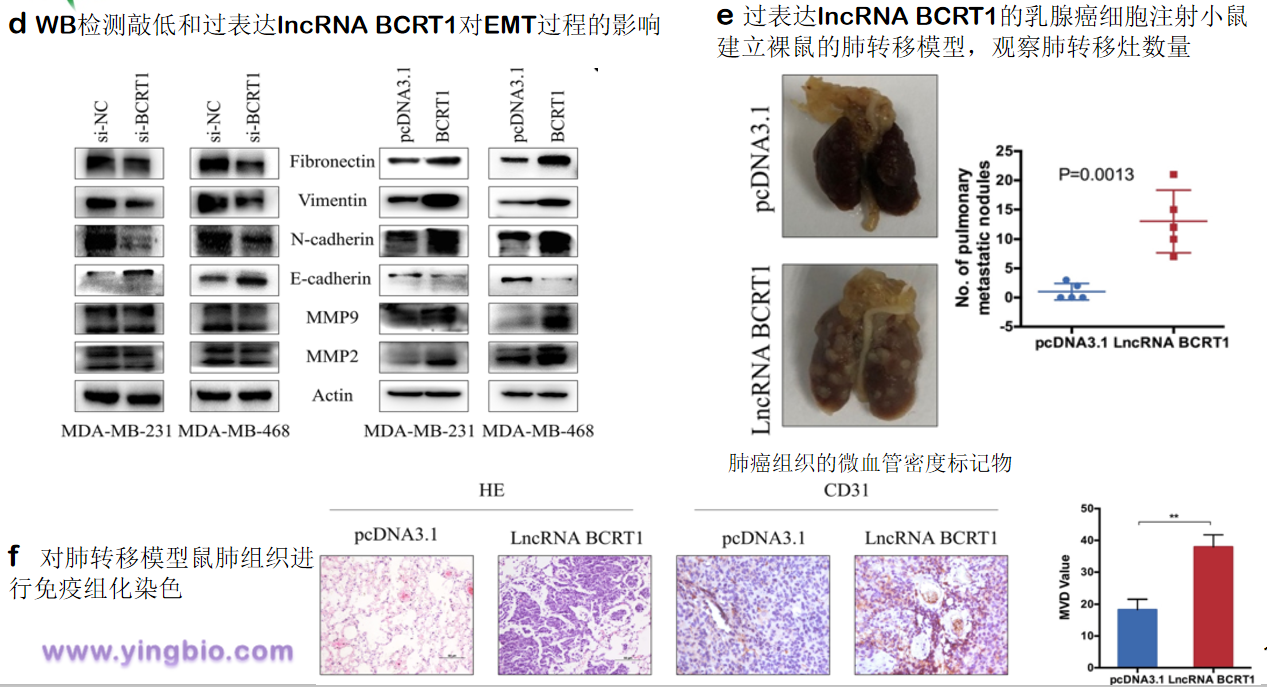
四、LncRNA BCRT1在乳腺癌细胞中起miR-1303海绵的作用
据报道,许多lncRNA在调节miRNA的表达和生物学功能中起竞争内源性RNA(ceRNA)的作用。研究决定,该研究选择miR-1303作为lncRNA BCRT1的抑制靶标,以进一步研究乳腺癌。



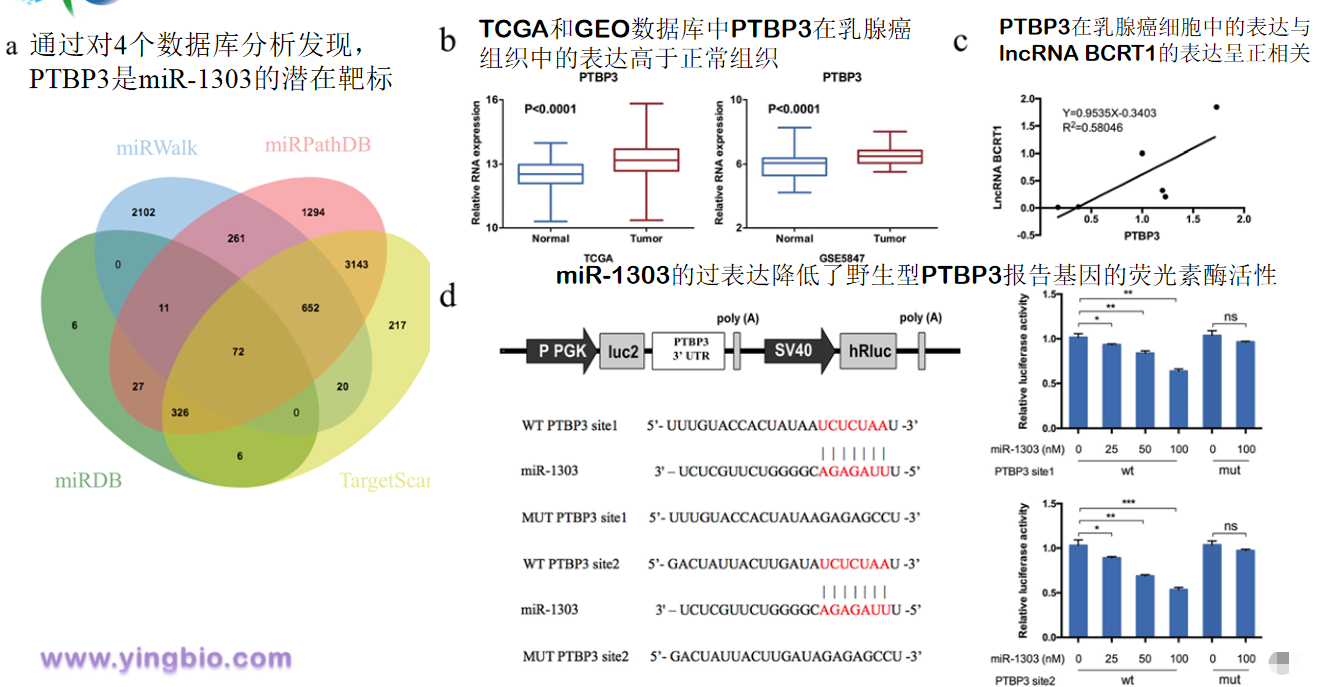
五、LncRNA BCRT1通过抑制miR-1303上调PTBP3表达
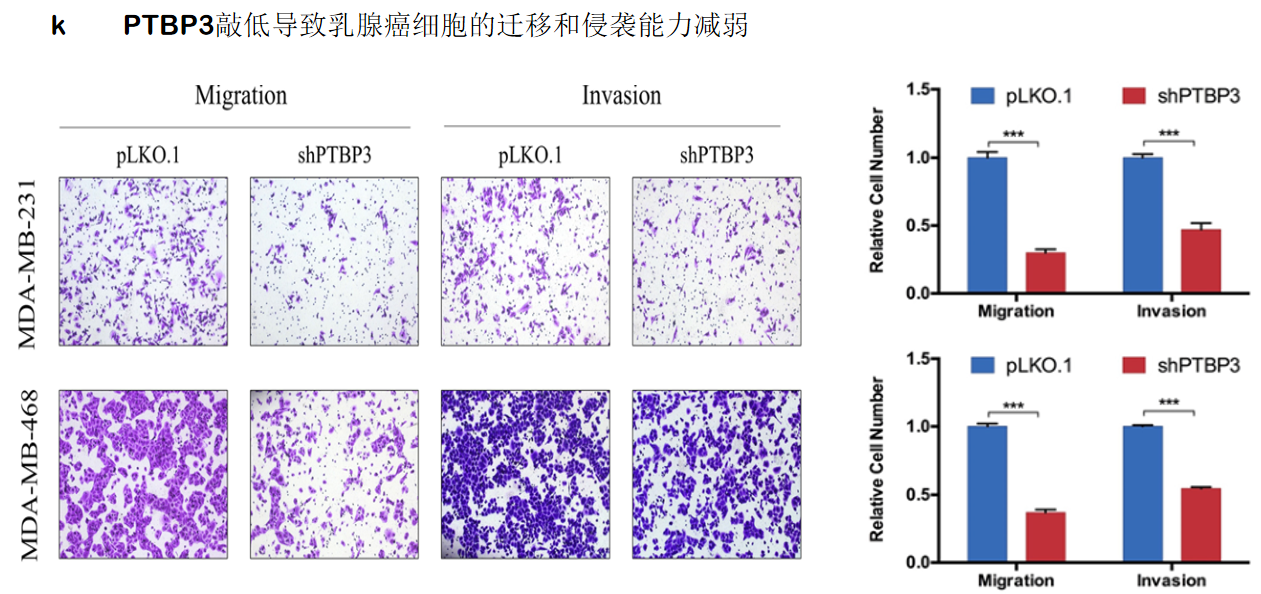
使用miRDB,miRWalk,miRPathDB和TargetS-can数据库,我们发现PTBP3是miR-1303的潜在靶标。经表明,PTBP3充当乳腺癌的肿瘤启动子,而lncRNA BCRT1通过调节miR-1303在调节PTBP3的表达中起着重要作用。

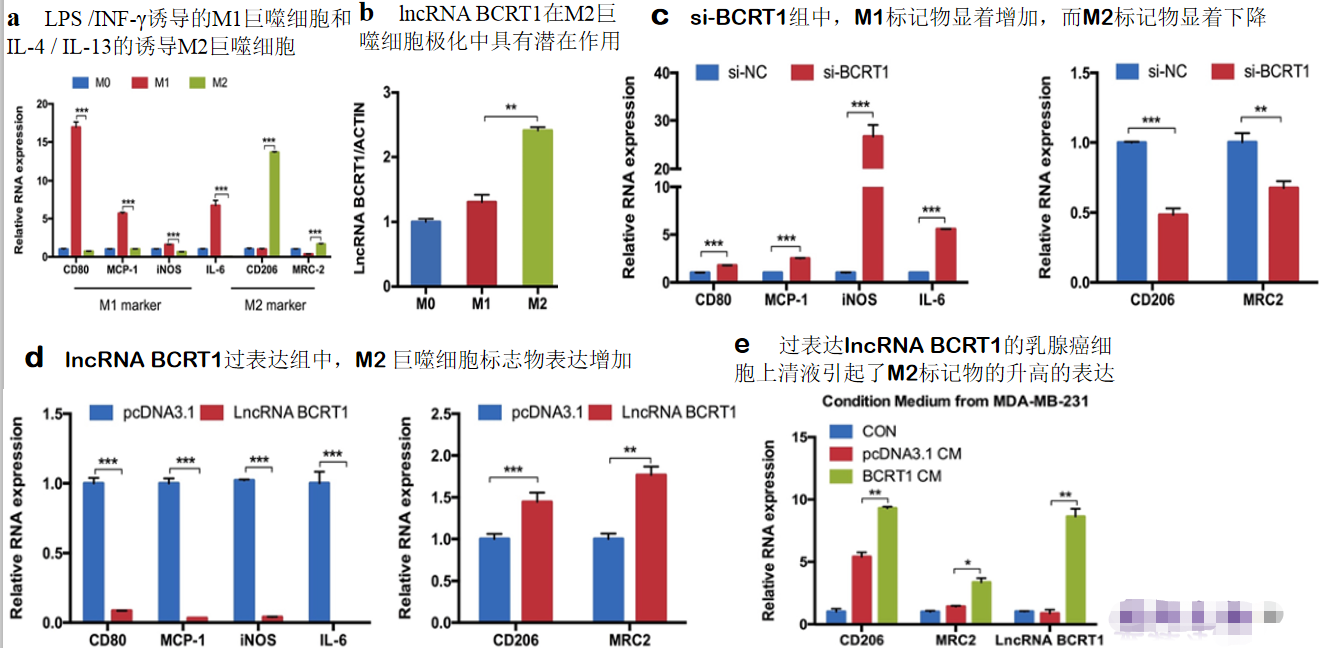
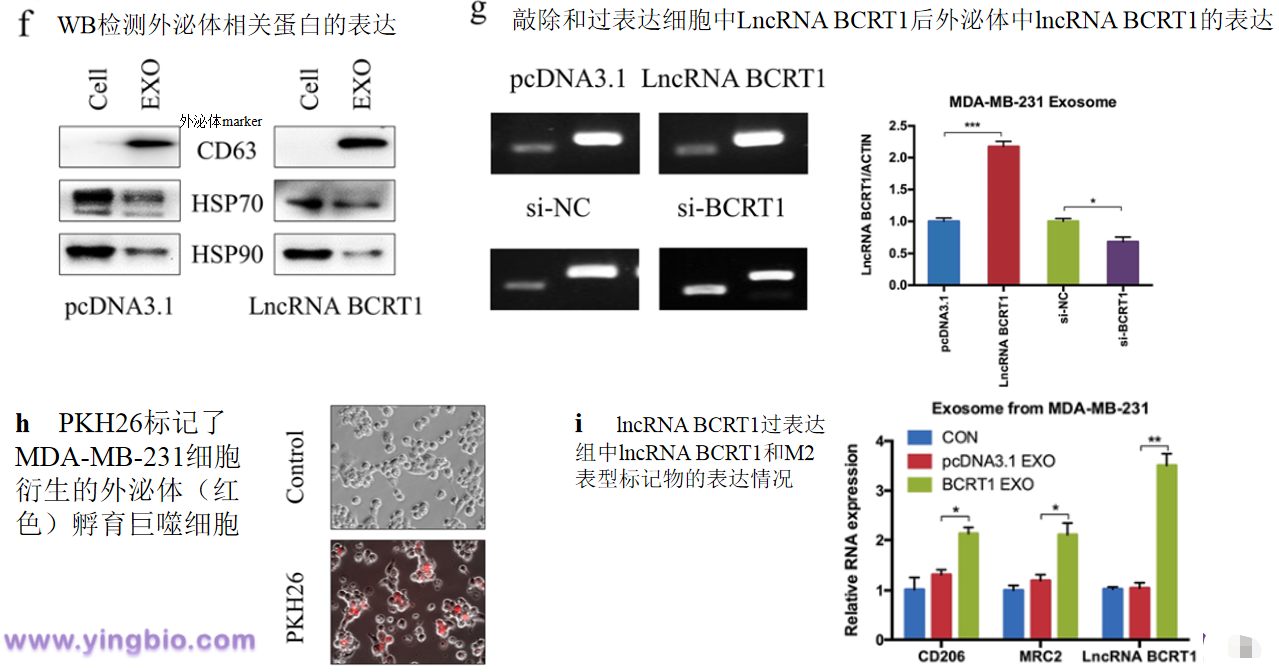
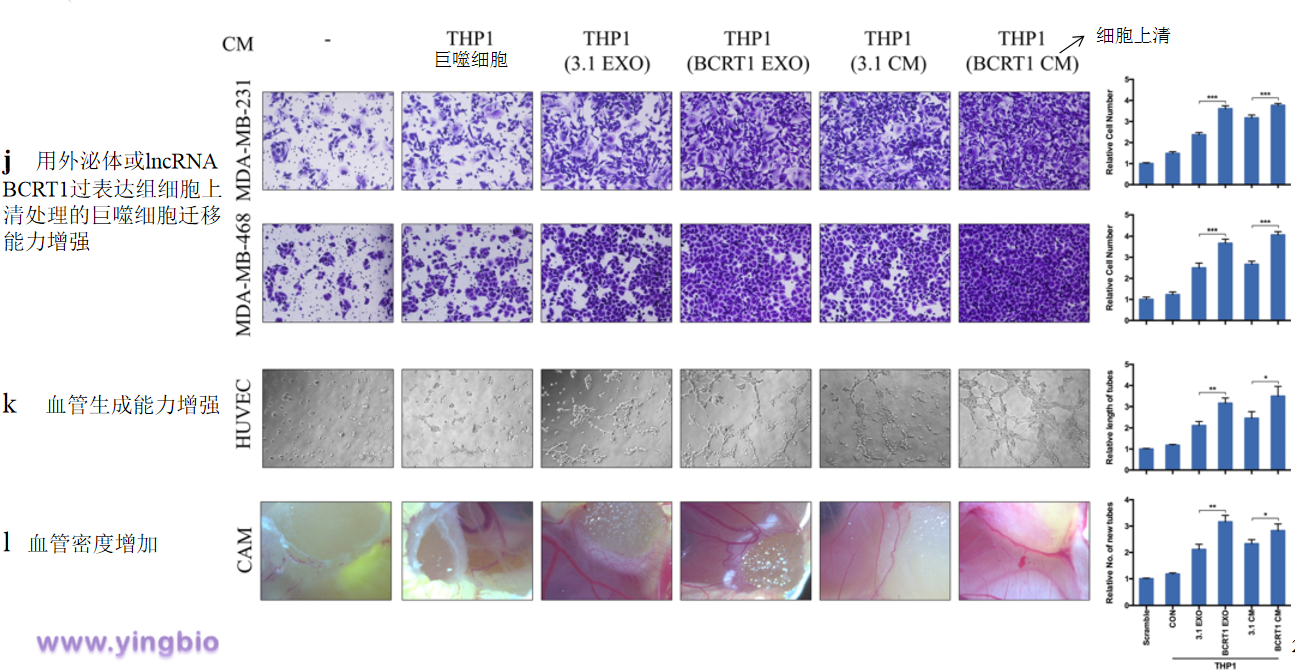
六、外泌体lncRNA BCRT1促进M2表型极化并增强巨噬细胞诱导的肿瘤进展
先前的研究已经报道,被认为具有M2样表型的肿瘤相关巨噬细胞(TAM)是肿瘤微环境(TME)中最丰富的免疫相关细胞,并通过介导血管生成,转移和免疫来参与肿瘤发展。我们评估了lncRNA BCRT1,M1标记和M2标记在非极化巨噬细胞,LPS /INF-γ诱导的M1巨噬细胞和IL-4 / IL-13诱导的M2巨噬细胞中的表达。然后,我们试图研究介导乳腺癌细胞和巨噬细胞之间的通信的机制。各种研究报道,lncRNAs可以被外泌体转移以调节肿瘤微环境。这些结果表明lncRNA BCRT1可以通过外泌体转移,从而促进M2表型极化并增强其肿瘤促进功能。
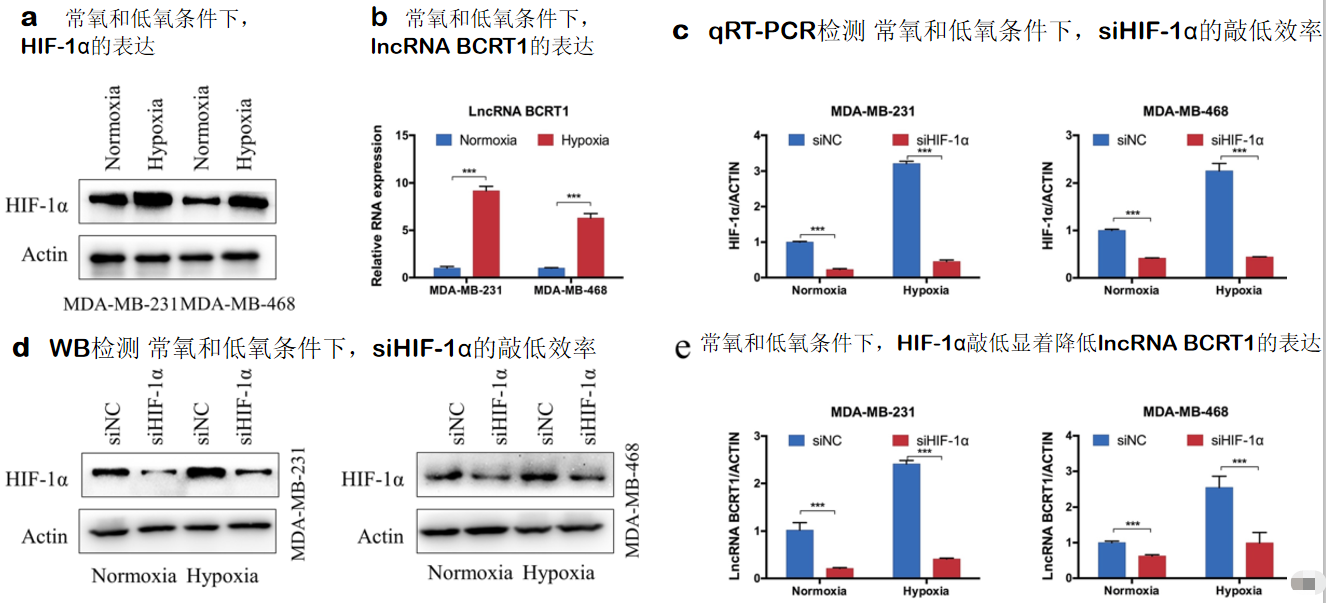
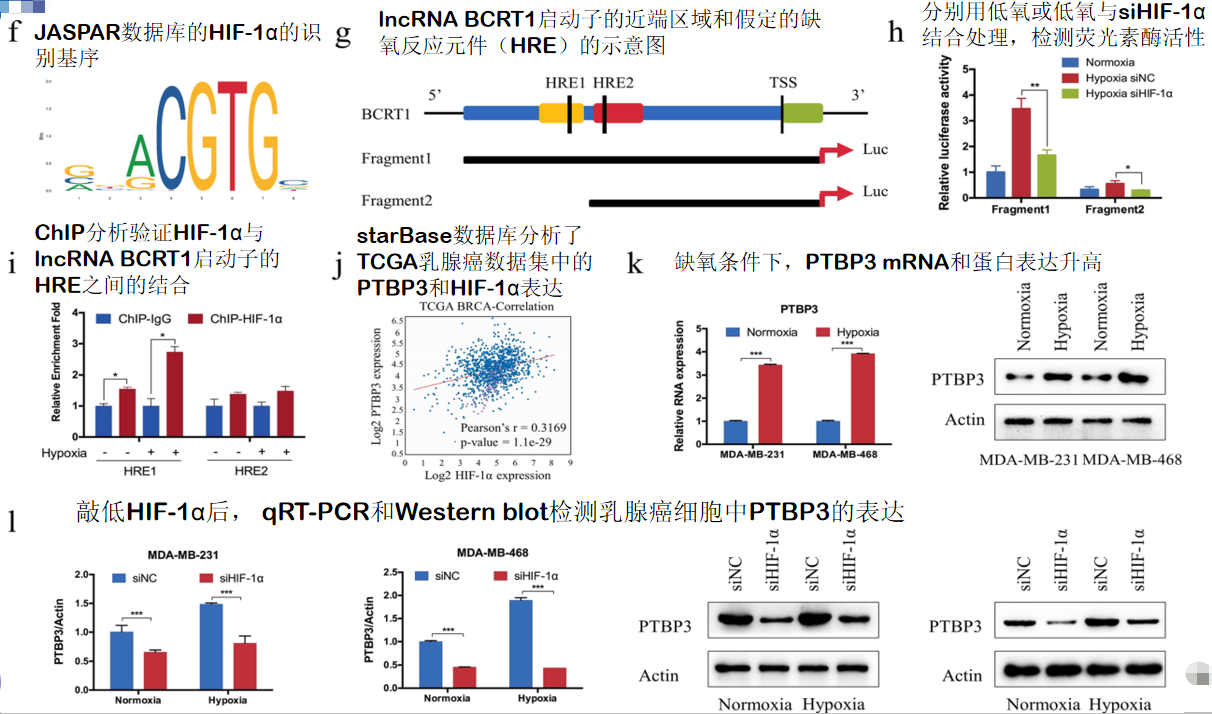
七、低氧条件下LncRNA BCRT1受HIF-1α转录调控
缺氧是各种癌症的主要肿瘤内特征之一,一些研究表明,癌症的低氧微环境可能是某些lncRNA异常表达的原因。为了研究lncRNA BCRT1是否为缺氧敏感的lncRNA,及一系列的相关机制,乳腺癌细胞经过缺氧或常氧处理48小时。研究结果表明,低氧通过与启动子上的HRE1直接结合而由HIF-1α转录调控lncRNA BCRT1的表达。
八、LncRNA BCRT1介导低氧诱导的乳腺癌细胞恶性特性
缺氧是肿瘤微环境的标志,并与多种实体瘤的增殖,转移和耐药性有关。通过缺氧处理研究发现,lncRNA BCRT1可能参与缺氧诱导的乳腺癌细胞生物学功能。


结 论:
1.LncRNA-BCRT1通过与miR-1303竞争性结合发挥肿瘤启动子的作用,保护PTBP3不被降解,从而促进乳腺癌细胞在体内外的生长和进展。
2.lncRNA-BCRT1可以通过外泌体转移到巨噬细胞中,促进M2极化,增强其对肿瘤进展的作用。
3.lncRNA-BCRT1是通过HIF-1α依赖性转录调控在缺氧条件下诱导的,从而促进了缺氧诱导的EMT。
4.研究结果为乳腺癌的转移机制提供了新的见解,为乳腺癌的治疗提供了一个有希望的靶点。






