新突破!miR-126-5p对caspase-3的非典型抑制可通过动脉粥样硬化自噬对内皮细胞起到保护作用
近日,一项刊登在国际杂志Science Translational Medicine(IF=16.304)上的文章 “The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression”,来自德国慕尼黑大学等机构的科学家们通过研究描述了一种miRNA分子异常不同的作用方式;研究人员表示,通过简单地与miR-126-5p相互作用就能促进其转移到细胞核中,并能抑制酶类caspase-3的活性,caspase-3主要会通过程序性细胞死亡的方式来杀灭细胞,以这种方式,miR-126-5p分子就能保护血管完整并减少动脉粥样硬化的病变的程度。

除了通过引导argonaute (AGO)蛋白靶向RNA诱导沉默复合物(RISC)中的RNA转录调控基因表达外,尚不清楚microRNAs (miRNAs)是否也可以通过其他机制调节细胞功能。miRNA发挥其转录后活性,miRNA需要多种成分,如高分子量RISCs中含有适配器6A (TNRC6A)的三核苷酸重复,以便miRNA与目标mRNA的3' 端UTR'区域以及介导翻译抑制或RNA衰减的酶相互作用。miRNAs可保留在与AGO2结合的低分子量复合物(LMW)中,不结合mRNA或参与靶mRNA抑制。尽管被看作是一个miRNA库, 这些复合物是否能使宿主miRNAs蛋白相互作用,而且这些蛋白不参与典型的RISC功能。这些miRNAs是否能对蛋白质活性发挥直接的翻译后作用,以及这与它们在细胞内的转运有何关系。
LMW复合物的组装是由哺乳动物雷帕霉素靶蛋白(mTOR)复合物I控制的,并且主要受mTOR抑制. mTOR的抑制是自噬最强大的触发因素之一,自噬是真核细胞用来适应应激、维持营养稳态的分解过程, 用于介导质量控制和受损细胞器和蛋白质聚合体的溶酶体降解。在内皮细胞(ECs)中,自噬通量通过mTOR途径被高剪切应力(HSS)触发,并在动脉粥样硬化的易感区域受损,但在这一背景下,层切应力和自噬调节miRNA命运和功能的机制尚不清楚.
Krüppel-like家族的转录因子(KLFs)是自噬的重要调控因子,是控制成熟miRNA表达的miRNA加工机制的变阻器。KLF2在动脉内皮细胞中协调大部分剪切应力诱发的转录程序,并且是斑马鱼血流量依赖性miR-126表达所必需的。在内皮高表达的mirna中,miR-126双链有助于血管生成和血管完整性,具有特异功能和稳态稳定。miR-126-5促血管生成和抗炎信号传导,miR-126-5p维持EC增殖储备,调节不同的靶点和通路。根据功能差异,只有miR-126-5p在动脉内皮细胞层流中上调,以限制HSS区域的动脉粥样硬化(16)。尽管这两条链是由一个共同的前体由核糖核酸内切酶Dicer处理的,但它们的动脉数量不受EC特异性Dicer缺失的影响。因此,miR-126链的差异调控并不依赖于转录或处理,这使得诸如剪应力引起的自噬等潜在机制有待阐明。在本研究中,我们试图详细说明EC自噬在HSS上的strand特异性调控和miR-126在细胞内转运中的作用,并明确鉴定了RNA结合蛋白Mex3a在miR-126-5p核富集中的作用。
研究者Donato Santovito说道,较高的剪应力往往会在内皮细胞触发一个多步骤过程,从而导致miR-126-5p和RNA结合蛋白之间形成分子复合体,随后这种复合体就会被运输到细胞核中。一旦进入细胞核,miR-126-5p就会被复合体释放并与caspase-3酶结合从而抑制其活性,caspase-3自身是程序性细胞死亡的一个重要介导子,如今研究者知道多种因素能够增加机体患动脉粥样硬化的风险,并促进内皮细胞发生细胞凋亡;比如血流紊乱、高水平胆固醇和高水平葡萄糖,因此,通过抑制caspase-3酶,细胞核的miR-126-5p就能保护内皮细胞免受诱导性的细胞死亡,此外,这样还能减少高剪应力部位内皮细胞对损伤的敏感性,这的确是一种保护机体抵御动脉粥样硬化的机制,因此,通过维持内皮细胞表面的完整性,miRNA就对整个机体血管系统做出了重要贡献。最后,研究者Weber表示,miR-126-5p迄今为止未知的功能代表了一种生物学调节原理,其能补充此前未被研究人员很好描述的机制,后期研究人员希望能够通过与其他研究人员同理合作来调查是否其它miRNAs分子也能以类似的方式来发挥作用,此外,进一步阐明这种信号通路作用的机制或为后期科学家们开发治疗心血管疾病的新型疗法提供新的思路。
Figure1:klf2诱导的自噬引起miR-126链的差异调控和miR-126-5p核定位

(A)pre - miR-126、miR-126- 3p和miR-126-5p在KLF2过表达HUVECs (n = 5 ~ 7)和(B) cdh5crecreklf2fl /fl (klf2eci - ko)和对照组(野生型(WT))主动脉内膜中的表达(n = 4 ~ 5)。
(C) Western blot分析KLF2过表达后的自噬标记,(D)密度测定LC3-II/LC3-I比值和p62表达(归一化为-actin) (n = 4)。
(E)雷帕霉素和巴菲霉素处理的HUVECs中miR-126-3p和miR-126-5p的含量(n = 6)。
(F)有无雷帕霉素处理的HUVECs中miR-126-3p和miR-126-5p模拟物的代表性免疫荧光(绿色)。标尺,5米。
(G)定量每个细胞的细胞质模拟病灶(n = 4 ~ 5)和(H)模拟和Hoechst核染料的皮尔逊s共定位系数(n = 39 ~ 69个细胞)。
(I) 雷帕霉素处理后内源性miR-126链在HUVECs中的核浆分布(n = 4)。
(J) 在接受雷帕霉素和沉默的自我吞噬病原蛋白质(ATG5或ATG7)或cotreated importin抑制剂伊维菌素(n = 3 - 6) HUVECs中,细胞核(Nuc)和细胞质(Cyto)中miR-126-5p的含量 (K) 在自噬速率限制蛋白(ATG5或ATG7)沉默或输入素抑制剂伊维菌素(n = 3 ~ 6)和(K)共处理的HUVECs中细胞核(Nuc)和细胞质(Cyto)中miR-126-5p的含量。
Fig. 2: miR-126-5p的优先核转移与其种子序列无关
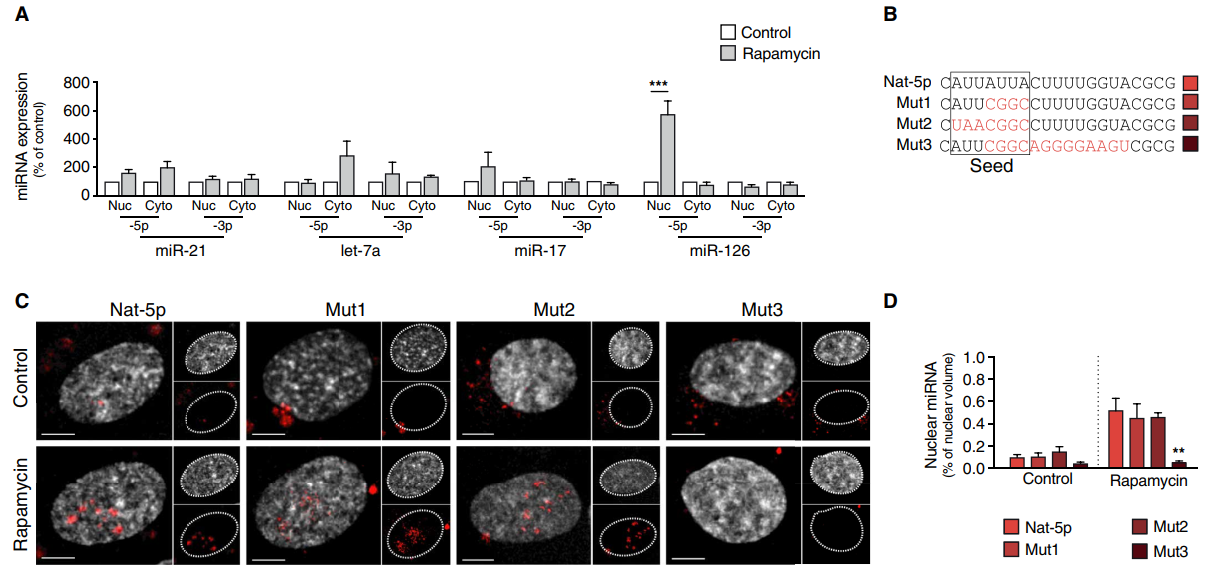
(A) qPCR检测经或不经雷帕霉素处理的HUVECs中miR-21、let-7a、miR-17和miR-126的细胞核和细胞质数量(n = 3至4)。
(B) HUVECs中转染miR-126-5p序列和突变体(Mut1到Mut3)。
(C)共聚焦显微镜显示miR-126-5p (Nat-5p)和突变体(Mut1到Mut3,红色)在4,6 -二氨基-2-苯基吲哚(DAPI)染色核(灰色)中定位。
(D)定量三维反褶积和渲染后评估的突变体所占的平均核体积(n = 4至6)。
Fig. 3: 核miR-126-5p与RNA结合蛋白Mex3a和AGO2相互作用
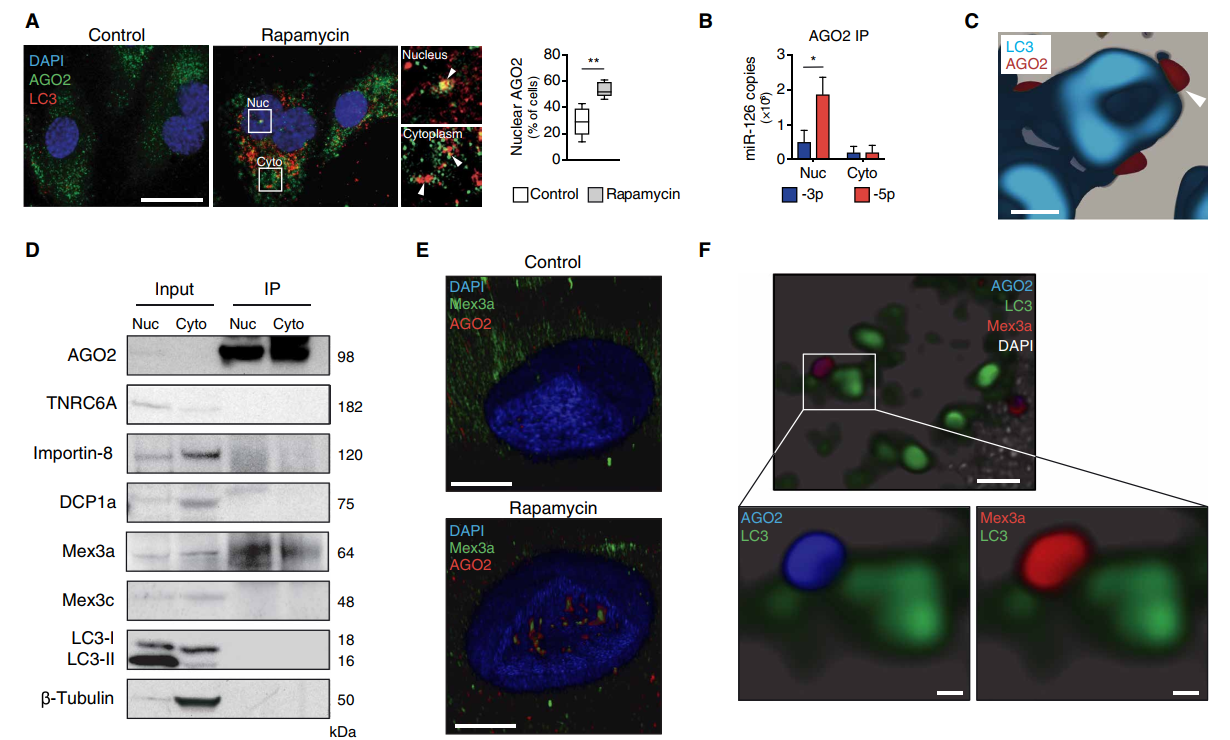
(A)免疫荧光法检测拉帕霉素处理的HUVECs和对照组的AGO2和LC3,并定量AGO2阳性细胞核细胞。Insets显示同步信号(白色箭头)(n = 5)。标尺,20米。
(B) rapamycin处理的HUVECs中细胞核和细胞质AGO2的RNA-IP显示miR-126链负载。
(C) STED nanoscope在lc3界限的囊泡外表面显示AGO2信号(白色箭头)。标尺,200nm。
(D) AGO2和Mex3a在雷帕霉素治疗的HUVECs中的Co-IP。
(E) 3D共聚焦显微镜观察rapamycin处理的HUVECs和对照组细胞核中的AGO2和Mex3a。标尺,5米。
(F)修饰的纳米镜详细描述了rapamycin治疗的HUVECs中AGO2:Mex3a:LC3细胞质复合物。标尺,1米(顶部)。两个荧光通道(AGO2与LC3和Mex3a与LC3)在底部面板显示复合物的放大。
Fig. 4: Mex3a优先结合miR-126-5p来驱动核富集
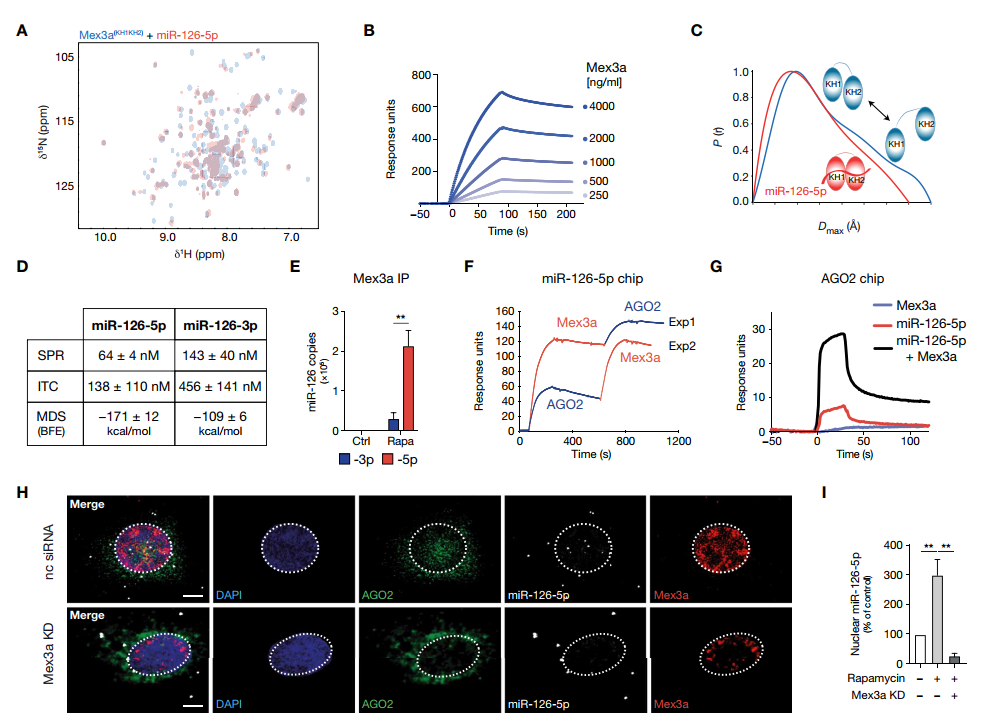
(A)在没有miR-126-5p(摩尔比,1:2)或存在miR-126-5p(红色)情况下,Mex3a(KH1KH2) 1H-15N HSQC光谱的覆盖。
(B)固定miR-126-5p与全长Mex3a相互作用的SPR传感器图。KD = 3.6 2.9 nM。
(C)无miR-126-5p(蓝色)或有miR-126-5p(红色)时,来自Mex3a(KH1KH2)的SAXS的成对距离分布。
(D) Mex3a与miR-126-5p和miR-126-3p相互作用的估计结合亲和参数表。
(E)未使用(Ctrl)和使用雷帕霉素(Rapa)处理的HUVECs核裂解液中Mex3a的RNA-IP显示miR-126链负载(n = 3)。
(F) SPR传感器图显示序列加载的全长重组蛋白Mex3a和AGO2 (Exp1)在固定化miR-126-5p上相互作用,反之亦然(Exp2)。
(G)全长Mex3a、miR-126-5p或其组合灌注在AGO2上的SPR检测图显示,在与miR-126-5p的复合物中,Mex3a和AGO2有明显的相互作用。
(H)有或没有Mex3a KD的rapamycin治疗的HUVECs中,miR-126-5p(灰色)的荧光原位杂交(FISH)和AGO2(绿色)和Mex3a(红色)的典型反压缩图像。
(I)雷帕霉素和Mex3a沉默后HUVECs中核miR-126-5p的数量(n = 5)。
Fig. 5: 核miR-126-5p抑制细胞凋亡

(A)雷帕霉素和miR-126-5p诱导ec相关基因变化的Circos图。热图显示了与对照组(内)和与雷帕霉素和miR-126-5p模拟物或抑制剂(外)处理的细胞相比,雷帕霉素处理的HUVECs的相对表达。KEGG功能类别以条带表示,(B)按褶皱富集程度排序。HIF-1,缺氧诱导因子1;ECM,细胞外基质;TNF,肿瘤坏死因子。
(C)对对照组和雷帕霉素处理的具有miR-126-5p的凋亡介质进行Western blot分析,或(D)在Mex3a KD与对照组siRNA (nc)对比后进行细胞凋亡介质的Western blot分析,包括标准化密度分析。PARP,保利(ADP-ribose)聚合酶。
(E)代表流式细胞仪分析和量化(F)的细胞凋亡率(膜联蛋白V +细胞百分比)雷帕霉素治疗后3小时(n = 10)和mir - 126 - 5 - p抑制(5 p异烟肼)(n = 10)或Mex3a KD (n = 10) (G)在Mex3a超表达有或没有mir - 126 - 5 - p抑制剂(n = 7), 7-AAD 7-aminoactinomycin D;FITC,异硫氰酸荧光素。
Fig. 6: miR-126-5p与caspase-3相互作用抑制其活性
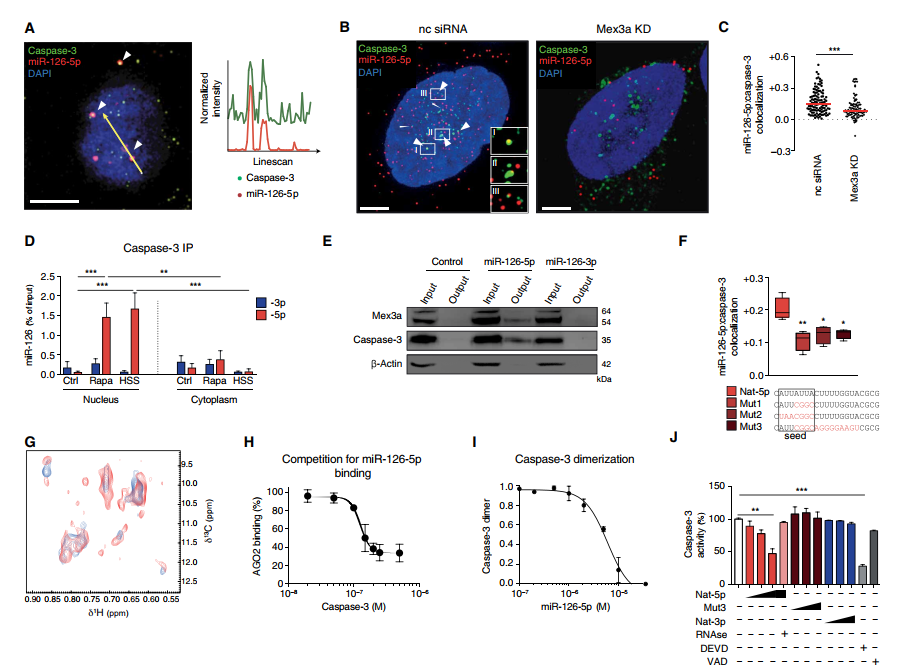
(A) miR-126-5p鱼的典型反卷积图像(红色)和caspase-3的共免疫染色(绿色)显示细胞核和核周围区域的共定位信号(白色箭头)。图中显示了在橙色箭头标记的位置上绿色和红色通道的归一化荧光强度曲线。标尺,5米。
(B)代表deconvoluted图像为鱼mir - 126 - 5 - p和coimmunostaining caspase-3 rapamycin-treated HUVECs转染与小干扰rna(数控siRNA)或非特异性核对抗Mex3a (Mex3a KD)和(C)皮尔森系数caspase-3和mir - 126 - 5 - p colocalization,红线表示中位数(n = 100 - 110)。
(D) RNA-IP核和细胞质caspase-3 mir - 126链加载HUVECs对待雷帕霉素(n = 6)或暴露于层流剪切应力(高速钢、12达因/ cm2) (n = 3)和控制(n = 9)。(E) Biotin-RNA下拉HUVECs mir - 126股转染的显示与Mex3a互动和caspase-3雷帕霉素治疗后。
(F)在雷帕霉素处理的HUVECs中miR-126-5p突变体和caspase-3共定位的Pearson s系数(n = 4)。红色代表变异的核苷酸。
(G) 1H13C甲基ILVM、2h标记的caspase-3(蓝色)与miR-126-5p复合物(红色)的二维核磁共振谱叠加,摩尔比为1:3。
(H)利用AGO2和caspase-3对固定化miR-126-5p竞争性结合实验(n = 3), IC50 = 126.9 nM。(我)Competition-binding试验使用caspase-3单体和mir - 126 - 5 - p (n = 3)。IC50 = 6.0 M (J)分析游离caspase-3活动存在mir - 126 - 5 - p (Nat-5p), mir - 126 - 5 - p突变(Mut3), mir - 126 - 3 - p (Nat-3p)(4、8、16米),核糖核酸酶,caspase-3抑制剂Z-DEVD-FMK (DEVD),或Z-VAD-FMK(10米)(n = 3)。
Fig. 7: 删除Atg5或Mex3a可减弱细胞核miR-126-5p-AGO2的穿梭,从而在体内驱动内皮细胞凋亡和动脉粥样硬化
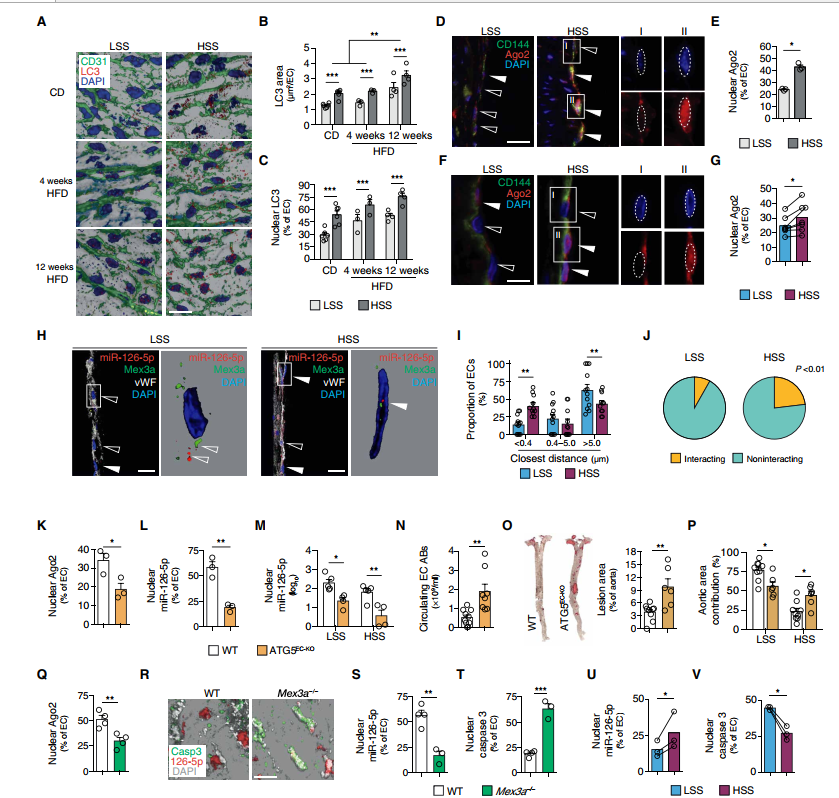
(A) 3 d反褶积显微镜(B)量化LC3 +区域和(C) ECs的百分比显示核LC3在面对主动脉弓(低剪切应力(LSS)]与胸主动脉(高剪切应力(HSS)]的载脂蛋白e /老鼠(n = 3 - 6) fed chow (CD)或高脂肪饮食(HFD) 4到12周。
(G) (D)免疫荧光和ECs的百分比显示核AGO2 (D和E)主动脉弓(LSS)和胸主动脉(HSS)的载脂蛋白E /老鼠(n = 3)在HFD 12周或(F和G)人类颈动脉标本收集上游(HSS)和下游(LSS)的分岔(n = 7)。地区I和II (D和F)的放大了ECs的insets显示单通道的细节,没有(我或空箭头)和核AGO2 (II或填充箭头)。标尺,20米。
(H)在人类颈动脉标本的分叉上游(HSS)或下游(LSS,覆盖动脉粥样硬化)中,共聚焦去折叠显微镜检查Mex3a免疫染色,并FISH检查经vWF染色的ECs核中的miR-126-5p (n = 3)。标尺,20米。
(I)定量EC核内Mex3a与miR-126-5p的最近距离,每个区域12个视野。分布显示了总距离和(J)相互作用代理定义的距离低于分辨率限制240纳米。(K to P)对Apoe / Cdh5Cre+Atg5fl/fl (ATG5EC-KO)和Apoe / cdh5c -Atg5fl/fl WT小鼠进行为期12周的实验研究。
(K)胸主动脉显示细胞核AGO2(免疫荧光)和(L) miR-126-5p(原位PCR)的ECs百分比(n = 3)。
(M) miR-126-5p在主动脉弓(LSS)和胸主动脉(HSS)中的核表达(n = 4 ~ 5)。
(N)血浆中的循环内皮抗体(N = 8 ~ 10)。
(O)油红色主动脉的动脉粥样硬化病变区域,(P)主动脉弓(LSS)和胸腹主动脉(HSS)的部分贡献(n = 6 ~ 9)。
(Q) C57Bl6/NCrl (WT)和Mex3a /小鼠胸主动脉ECs显示细胞核AGO2的百分比(n = 4)。
(R) FISH检测WT和Mex3a /小鼠en face胸主动脉中miR-126-5p,共免疫染色检测caspase-3和CD31。标尺,20米。
(S)显示核miR-126-5p和(T) caspase-3的ECs百分比(n = 3至4)。
(U)分叉下游(LSS)或上游(HSS)人类颈动脉标本中显示核miR-126-5p和caspase-3的ECs百分比(n = 3)。






