灰血小板综合征免疫失调和颗粒缺陷的新临床表现
2020年7月,《Blood》杂志发表“Novel manifestations of immune dysregulation and granule defects in gray platelet syndrome.”文章,IF=17.543,此报道发现了GPS患者的新特征,包括白细胞减少、自身免疫性病变、髓细胞粒度过细和促炎血浆蛋白组。通过评估GPS患者临床和细胞水平的表型,进一步证明了Nbeal2在血小板和免疫细胞的颗粒和细胞生物学中的作用,并强调了之前与这种罕见的出血疾病无关的免疫失调。

NBEAL2双等位基因变异导致灰色血小板综合征(GPS)的发现是血液学的一个重要进展,提高了我们对血小板和颗粒生物学的理解。Nbeal2 - / -小鼠拟表型GPS的特点,包括出血,血小板减少症,缺乏血小板α(ɑ)颗粒,脾肿大,骨髓(BM)纤维化。Nbeal2-/-小鼠对细菌和病毒感染的易感性与器官损伤增加、存活率降低和感染后恢复时间更长有关。这是由自然杀伤细胞和中性粒细胞分泌颗粒的缺陷导致的。此外,在贮藏囊泡中,Nbeal2-/-小鼠的肥大细胞不足,单核细胞的颗粒度降低。Nbeal2-/-巨核细胞(MKs)具有促炎特性。这些报道强调了Nbeal2对MKs、血小板以及小鼠中多种骨髓和淋巴细胞的正常颗粒功能很重要。然而,在小鼠模型中观察到的免疫细胞缺陷是否与GPS的病理生理学相关,目前还不清楚。GPS患者研究表明复发感染和自身免疫性淋巴增生综合征(ALPS)的不典型表现。对GPS患者的中性粒细胞超微结构进行了评估:一些报告显示中性粒细胞颗粒被保留,而另一些报告指出中性粒细胞颗粒没有被保留。鉴于发表的关于NBEAL2病因变异确诊的GPS患者的研究很少,我们建立了一个国际合作来系统性评估大量的患者临床和实验室表型。我们将重点放在与免疫相关的特征上,随后使用蛋白质谱(MS)和RNA测序(RNA-seq)对患者亚群中的血浆、血小板和三种不同白细胞群体进行了分子表征。
一、NBEAL2变异导致GPS

A)利用Genome Reference Consortium human Genome build 37 (GRCh37)测定3号染色体上56个相对于NBEAL2的仅有变异位点(Chr 3)。垂直的黑色条代表外显子。
B)根据美国医学遗传学和基因组学学院(ACMG)指南,根据致病性分类的独特变异的频率22。
C)与Nbeal2的氨基酸序列和已知功能域(x轴上)相比,错义变异的位置。变异的y轴位置为其利用ConSurf38计算的估计进化保护分数。得分为正则表示保护程度较低,得分为负则表示保护程度较高。垂直灰色线代表50%置信区间的保守分值范围:柱的底部和顶部分别为推断出的进化率分布的第25个百分位数和第75个百分位数。
二、新的临床表型
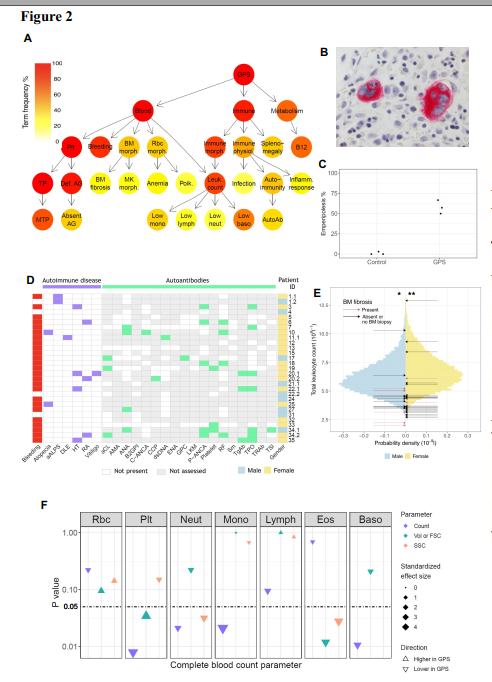
A) 人类表型本体论(HPO)树,显示了47例GPS患者最常见的3个HPO器官系统:血液(血液和血液形成组织异常)、免疫(免疫系统异常)和代谢(代谢/稳态异常)。
HPO 相关术语:Plt,血小板形态异常; Bleeding,非正常出血; BM形态、骨髓细胞形态异常;红细胞变形、红细胞形态异常;免疫变形。免疫系统形态异常;免疫杂志。免疫系统生理异常;脾肿大,脾肿大; B12,维生素B12水平异常;TP,血小板减少症;颗粒数异常;骨髓纤维化,骨髓纤维化;可变形。巨核细胞形态异常;贫血,贫血; Poik。异形红细胞症; Leuk。白细胞计数异常;感染,反复感染;自身免疫、自身免疫; MTP Macrothrombocytopenia;无AG,无颗粒;低单核细胞减少;低淋巴,淋巴减少;低中性,中性粒细胞减少;低碱性,嗜碱性细胞计数减少;自体免疫抗体阳性。
B)患者ID 20.3的CD61染色BM trephine 图像(1000x),两个MKs显示中性粒细胞分裂。
C)三位GPS患者(患者编号18、33和34.1)MKs伴中性粒细胞增多百分比的点图;
D)对29例GPS患者(按患者身份标记)进行自身抗体检测的自身免疫性疾病表现、自身抗体检测结果和出血症状。
Abbreviations: aALPS, 盘状红斑狼疮; HT,桥本甲状腺炎; RA, 类风湿性关节炎; 自身抗体:aCL,心磷脂; AMA、线粒体; ANA, 核;B2GPI beta2-glycoprotein 1;C-ANCA,中性粒细胞胞质; CCP, 环瓜氨酸肽; ENA,可提取的核抗原; GPC, 胃壁细胞;LKM,肝肾微粒体;P-ANCA,中性粒细胞细胞核周围的; RF, 类风湿因子;Sm, spliceosomal;TgAb甲状腺球蛋白; TPO, thyroperoxidase;TRAb,促甲状腺激素受体;TSI,甲状腺刺激免疫球蛋白。
E)白细胞总数的柱状图
F) 5例GPS患者与5例对照的CBC(全血计数)。
三、血小板、中性粒细胞、单核细胞和cd4淋巴细胞的转录组和蛋白质组
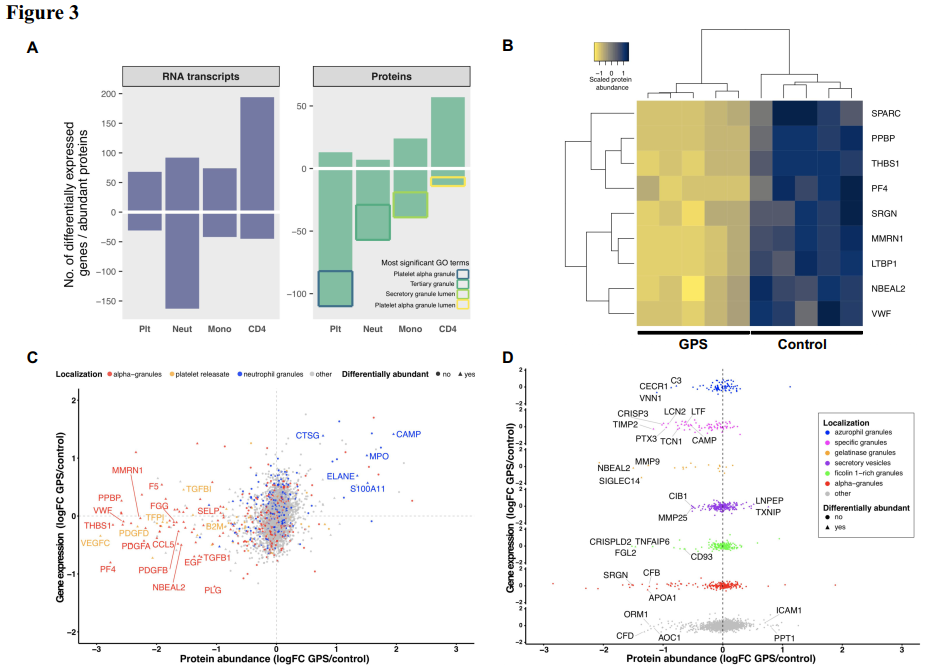
A)RNA-seq差异表达基因(左)和MS差异丰富蛋白(右)条形图。由于自身免疫性疾病的倾向和CBC参数的改变,全面地了解GPS患者CBC参数在细胞表型上的差异。用RNA-seq和蛋白质谱分析血小板、中性粒细胞、单核细胞和cd4淋巴细胞,并将结果与5个对照组进行比较。通过主成分分析,除血小板RNA-seq外,其他数据清晰地描绘了GPS和对照样品(Supp.图3.1)。在每种血细胞类型中,差异表达基因的数量从95到255不等,差异丰富蛋白的数量从63到123不等(图3A;在血小板、中性粒细胞和单核细胞中123、65和63个差异丰富蛋白中,GPS患者分别减少89%、86%和62%。这些被还原的蛋白质在GO术语中富集,这些条目与细胞颗粒及其管腔有关。包括Nbeal2在内的9种蛋白在GPS患者中显著降低。少的蛋白质不同GPS血小板丰富,有一个显著的代表的蛋白质在ɑ颗粒和/或血小板释放物. 然后我们检查了这13种不同程度上在GPS血小板中更丰富的蛋白质。其中5个,包括弹性蛋白酶(Elane)和髓过氧化物酶(Mpo),已知定位于中性粒细胞颗粒(figure 3C)。在GPS中性粒细胞中减少的56个差异丰富的蛋白中(图3A), 36个(65%)可以被划分为不同的颗粒亚型(figure 3D).
四、GPS血浆蛋白质组具有促炎和肝脏特征
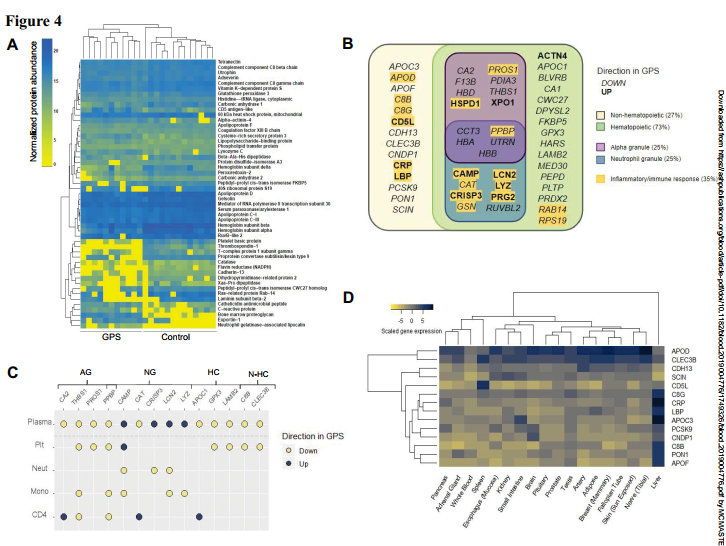
作者推测颗粒异常的血细胞评估可能导致系统性的血液循环改变。为此,我们分析了11例患者和13例对照组的血浆。首先,对分离的患者和对照样本的血浆蛋白归一化浓度进行无监督随机森林分析,并确定51个鉴别蛋白(图4A),分析结果显示,11个和40个鉴别蛋白在患者中分别有较高和较低的浓度。GO富集分析强调了与炎症和免疫反应相关的条目的存在,特别是在GPS血浆中更丰富的11种蛋白的topGO术语中(图4B);随后鉴别血浆蛋白与四种细胞类型的蛋白质组重叠。在至少一种细胞类型的蛋白质组中,有14种血浆蛋白的丰富程度存在差异,但其方向模式因蛋白而异(图4C)。此外,蛋白质,少在GPS血小板丰富的蛋白质组也丰富GPS等离子体,包括蛋白质局部ɑ颗粒。与此相反,血浆中四种高水平的重叠蛋白都存在于中性粒细胞颗粒中。其中抗菌肽(Camp)、富含半胱氨酸的分泌蛋白3 (Crisp3)和中性粒细胞明胶酶相关的脂质钙蛋白(Lcn2)在GPS中性粒细胞中含量较低,且均定位于中性粒细胞特异性颗粒。






