MIRNA调控影响鼻咽癌恶性表型
作为转录后负调控子,microRNA(miRNA)调节人类三分之一以上的mRNA,进而发挥重要的生物学调控功能。研究发现,失调的miRNAs参与了癌症的进展、转移和不良预后。自噬是一种动态的分解代谢过程,吞噬和消化损坏细胞器和蛋白质聚集体。自噬和miRNAs在鼻咽癌中的故事由此展开。
技术路线:

结果:
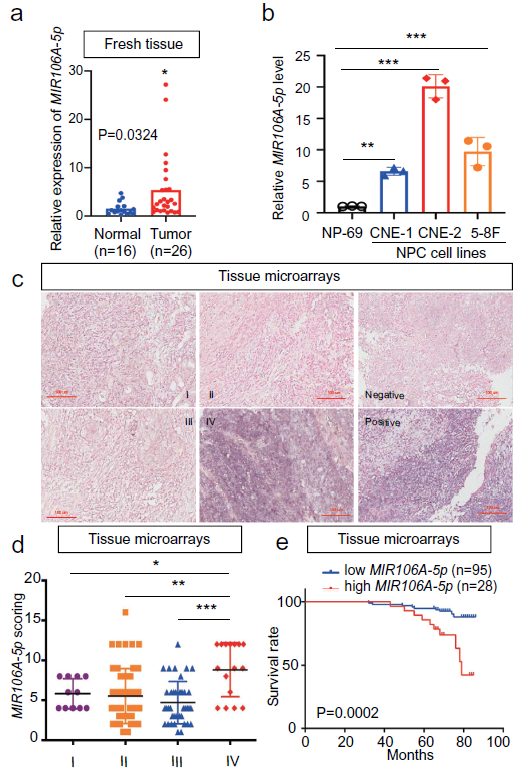
1. MIR106A-5p在鼻咽癌(NPC)中的表达及其临床意义
GEO数据库筛选出NPC miRNA的表达谱,发现MIR106A-5p在NPC组织中明显增加,并通过qRT-PCR在鼻咽癌组织和NPC细胞系中确认。鼻咽癌组织原位杂交微阵列显示在临床IV期NPC患者中MIR106A-5p过表达显著增多。生存率分析表明高MIR106A-5p表达患者的临床结局比MIR106A-5p表达低的患者更坏。总体而言,鼻咽癌的进展是与上调的MIR106A-5p相关。
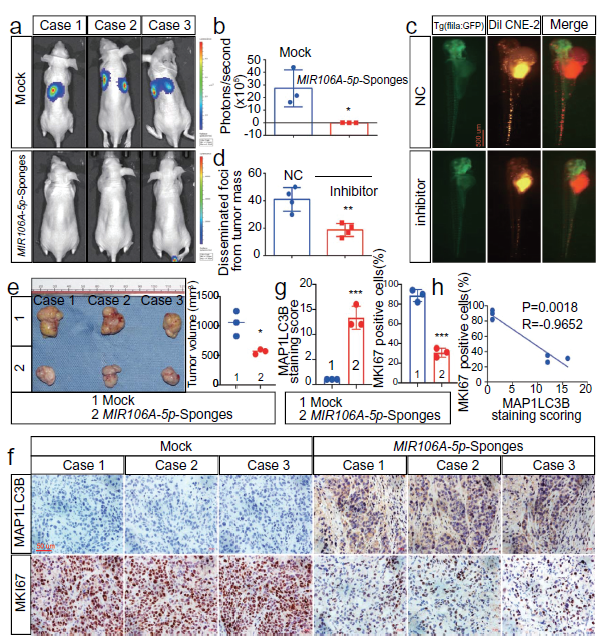
2. MIR106A-5p加速恶性NPC表型
MIR106A-5p表达降低的NPC细胞生长和迁移能力受阻。建立荷瘤模型,发现MIR106A-5p的敲低显著抑制了NPC细胞的转移能力,小鼠注射低MIR106A-5p表达的细胞后肿瘤生长降低。以上表明,MIR106A-5p可加速NPC转移和生长。免疫组织化学分析表明低MIR106A-5p表达的异种移植物中MAP1LC3B表达增加,MAP1LC3B表达水平与NPC异种移植物中的MKI67(增殖ki-67标记)表达负相关。
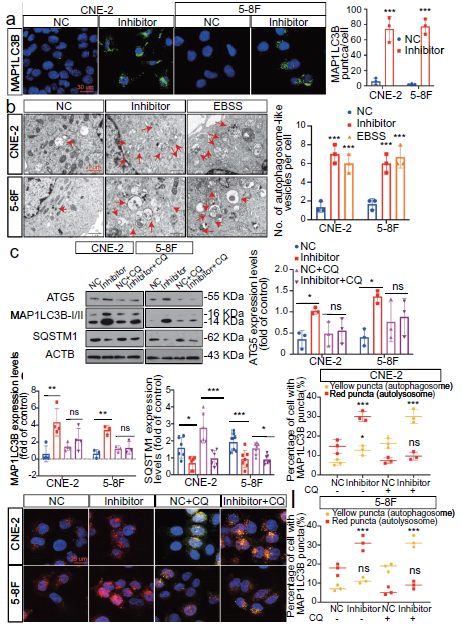
3. MIR106A-5p抑制NPC细胞自噬
MIR106A-5p表达沉默显著促进ATG基因表达并诱导自噬通量以产生自噬体和/或自溶酶体,表示MIR106A-5p有效抑制NPC细胞中的自噬。
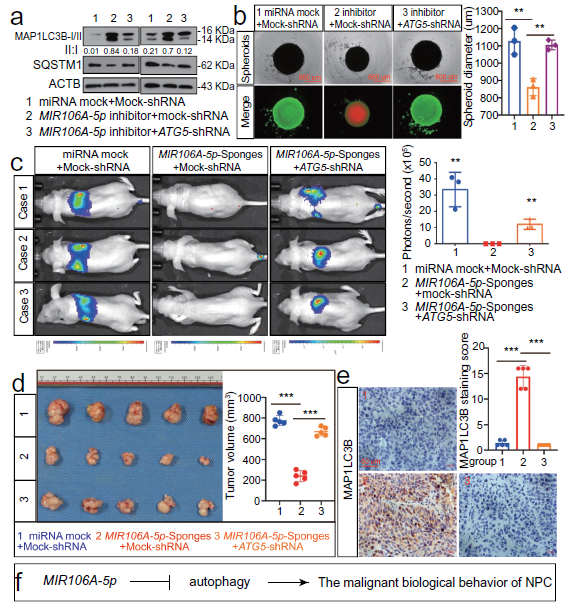
4. MIR106A-5p通过抑制自噬加速NPC恶性表型
评估MIR106A-5p抑制自噬在NPC生长和转移中的功能,发现敲低ATG5明显降低了被MIR106A-5p抑制所诱导的自噬。沉默MIR106A-5p表达减少了细胞活力,这种表型通过敲除ATG5得以部分挽救,MIR106A-5p海绵体内诱导的生长转移减少可被敲低ATG5所消除。这些表明MIR106A-5p抑制的自噬可加速恶性NPC表型。
5. BTG3是MIR106A-5p的直接靶标并与头颈癌预后不良相关
生物信息学工具来预测MIR106A-5p的自噬相关靶标,筛选出含有MIR106A-5p的潜在高亲和力结合位点的BTG3(BTG抗增殖因子3)。萤光素酶报告基因检测显示出MIR106A-5p和BTG3 3'-UTR之间有效的相互作用,NPC中BTG3 mRNA和蛋白表达下降。MIR106A-5p抑制后,BTG3蛋白水平急剧增加,而BTG3 mRNA水平保持不变。NPC组织微阵列中MIR106A-5p表达与BTG3蛋白水平负相关。这些结果表明MIR106A-5p可能通过翻译抑制调控BTG3表达。NPC组织微阵列的Kaplan-Meier分析揭示低BTG3水平与更差的临床预后有关。这些数据提示MIR106A-5p通过靶向BTG3直接调节自噬。
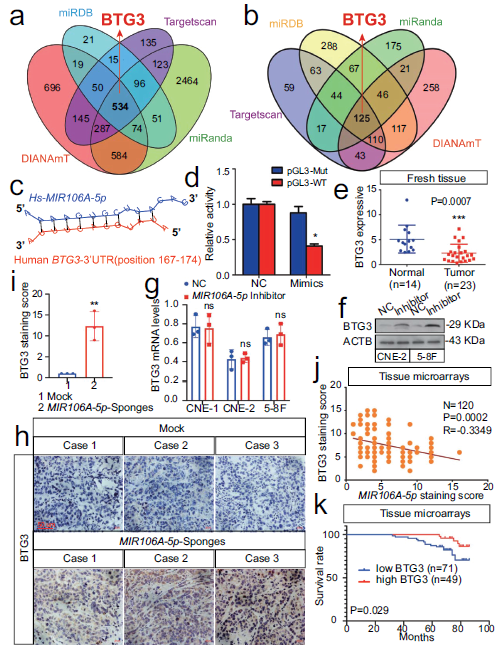
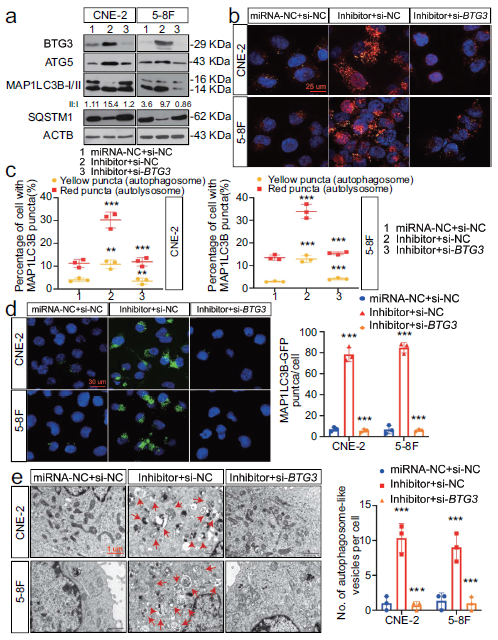
6. MIR106A-5p抑制自噬需要BTG3
过表达BTG3明显增加了自噬的诱导,BTG3参与MIR106A-5的自噬调控效应,BTG3的敲低消除了MIR106A-5p抑制导致的增强自噬能力,表明MIR106A-5p对自噬的抑制作用取决于降低BTG3水平的能力。
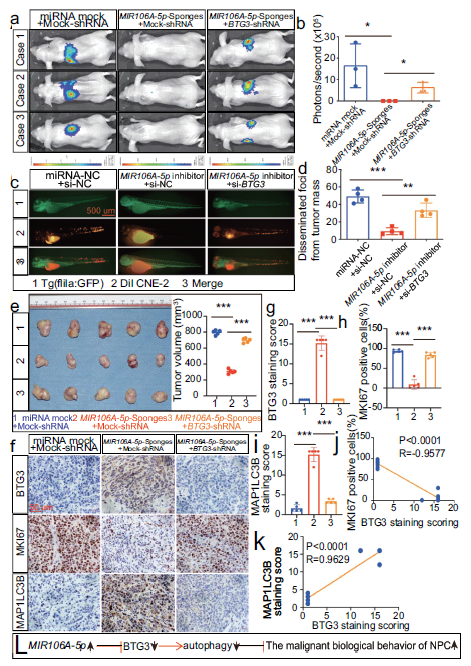
7. BTG3是MIR106A-5p加速恶性NPC表型的关键分子
进一步证实MIR106A-5p-BTG3轴导致恶性肿瘤加速,发现MIR106A-5p抑制减少了NPC细胞的转移和生长,但是这些影响在BTG3敲低之后大大降低,NPC异种移植组恶性表型加快自噬减少,表明自噬抑制和MIR106A-5p的促肿瘤作用需要BTG3。
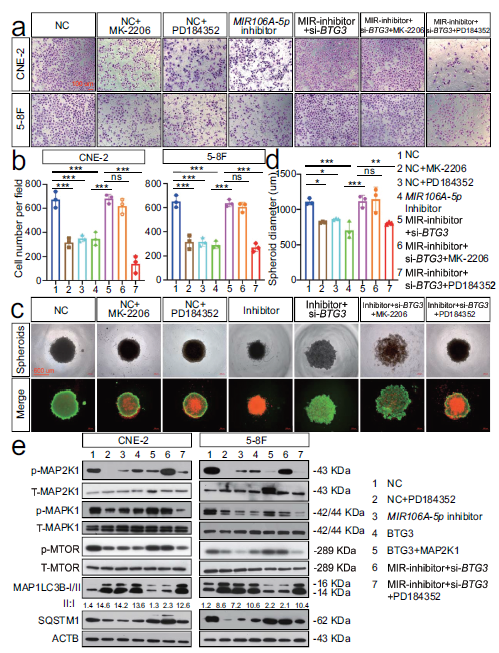
8. MIR106A-5p-BTG3轴通过MAPK途径抑制自噬
研究通过BTG3调节自噬的机制,关注自噬相关途径。MIR106A-5p靶基因的KEGG分析显示MAPK和AKTMTOR通路作为自噬负调节剂出现。发现仅抑制MAP2K1 / MEK活性抑制MIR106A-5p和BTG3沉默诱导的细胞增殖迁移。相反,通过抑制AKT活性无法更改MIR106A-5p-BTG3介导的肿瘤生长和迁移。探索MIR106A-5p-BTG3轴依赖的自噬抑制是否与MAPK信号激活相关。当抑制MIR106A-5p 或BTG3表达激活自噬时,p-MAP2K1和下游p-MAPK1 /ERK和p-MTOR水平降低。在MIR106A-5p和BTG3敲低细胞中抑制MAP2K1活性后,p-MAP2K1,p-MAPK1和p-MTOR水平和ATG表达可被拯救。以上表明,在NPC中激活MAPK信号传导部分负责MIR106A-5p-BTG3轴的抑制自噬。
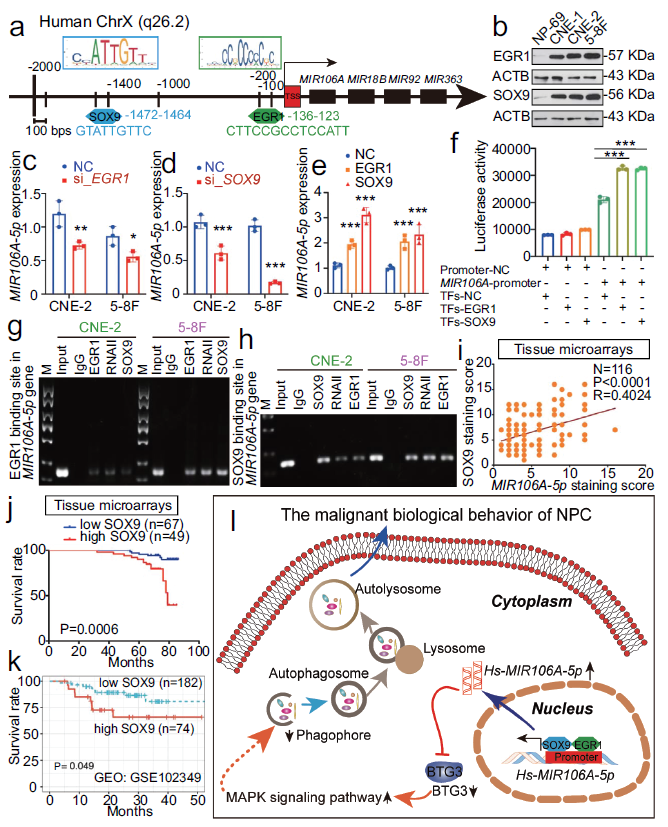
9. NPC中的MIR106A-5p上调是由EGR1和SOX9反激活增加
探索NPC细胞中MIR106A-5p如何上调。分析确定MIR106A-5p启动子序列确定了EGR1和SOX9的假设结合位点。且发现EGR1和SOX9均在NPC细胞系中上调。沉默EGR1和SOX9表达降低MIR106A-5p水平,而过表达EGR1和SOX9增加MIR106A-5p水平。此外,萤光素酶报告基因测定和染色质免疫沉淀分析显示EGR1和SOX9直接结合到MIR106A-5p启动子的预测结合位点并反激活MIR106A-5p。NPC组织中SOX9与MIR106A-5p表达呈正相关。鼻咽癌组织芯片的生存分析表明,高SOX9表达的患者预后较差。这些结果表明NPC中MIR106A-5p的过表达是由EGR1和SOX9反式激活。
参考文献:
Zhu Q , Zhang Q , Gu M , et al. MIR106A-5p upregulation suppresses autophagy and accelerates malignant phenotype in nasopharyngeal carcinoma[J]. Autophagy, 2020(7637):1-17.






