Blood|人类红白血病遗传学和转录组鉴定主转录因子为功能性疾病驱动因子
急性红白血病(AML-M6或AEL)是一种罕见但侵袭性的血液恶性肿瘤。既往研究表明,AEL白血病细胞经常携带复杂的核型和已知aml相关癌基因的突变。为了更好地定义驱动红细胞表型的潜在分子机制,我们研究了一系列33个AEL样本,它们代表三个遗传AEL亚群,包括TP53突变、表观调控突变(如DNMT3A、TET2或IDH2),以及低突变负荷的未定义病例。我们建立了一个基于红髓转录组的空间,独立于分子亚群之外,大部分AEL样本表现出独特的图谱,不同于非m6 AML和骨髓增生异常综合征样本。值得注意的是,超过25%的AEL患者,包括在基因不明确的亚组中,显示了关键转录调节因子的异常表达,包括SKI、ERG和ETO2。这些因子在小鼠红系祖细胞中的异位表达阻断了体外红系分化并导致永生化,进而导致GATA1结合位点染色质可及性降低和对GATA1活性的功能干扰。体内模型显示了致命红血球、混合红血球/髓系或其他恶性肿瘤的发展,取决于表达ael相关改变的细胞群。总的来说,我们的数据表明,AEL是一种具有红细胞特性的分子异质性疾病,其部分原因是造血干细胞或祖细胞中关键的红细胞转录因子的异常活动。

技术路线:

背景:
红系的急性髓系白血病(AML)(红细胞白血病,AML- m6或AEL)占AML患者的3-5%,与不良预后有内在联系。虽然AEL可以发生在任何年龄,但大多数患者都是65岁,该病通常继发于其他肿瘤,包括骨髓增生肿瘤(MPN)或骨髓增生异常综合征(MDS),或在细胞毒性癌症治疗后发生。两种主要的形态学亚型已被提出:纯红白血病(PEL, AML-M6b,又称Di Giuglielmo病),80%的细胞属于红系;以及AML- M6a,其特征是红细胞前体和髓细胞同时存在。2016年世卫组织分型将AML- m6a纳入骨髓增生异常综合征(MDS)或非特异性AML (AML- nos),但该分型仍存在争议。
功能研究表明,在HSPC预先发生改变的背景下,2-5个基因驱动病变可能足以诱发AML。对于AEL,早期的工作表明白血病细胞通常有复杂的核型,并且靶向DNA测序揭示了几个已知的aml相关突变的存在,但是AEL驱动的分子机制仍然不完全了解,并且红血病特异性突变很少得到功能上的验证。引人注目的是,单个或多个TP53突变已被证明是PEL的分子特征。
正常的红细胞分化是由两种外部信号因子控制的,包括通过EPOR信号通路介导其作用的促红细胞生成素(EPO)和内在的多聚体转录复合物。后者包括造血主监管机构如GATA-binding蛋白1 (GATA1), t细胞急性淋巴细胞白血病蛋白1 (TAL1), LIM领域仅2 (LMO2) CBFA2 / RUNX1伙伴转录体若3 (CBFA2T3,也称为ETO2)和LIM-domain-binding蛋白1 (LDB1),此后一般叫“GATA1-复合物”,可以激活或抑制靶基因的转录。这些GATA复合物通过与重要红细胞基因(如血红蛋白)的基因位点结合和转录,促进终末红细胞的分化。
结果:
一、AEL患者的分子改变
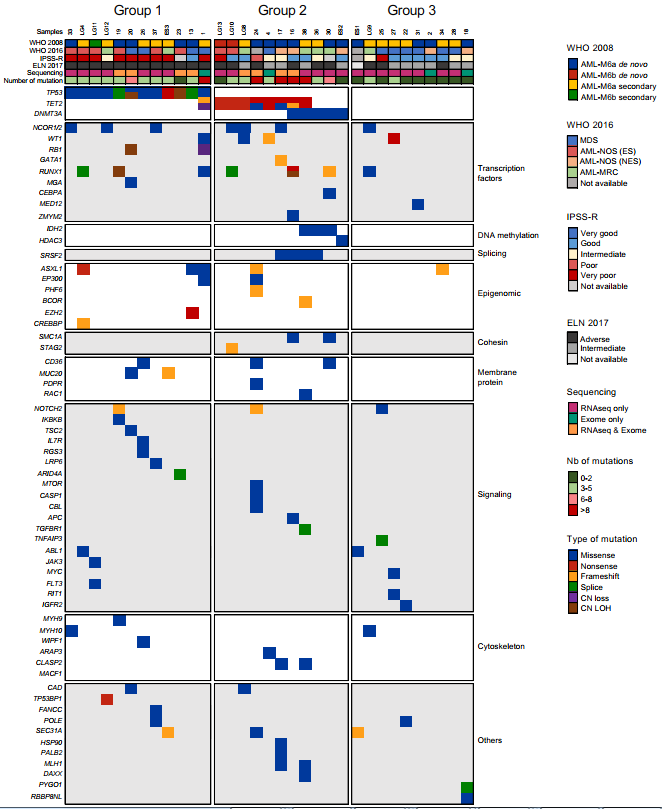
我们收集了58例AEL患者的样本,包括34例60岁的成人,14例40-59岁,8例青壮年(21-39岁)和2例儿科患者。根据2008年世卫组织分类、33例诊断为新创AEL,包括29 AML-M6a 349和4 AML-M6b, 20名患者被诊断出患有AML-M6a次要MDS / CML, 1 AML-M6b二级脉络丛癌和一个更精确的诊断缺乏4例(补充图1 a和补充表3)。
此后,所有患者都使用了AEL一词。一些AEL样本缺乏足够数量的活细胞,通过异种移植来扩大他们在NOD。Cg-PrkdcscidIl2rgtm1Wjl / SzJ (NSG)老鼠。
这种方法提供了额外的白血病材料分离RNA(7例)和DNA(4例)。从33名患者获得了测序材料,并对11对白血病和非肿瘤性(来自同一患者的CD3+或CD19+细胞)样本进行外显子组测序,并对29个白血病样本进行rna测序。
结合外显子组和RNA-seq数据,我们在62个基因中鉴定了序列变异,预测了359个功能后果。
出现TP53突变的亚群-1(占36.3%的患者)每个样本平均有4.41个突变,与较高的细胞遗传风险和较差的结果相关。
亚组3 (n= 10,30.4%)的样本中没有TP53或表观遗传变异。平均而言,这些AEL在每个样本中显示1.60个突变,显著低于亚组-1和2。
二、AEL基因表达特征与红细胞分化相关
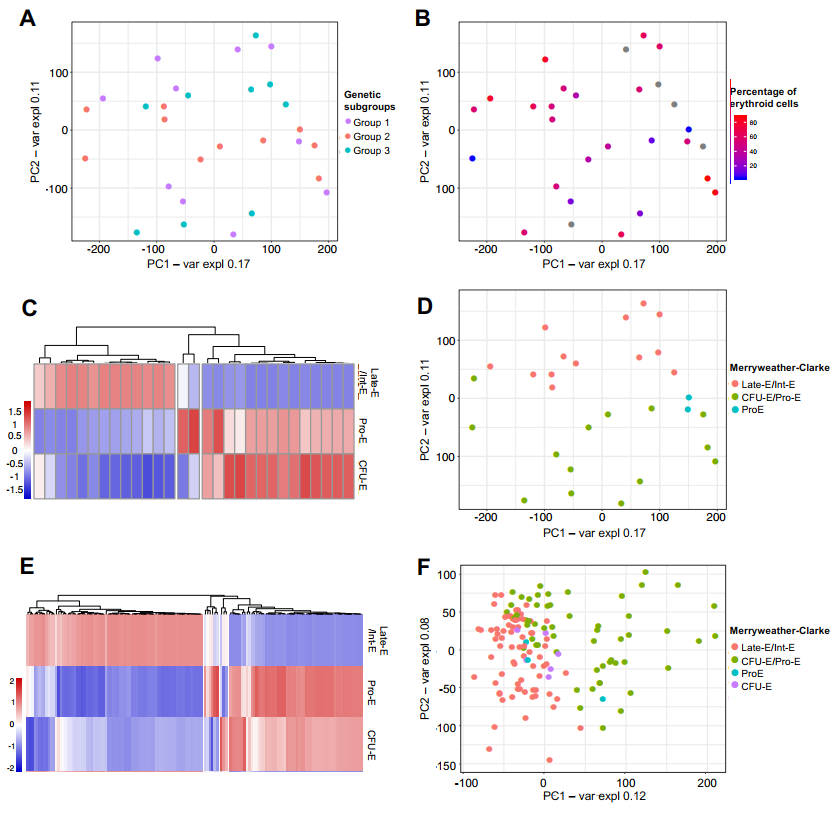
由于异质遗传改变不能为这些白血病的红系表型提供任何强有力的理论依据,我们通过比较基因表达标记(GES)来研究红系特征。主成分分析(PCA)没有显示GES和之前鉴定的三个分子亚群之间有任何显著的相关性(图2A)。同样,诊断时患者BM中的红细胞百分比在GES中反映不佳(图2B)
为了进一步探讨AEL转录组与人类红细胞不同成熟阶段的关系,在将人外周血单核细胞体外分化为集落形成单位红细胞(“CFU-E”,CD71+CD235-)、前红细胞(“Pro-E”,CD71+CD235low)、中红细胞(“Int-E”,CD71+CD235high)和晚期红细胞(“late -e”,CD71lowCD235high)后,我们比较了患者的GES和那些通过实验获得的GES并根据这些成熟阶段观察到聚类(图2C-D)。重要的是,来自一个独立的更大的AEL患者队列36的转录组相似地聚集在一起(图2E-F)。
总之,AEL基因表达程序受红细胞分化阶段的影响,而不是受特定基因病变的影响,表明人类AEL中红细胞的同一性与细胞起源和驱动细胞分化的转录调节活性有关。
三、基于转录组的空间映射AEL, MDS和其他AML到红系和髓系的谱系轨迹
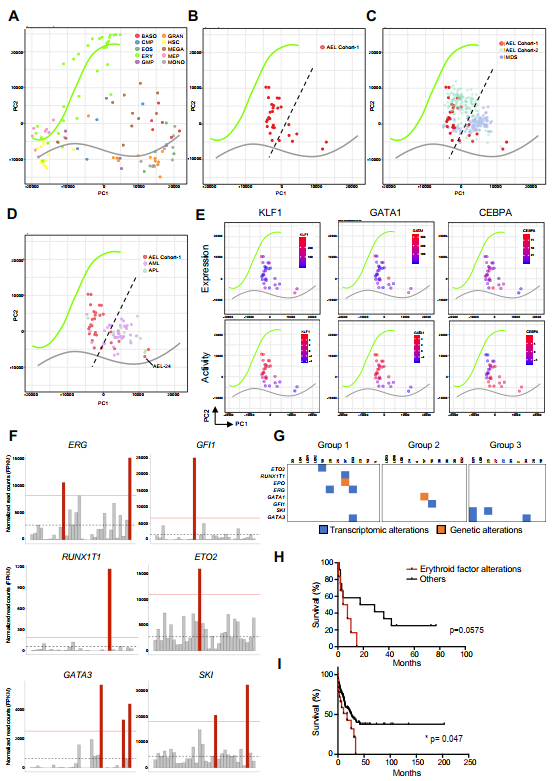
我们从DMAP数据库中检索细胞特征并计算红细胞和髓系分化表达轨迹(Figure 3A)。与预期的一样,相对差异的基因表达聚集在我们的AEL样本之间的红髓轨迹。大多数病例(n=25)靠近红系轴,而其余病例(n=7)靠近髓系轨迹,更接近MDS转录组(图3B-C)。同样,来自最近发表的一个大型AEL组36的样本,除了MDS样本(图3C)和非m6 AML样本41(图3D)外,也大多聚集在一起。
值得注意的是,AEL样本大多预测在造血干细胞和成熟红细胞之间,支持只有部分成熟相关红细胞程序在这些样本中表达。有趣的是,在我们AEL样本映射靠近髓轴和其他AML样本,样本# 24显示高表达SPI1(图2图3 d,补充b)也出现在其他AML亚型和实际上是由临床医生重新归类为AML-M5独立的过程中。有趣的是,我们观察到,红细胞转录因子(如KLF1、GATA1、NFE2、TAL1、NFIA)的表达逐渐下降,并预测其活性从红细胞向髓系轨迹转移,且与髓系因子(如CEPBA和SPI1)因子呈负相关(图3E和补充图3C)。我们观察到一些AEL患者确实表达了异常高水平的ERG (n=2)、GFI1 (n=1)、RUNX1T1(=1)和ETO2 (n=1)(图3F)。
四、AEL相关的gata1干扰因子过表达可转化小鼠红细胞祖细胞
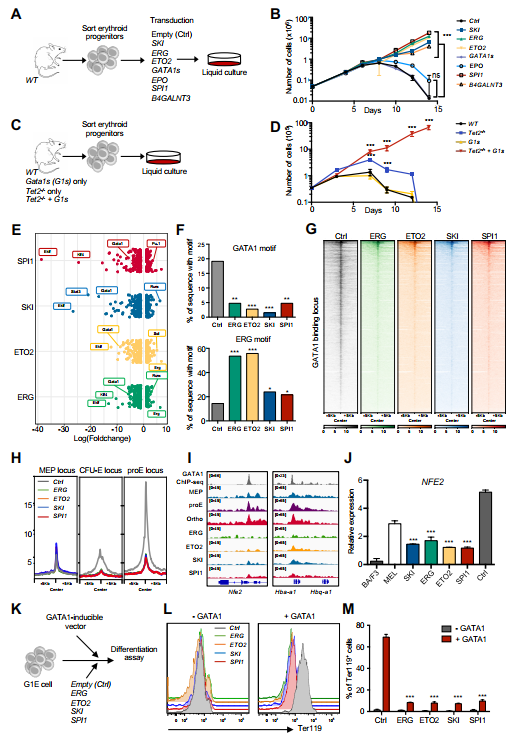
为了从功能上检测在AEL样本中发现的gata1干扰因子的异常表达是否有助于红细胞系的转变,我们探讨了SKI、ERG、ETO2、GATA1s、EPO、SPI1和B4GALNT3的异位表达对小鼠红细胞祖细胞的影响。
将经facs纯化的试剂盒+CD71+Ter119+细胞转染编码这些基因的逆转录病毒,在体外培养(图4A)。
只与vector-transduced控制扩散~ 7天,ERG的异位表达,SPI1, ETO2,滑雪,和B4GALNT3明显保持红细胞细胞扩散呈现一个不成熟CD71 +设备+ Ter119 -表型和pro-erythroblast形态在30天内(图4图5 b和补充)。
虽然在这种情况下,将在人类AEL样本中观察到的过表达水平与在小鼠模型中观察到的过表达水平进行精确比较在技术上具有挑战性,但在ERG、ETO2、SKI和B4GALNT3中观察到类似的过表达范围(补充图5B)。值得注意的是,仅EPO或GATA1s的异位表达不足以使成红细胞扩张超过10天(图4B)。
为了解决tet2失活和Gata1s突变之间的合作是否能在体外转化成红细胞,我们从野生型、Tet2-缺陷(Tet2-/-)、Gata1 e2敲入(Gata1s)和双Tet2-/-+Gata1s转基因小鼠中纯化红系祖细胞,比较其增殖情况(图4C)。只有Gata1s-或Tet2-/-的红细胞在10-15天内没有扩张,而Tet2-/-+Gata1s红细胞增殖超过2个月,呈现红样形态(图4D和补充图5C)。
此外,异常表达的AEL相关转录调节因子干扰了GATA1染色质的可及性和功能。
五、AEL相关变化之间的功能协作的体内模型
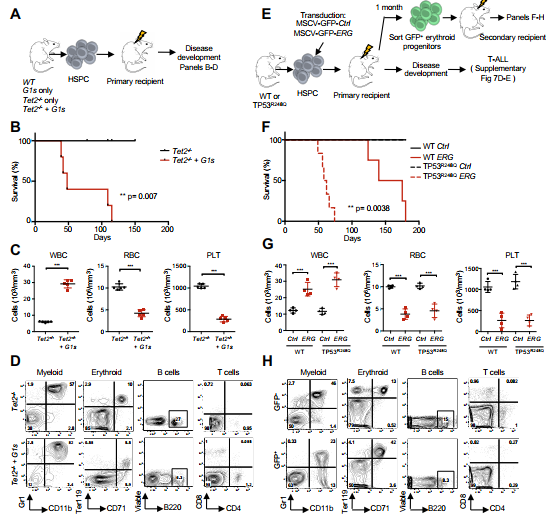
为了解决功能合作问题,我们将Tet2-/-+Gata1s Lin- HSPC移植到致死辐照受体中(图5A)。与只接受Tet2-/-细胞的受体不同,接受Tet2-/-+Gata1s细胞的受体出现了一种快速、完全渗透的致命疾病,并伴有高WBC、贫血、血小板减少和脾肿大(图5B-C和补充图7B)。流式细胞仪分析显示,白血病细胞主要为CD11b+Gr1+髓系细胞(图5D),组织病理学分析证实,骨髓和脾脏中有大量髓系细胞浸润(补充图7C)。
我们通过将从一次受体获得的纯化的ERG转染(GFP+)野生型或TP53R248Q红母细胞移植到二次受体,评估了特别是在红系祖细胞中ERG高表达的长期后果(图5E)。
AEL相关的TP53改变大多与其他表观基因组异常有关,包括转录因子ERG的异常表达。所有接受过表达ERG的TP53R248Q红细胞均发生致命白血病,中位生存期为60天,而接受表达ERG的野生型红细胞在4个月后发生疾病。(图3F)。
TP53R248Q+ erg诱导的疾病以贫血、血小板减少(图5G)、CD71+Ter119+红血球和少量CD11b+Gr1+髓系祖细胞在BM中积累为特征(图5H),并浸润脾脏和肝脏(补充图7F)。
六、SKI表达异常引起红细胞转化的体内建模
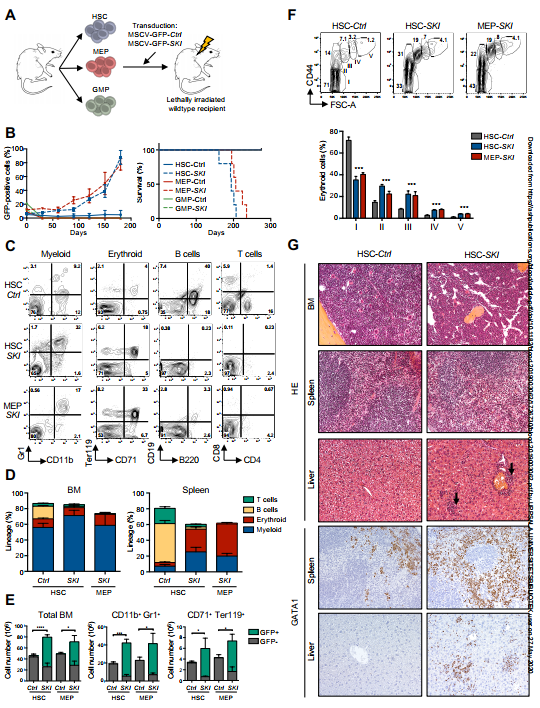
为了研究SKI的转化活性是否依赖于造血靶细胞,我们纯化、转导和移植了长期的多能造血干细胞、红细胞- nriched (MEP)或骨髓承诺粒细胞-巨噬细胞(GMP)祖细胞(图6A)。移植后3周,所有组的血液中都能检测到转导细胞,但仅在ski -转导的HSC和MEP受体的骨髓移植中观察到。随后出现以贫血、血小板减少为特征的症状性疾病(补充图8H),同时表现为CD11b+Gr1+髓系和CD71+Ter119+红系特征(图6B-E)。ski -介导的GMP受体没有发生疾病。有症状的HSC或MEP受体显示嗜碱性、嗜多色和原色红细胞增多,网织红细胞增多,成熟红细胞相对减少(图6F),表明SKI延迟但不完全阻止体内红细胞分化。组织病理学分析证实了BM细胞过度增生,并显示在脾脏和肝脏中有红细胞浸润(图6G和补充8I)。






