胆固醇与非酒精性脂肪肝相关肝癌
非酒精性脂肪性肝病(NAFLD)相关的肝细胞癌(HCC)是世界范围内日益增加的医疗负担。饮食中胆固醇对NASH进展的作用已有报道,且肠道菌群有助于NAFLD的发生及其向NAFLD-HCC的发展。然而,肠道微生物群失调是否是饮食胆固醇诱导的NASH和NAFLD-HCC进展的原因或影响尚不清楚。今天小编为大家带来发表于影响因子为19.819的“Gut”上的文章“Dietary cholesterol drives fatty liver- associated liver cancer by modulating gut microbiota and metabolites”,为大家介绍胆固醇在NAFLD-HCC发生发展中的作用和机制。

在本文中,我们以高脂/高胆固醇(HFHC)、高脂/低胆固醇或普通饲料喂养C57BL/6雄性幼仔14个月。将降胆固醇药物阿托伐他汀应用于HFHC喂养的小鼠。将不同饮食的小鼠粪便移植到无菌小鼠中,以确定胆固醇调节微生物群在NAFLD-HCC中的直接作用。此外,我们采用16S rRNA测序分析肠道菌群,液相色谱-质谱代谢组学(LC-MS)分析血清代谢物。
技术路线:

结果:
1.胆固醇促进NAFLD-HCC的发展
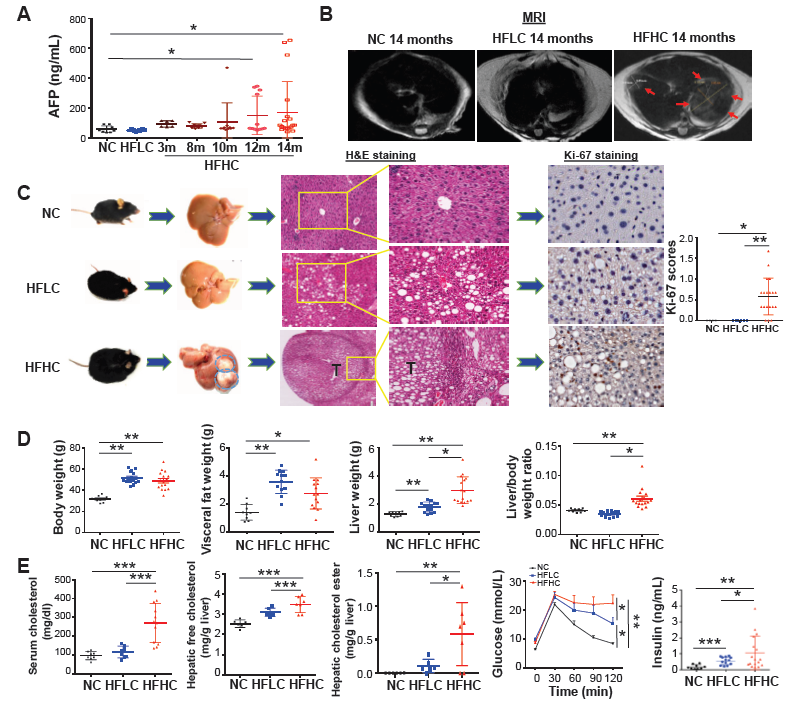
为了研究胆固醇在脂肪变性、NASH、纤维化和NAFLD-HCC中的作用,用HFHC、17-HFLC或NC喂养小鼠。在不同时间点(3、8、10、12和14个月)监测血清甲胎蛋白(AFP,肝癌标志物)水平。在第10个月观察到AFP水平升高,与第14个月HFLC或NC相比,喂食HFHC的小鼠在第12个月和第14个月进一步升高(图1A)。MRI扫描显示,在第14个月时,喂食HFHC的小鼠出现肝脏肿瘤(图1B)。然后在第14个月收获小鼠。在喂食HFHC的小鼠中,有68%出现肝肿瘤,但在喂食HFLC或NC饮食的小鼠中未发现肝肿瘤(图1C)。肝切片组织学检查证实所有肝肿瘤均为HCC(图1C),与喂食HFLC的小鼠相比,喂食HFHC小鼠的肝脏切片中有更多的Ki-67阳性细胞,这表明喂食HFHC小鼠的细胞增殖增加(图1C)。这些结果表明,饮食胆固醇可以自发地诱导NAFLD-HCC的形成。随着HCC的形成,在第14个月时,与NC喂养的小鼠相比,喂食HFHC的小鼠体重、内脏脂肪、肝脏重量和肝体重比显著增加(图1D)。HFLC喂养的小鼠体重、内脏脂肪和肝脏重量也有所增加(图1D)。与HFLC喂养或NC喂养小鼠相比,HFHC喂养小鼠的血清胆固醇、肝脏游离胆固醇和胆固醇酯、葡萄糖不耐受和空腹胰岛素显著增加(图1E)。与NC相比,HFLC喂养的小鼠的葡萄糖耐量和空腹胰岛素也有所增加(图1E)。
2.高胆固醇喂养14个月的小鼠出现NASH和纤维化
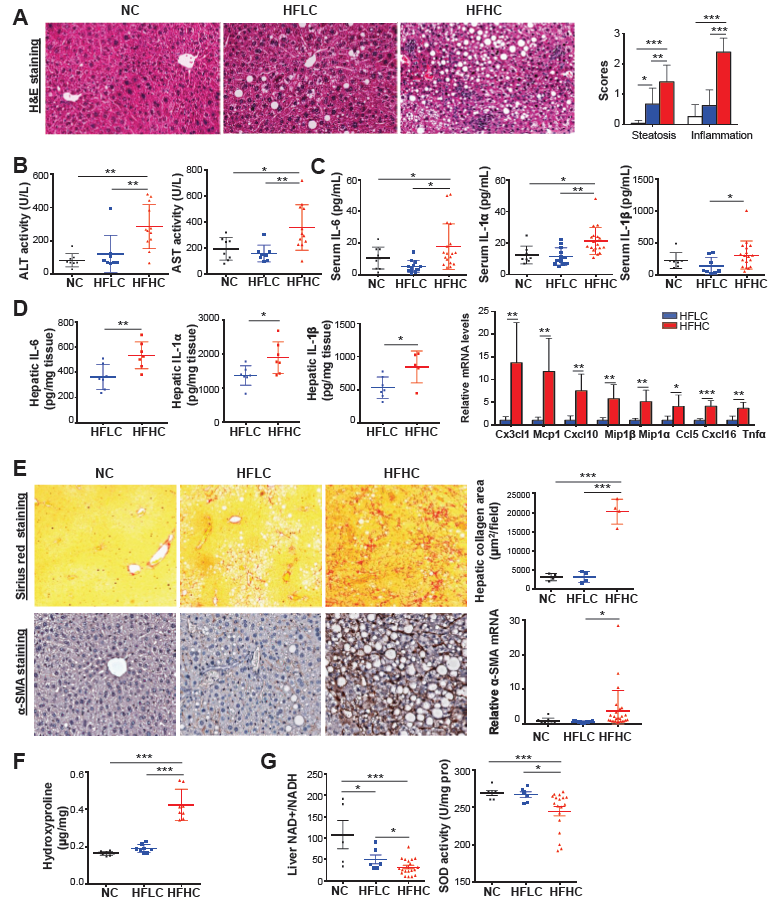
肝脏切片检查显示,在喂食了HFHC 14个月的小鼠的HCC相邻肝组织和非HCC肝组织中存在以脂肪变性和小叶炎症为特征的脂肪性肝炎,而在HFLC喂养的小鼠中只观察到脂肪变性(图2A)。与组织学炎症相一致的是,与HFLC或NC喂养的小鼠相比,HFHC喂养的小鼠血清丙氨酸转氨酶(ALT)和天门冬氨酸转氨酶(AST)水平显著升高(图2B)。通过细胞因子谱分析和酶联免疫吸附测定,在HFHC喂养的小鼠中,细胞因子包括IL-6、IL-1α和IL-1β(图2C,D)增加。RNA测序分析表明,与HFLC喂养小鼠相比,14个月HFHC喂养小鼠的肝组织中关键的NASH相关促炎细胞因子,包括Cx3cl1、Mcp1、Cxcl10、Mip1β、Mip1α、Ccl5、Cxcl16和Tnfα显著上调(图2D)。HFHC喂养的小鼠出现严重的纤维化损伤,胶原分布区明显增多α-平滑肌肌动蛋白(α-SMA)mRNA和蛋白水平增加(图2E),肝羟脯氨酸试验(图2F)显示胶原含量增加(图2E)。肝脏氧化应激检查显示,在HFHC喂养的小鼠中,氧化烟酰胺腺嘌呤二核苷酸(NAD+)与NADH(NAD的还原形式)的比率和抗氧化超氧化物歧化酶(SOD)活性显著降低(图2G),表明胆固醇诱导肝氧化应激。总的来说,这些发现表明在HFHC喂养的小鼠的非HCC肝组织中形成了NASH和纤维化。
3.高胆固醇导致小鼠脂肪肝、脂肪性肝炎和纤维化
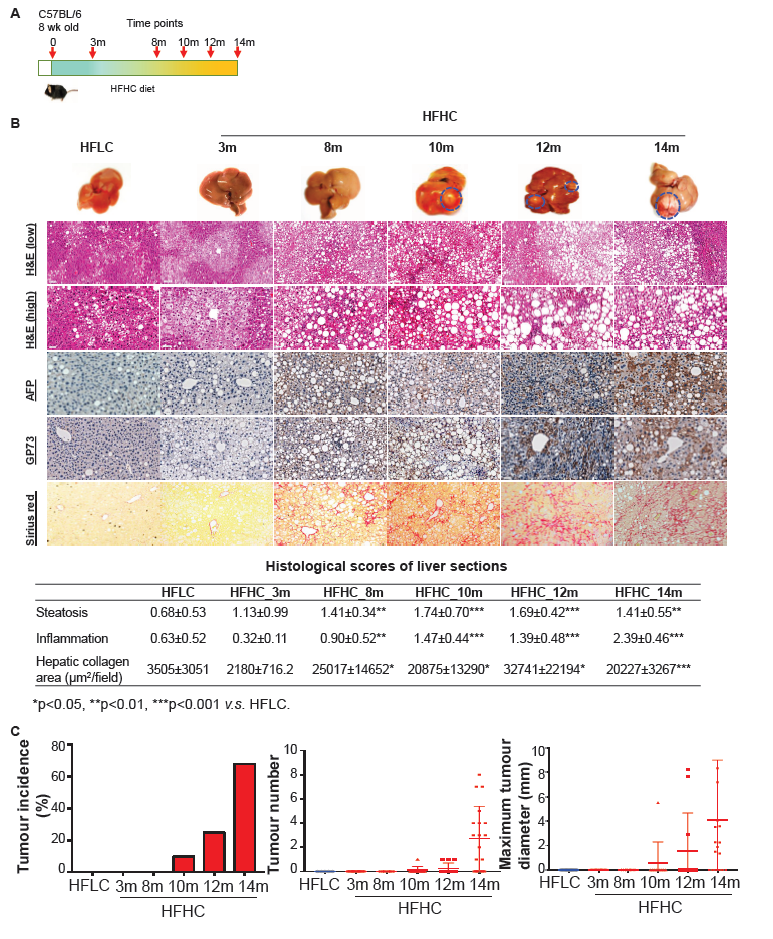
为了阐明肝细胞癌形成前NAFLD的进展,我们监测了喂饲HFHC的小鼠血清AFP和肝脏组织学变化。在喂养后3、8、10和12个月收获小鼠(图3A)。喂食HFHC小鼠的肝脏组织学在3个月时显示脂肪变性和轻度炎症,8个月时出现脂肪性肝炎和纤维化并在10、12和14个月时形成HCC(图3B)。我们还对两个HCC标志物AFP和GP73进行了免疫组化。在喂食HFHC的小鼠的肝组织上观察到阳性染色(图3B)。肝脏脂肪变性、小叶炎症和肝胶原区域的评分证实了整个疾病阶段肝脏组织学严重程度的增加(图3B)。此外,10%的HFHC喂养小鼠在10个月时发生HCC,25%在12个月时发展成HCC,68%在14个月时发展成HCC(图3C),表明HFHC喂养的小鼠逐渐发展成脂肪变性、脂肪性肝炎、纤维化和NAFLD-HCC。
4.胆固醇诱导的肠道菌群失调在NAFLD-HCC的发生和发展中的作用
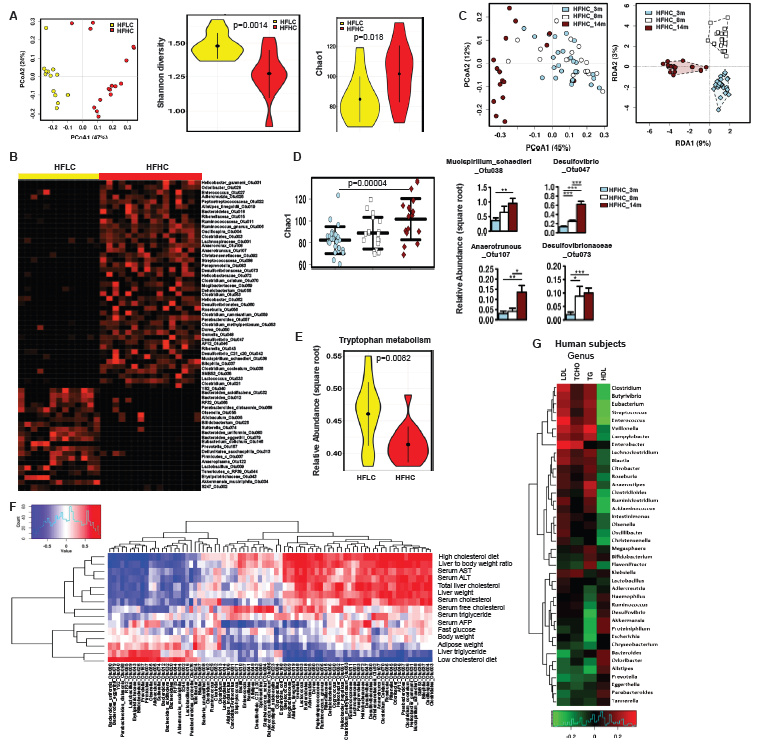
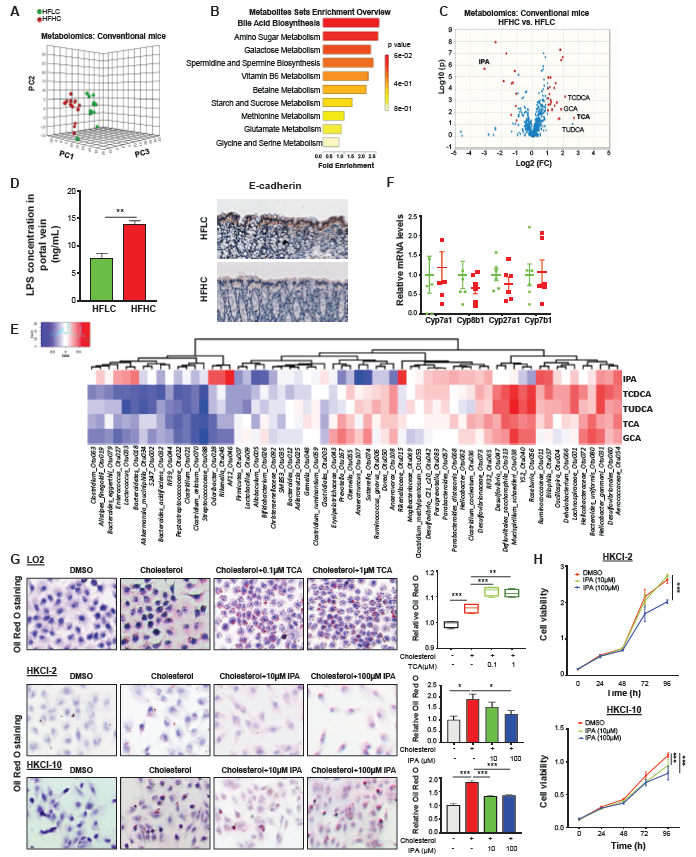
为了探讨肠道微生物群在调节胆固醇诱导的NAFLD-HCC中的潜在作用,我们对14个月龄的HFLC和HFHC喂养小鼠的粪便进行了16S rRNA基因测序。PCA分析表明14个月龄时HFLC喂养和HFHC喂养小鼠的肠道微生物群组成存在差异(p<0.001)(图4A)。此外,在14个月龄时,与单纯脂肪变性的HFLC喂养小鼠相比,HFHC喂养的HCC小鼠的细菌多样性更低,细菌丰富度增加(图4A)。与HFLC喂养的小鼠相比,喂食HFHC的小鼠中有几种细菌OTU的丰度不同(图4B)。主成分和冗余分析还表明,喂食HFHC 3个月,8个月和14个月的小鼠的微生物群组成明显聚集(图4C)。此外,细菌丰富度随着NAFLD–HCC的进展而依次增加(图4D)。特别是,观察到Mucispirillum schaedleri_Otu038、Desulfovibrio_Otu047, Anaerotruncus_Otu107 and Desulfovibrionaceae_Otu073从喂养HFHC的3个月到8个月和14个月依次增加(图4D)。此外,与HFLC喂养的小鼠相比,喂养HFHC的小鼠肠道微生物群相关的色氨酸代谢能力降低(图4E)。综上所述,高胆固醇饮食导致肠道微生物群失调和微生物色氨酸代谢受损。
接着进行相关分析以确定细菌丰度与小鼠表型的潜在关联。我们观察到,在HFHC喂养小鼠的粪便样本中富集的M. schaedleri_Otu038,Desulfovibrio_Otu047,Anaerotruncus_Otu107,C celatum_Otu070,C. cocelatum_Otu036 和 C. methylpentosum_Otu053呈正相关(图4F),而Bifidobacterium_Otu026,B. acidifaciens_Otu032,B. uniformis_Otu080,A. municiphila_Otu034 和Lactobacillus_Otu009在HFHC喂养的小鼠中被耗尽,与高胆固醇饮食、血清和肝脏胆固醇水平呈负相关(图4F)。这些结果表明,NAFLD-HCC患者肠道菌群失调与胆固醇水平相关。另外,双歧杆菌和类杆菌与血清总胆固醇和低密度脂蛋白胆固醇呈负相关,而与高密度脂蛋白胆固醇呈正相关(图4G),进一步表明肠道微生物群参与了胆固醇诱导的紊乱。
5.胆固醇通过诱导代谢物改变促进NASH-HCC的进展
为了揭示可能与胆固醇诱导的NAFLD-HCC相关的代谢表型,我们对HFHC喂养和HFLC喂养小鼠的血清进行了代谢分析。根据PCA测定,血清代谢物有显著差异(图5A)。胆汁酸生物合成是高胆固醇小鼠的关键途径(图5B)。初级胆汁酸包括牛磺胆酸(TCA)、牛磺去氧胆酸(TUDCA)、甘胆酸(GCA)和牛磺去氧胆酸(TCDCA)是HFHC喂养小鼠中异常上调的代谢物。另一方面,微生物色氨酸代谢产物 IPA 18在HFHC喂养的小鼠中是一个异常的下调代谢产物(图5C)。此外,与HFLC喂养的小鼠相比,HFHC喂养的小鼠门静脉的血清脂多糖(LPS)浓度升高,结肠E-钙粘蛋白表达减少(图5D),表明胆固醇可能损害肠屏障功能。接着进行相关分析以确定HFHC改变的微生物和代谢物之间的潜在联系。相关分析显示,Mucispirillum schaedleri_Otu038与TUDCA、TCDCA、TCA和GCA呈正相关。Roseburia_Otu056 and Helicobacter_ganmanii_Otu031也与TUDCA和TCDCA呈正相关。此外,HFHC-耗尽的Akkermancia_muciniphila_Otu034与TCDCA和TUDCA呈负相关,而HFHC-富集的Anaerotruncus_Otu107与IPA呈负相关(图5E)。
进一步的实验表明,高胆固醇饮食不会改变胆汁酸合成酶的mRNA表达,包括肝细胞色素P450(Cyp)7a1、Cyp8b1、Cyp27a1和Cyp7b1(图5F)。其他体外实验表明,TCA可加重胆固醇诱导的人永生化肝细胞系LO2(图5G)中的甘油三酯积累,而IPA抑制NASH-HCC细胞系、HKCI-2和HKCI-10中胆固醇诱导的脂质积聚(图5G)和细胞增殖(图5H)。这些结果表明,胆固醇通过调节宿主血清代谢物,至少部分通过增加TCA和降低IPA来促进NASH-HCC的进展。
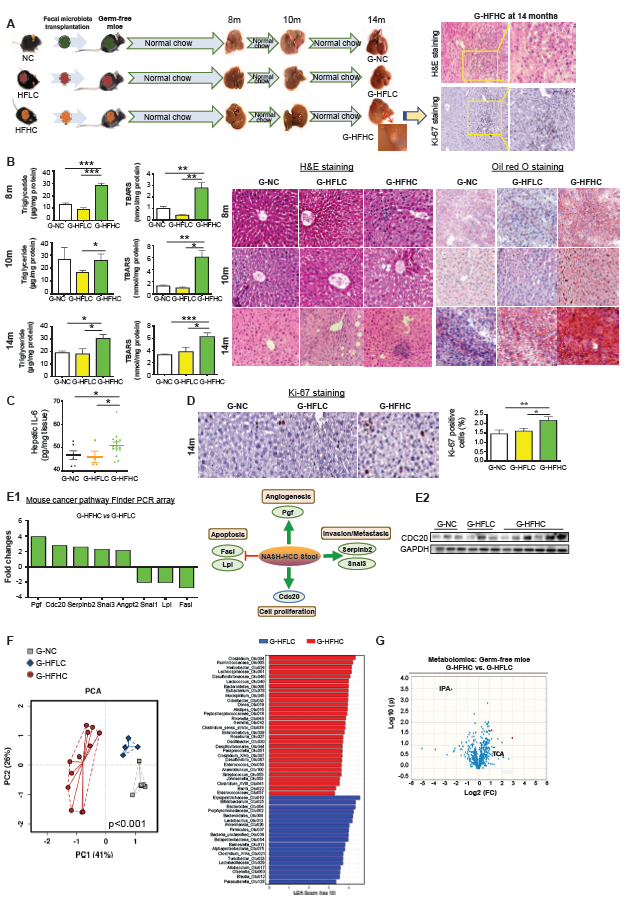
6.高胆固醇调节肠道微生物群促进无菌小鼠脂肪性肝炎和肝细胞增殖
我们通过粪便微生物群移植(FMT)评估胆固醇调节微生物群在NAFLD–HCC中的作用。将NC喂养、HFLC喂养和HFHC喂养小鼠(14个月)的粪便灌胃给NC饮食下的无菌小鼠(G-NC、G-HFLC和G-HFHC)(图6A)。在FMT后8个月、10个月和14个月,G-HFHC小鼠的肝脏脂质积聚和过氧化作用显著增加,并伴有肝组织学损害(图6B)。通过细胞因子谱分析,肝脏细胞因子和趋化因子包括IL-6增强,证明炎症增加(图6C)。
在14个月龄时,G-HFHC小鼠的肝脏中观察到肝细胞增殖增加(图6D)。癌症途径PCR阵列显示,与G-NC和G-HFLC小鼠相比,G-HFHC小鼠肝组织中参与致癌途径的基因上调,包括细胞增殖(Cdc20)、血管生成(Pgf)、侵袭/转移(Serpinb2、Snai3)和凋亡相关基因(Fasl和Lpl)下调(图6E1)。免疫印迹证实CDC20上调(图6E2)。在14个月龄的G-HFHC小鼠中观察到一个肝结节,(图6A)。组织学检查证实该结节发育不全,有小球状增生,细胞增殖增强(图6A)。此外,我们发现,受体无菌小鼠的肠道菌群与供体的饮食有显著差异(图6F)。对无菌小鼠血清代谢物的分析表明,与G-HFLC小鼠相比,G-HFHC小鼠的IPA降低,与喂食HFHC的传统小鼠一致(图6G)。总之,这些数据表明,胆固醇调节的微生物群通过诱导代谢物改变促进NAFLD和肝细胞增殖,从而促进胆固醇诱导的NAFLD-HCC的形成。
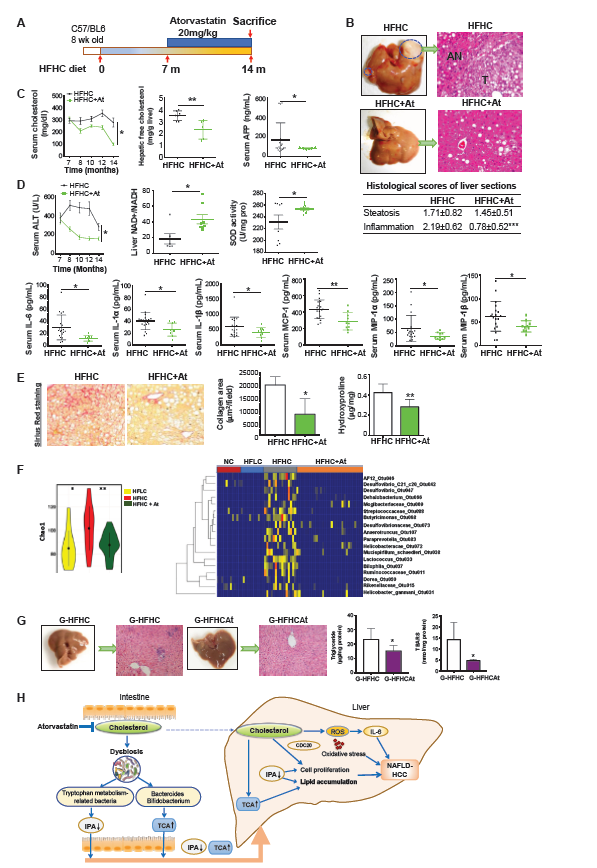
7.抗胆固醇治疗可完全预防HFHC喂养小鼠NAFLD–HCC的形成
由于胆固醇推动NAFLD–HCC的进展,我们评估了抗胆固醇药物是否可以抑制NAFLD及其进展为HCC。阿托伐他汀(20mg/kg)是一种降低胆固醇的药物,给予喂食了7个月的HFHC的小鼠,之后并继续服用HFHC和阿托伐他汀7个月(图7A)。在实验结束时(14个月),阿托伐他汀完全阻止了HFHC饮食诱导的NAFLD-HCC形成,并改善了NASH的严重程度(图7B)。这与血清胆固醇、肝脏游离胆固醇、血清甲胎蛋白(图7C)、丙氨酸氨基转移酶(ALT)、血清促炎细胞因子和氧化应激的降低相伴随(图7D)。阿托伐他汀还通过显著减少肝胶原沉积和羟脯氨酸含量来改善肝纤维化(图7E)。用16S rRNA基因测序法对阿托伐他汀(HFHC+At)处理的HFHC小鼠粪便进行微生物群落分析,并与NC、HFLC和HFHC喂养的小鼠进行比较。抗胆固醇阿托伐他汀治疗显著恢复了HFHC喂养小鼠的细菌丰富度(图7F)。此外,在HFHC喂养小鼠失调的OTUs中(图4B和D),抗胆固醇治疗可逆转Mucispirillum schaedleri_Otu038,Desulfovibrio_Otu047,Anaerotruncus_Otu107 和Desulfovibrionaceae_Otu073的丰度(图7F)。为了研究微生物群在抗胆固醇药物预防NAFLD肝细胞癌中的直接作用,我们将HFHC+At小鼠的粪便灌胃给无菌小鼠。在灌胃14个月后,与G-HFHC组相比,G-HFHCAt小鼠的肝脏组织学得到改善,肝脏甘油三酯和脂质过氧化减少(图7G)。这些结果进一步表明肠道微生物群在胆固醇诱导的NAFLD-HCC中起着积极的调节作用。
结论:
总之,这项研究首次表明,长期高胆固醇饮食通过调节肠道微生物群,诱导雄性小鼠自发性和渐进性NAFLD-HCC的发展。胆固醇通过肠道微生物群的改变诱导TCA增加和IPA降低,从而促进肝脏中的脂质积累和细胞增殖,导致NAFLD–HCC的发展。抗胆固醇治疗完全消除了胆固醇引起的NAFLD-HCC的形成。这项研究强调胆固醇抑制和肠道微生物群及其相关代谢物的控制可能是预防NAFLD-HCC的有效策略。






