干细胞外泌体的研究套路
干细胞一类具有无限的或者永生的自我更新能力的细胞,干细胞疗法代表了多种疾病的前沿治疗方法。外泌体是细胞分泌的一种直径30-150 nm的囊泡,干细胞衍生的外泌体可以调控各种病理进程,具有潜在的应用价值和研究价值。干细胞外泌体的研究套路值得关注。

(IF:8.579)
技术路线:

结果:
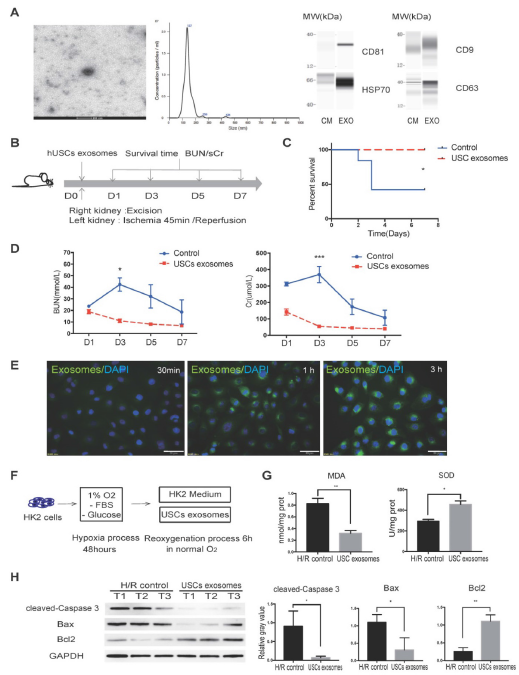
1. 分离人类尿液来源干细胞(hUSCs)
从人尿样中分离的细胞快速增殖,表达MSCs共同表面标志(CD29、CD73、CD44、CD90、CD146),不表达内皮或造血细胞表面标志,免疫原性较低,表达特异性肾脏标志物和多能性标记物。

2. 肾缺血/再灌注损伤(IRI)中,USCs可减轻肾小管损伤和细胞凋亡,抑制局部炎症
建立肾IRI模型,USCs治疗可显著提高大鼠存活率,降低肾损伤病理评分,表明静脉输注USCs可改善大鼠IRI模型肾损伤,保护肾功能。hUSC处理降低IRI肾脏的细胞凋亡,USC处理大鼠肾脏中促凋亡分子表达降低,而抗凋亡Bcl2表达增加;肾脏中浸润的中性粒细胞显著减少,MDA含量显著降低,SOD活性显著升高。这些结果表明USC治疗减少了IRI肾脏的细胞凋亡、中性粒细胞浸润和氧化应激。

3. USC外泌体(USC-Exo)具有体内保护作用,在体外抑制缺氧损伤后HK-2细胞的氧化应激
研究USCs是否通过分泌外泌体保护人肾皮质/近端小管细胞HK2免受缺氧诱导的损伤。分离USC分泌的细胞外囊泡EVs,发现USC-EVs呈球形形态,直径100-150 nm,表达外泌体标记物,。这些结果证明从USCs分离的EVs是外泌体。肾脏IRI模型中注射USC-Exo,治疗组大鼠在观察期间未死亡,BUN和sCr水平明显低于对照。这些结果证明,在大鼠IRI模型中,USC-Exo治疗也可以改善肾损伤,与USCs效果相似。
检测USC-Exo在体外的保护作用。细胞暴露于缺氧后,在复氧过程中向HK2培养基中加入USC-Exo溶液,USC-Exo治疗组MDA含量降低,SOD活性显著升高,促凋亡分子降低,抗凋亡增加。这些结果证明USC-Exo对HK2细胞H/R损伤的保护作用。
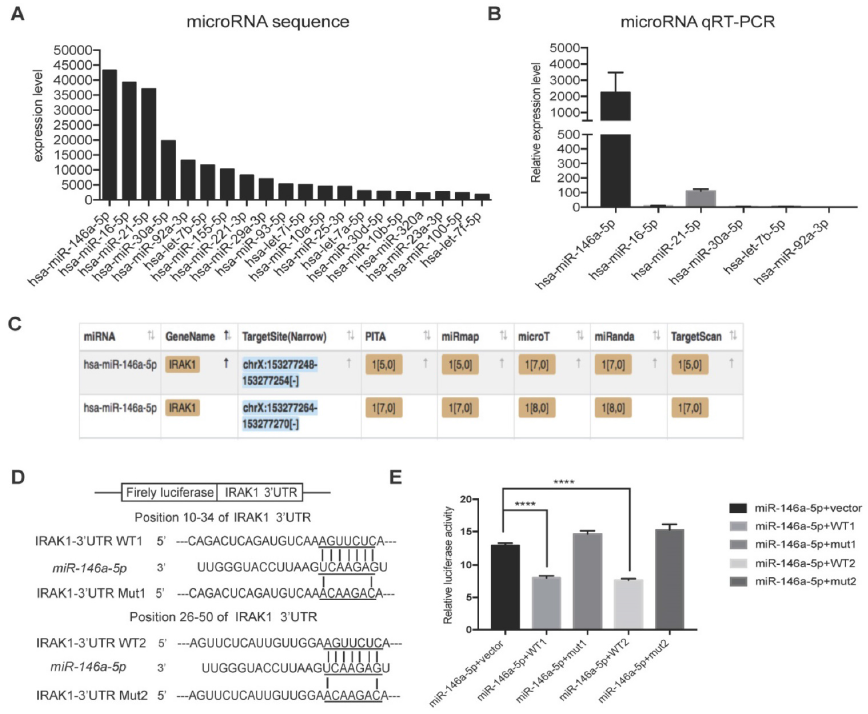
4. USC-Exo中的miR-146a-5p抑制IRAK1表达
进一步研究USC-Exo的保护作用机制,RNA测序结合qRT-PCR确定miR-146a-5p是USC-Exo中表达量最高的miRNA。预测miRNA靶标,白细胞介素-1受体相关激酶1(IRAK1)在miR-146a-5p的预测靶标中排名最高。荧光素酶报告基因实验证实来自USC-Exo的miR-146a5p可结合IRAK1 mRNA 3’UTR区域,通过翻译后抑制抑制IRAK1表达。
5. USCs在体内外增强miR-146a-5p表达
USC处理的IRI大鼠肾脏中miR-146a-5p表达上调,血清中外泌体miR-146a-5p的表达上调,IRAK1的mRNA和蛋白表达下调。USC-Exo处理显著上调HK2细胞中miR-146a-5p表达,减少IRAK1蛋白表达以及NF-κB p65亚基的核转位。提示:USCs对肾损伤的保护作用可能是通过外泌体miR-146a-5p介导的NF-κB信号下调导致的。
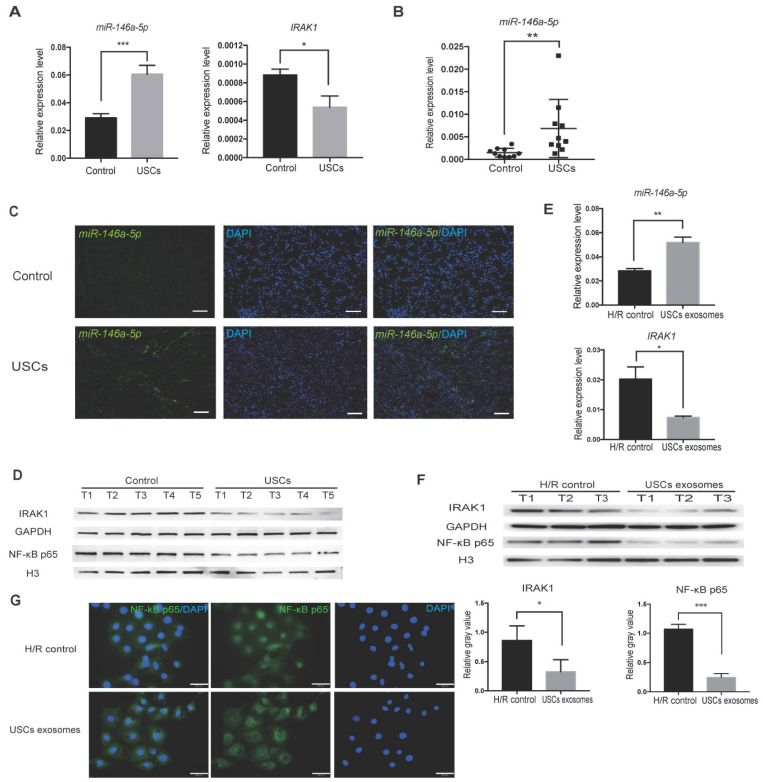
6. miR-146a-5p抑制HK2细胞中IRAK1表达和NF-κB p65的核转位
探究miR-146a-5p和IRAK1之间的调控关系。缺氧诱导过表达miR-146a-5p细胞,发现IRAK1 mRNA表达显著下降,氧化应激减轻,NF-κB p65亚基核转位显著下降。miRNA抑制剂处理HK2细胞,发现IRAK1的表达水平高,加重氧化应激,NF-κB p65亚基核转位增加。这些结果表明miR-146a-5p在缺氧诱导损伤中调节IRAK1表达和NF-κB p65亚基核转位。

总结:
1. USCs通过抗氧化、抗炎和抗细胞凋亡作用在致死性大鼠IRI模型中保护肾损伤。
2. USC-Exo中miR-146a-5p通过下调IRAK1/NF-κB信号介导细胞保护作用。






