miR-142-5p诱导IDO促进免疫抑制
对免疫疗法的临床反应与免疫抑制肿瘤微环境(TME)密切相关,并受肿瘤细胞与淋巴管内皮细胞(LEC)之间动态相互作用的影响。本文发现晚期宫颈鳞状细胞癌(CSCC)分泌的外泌体(LV)传递miR-142-5p通过诱导吲哚胺2,3-加双氧酶(IDO)作用于CSCC的免疫TME,促进疾病进展。本文于2020年9月发表于《Cell Death & Differentiation》IF:10.717。
本文技术路线如下:

本文主要结果:
1、在CSCC进展过程中,miR-142-5p表达与淋巴细胞IDO表达相关,并与浸润的CD8+ T细胞数量负相关。
为了评估CSCC进展过程中miR-142-5p表达,作者使用ISH分析了116个病人的组织微阵列,与早期组织相比,miR-142-5p的表达和癌周的IDO阳性LV的比例都在晚期组织中显著上调,但是CD8+ T细胞数量在CRCC进展中减少了。因此,miR-142-5p的表达与癌周的IDO阳性LV的和总的LV数量呈现正相关性,和浸润的CD8+ T细胞数量负相关。此外,淋巴管的miR-142-5p与IDO表达在肿瘤中的共定位与肿瘤中miR-142-5p高表达有关,表明肿瘤来源的miR-142-5p转运至癌周LV中可能上调了淋巴管IDO的表达。

图1在CSCC进展过程中,miR-142-5p表达与淋巴细胞IDO表达相关,并与浸润的CD8+ T细胞数量负相关。
2、miR-142-5p可能通过CSCC分泌的外泌体转运至人真皮淋巴内皮细胞(HDLECs)
作者接下来探究了miR-142-5p是否通过外泌体途径参与了CSCC细胞与HDLEC细胞间的串扰。如图2A-C所示,是提取的CSCC分泌的外泌体,具有典型的外泌体特征,随后与HDLEC共孵育,结果显示,绿色荧标记的外泌体均可被其吸收内化,但是与对照组外泌体相比,miR-142-5p外泌体组孵育后的HDLEC细胞中miR-142-5p的表达显著更高。
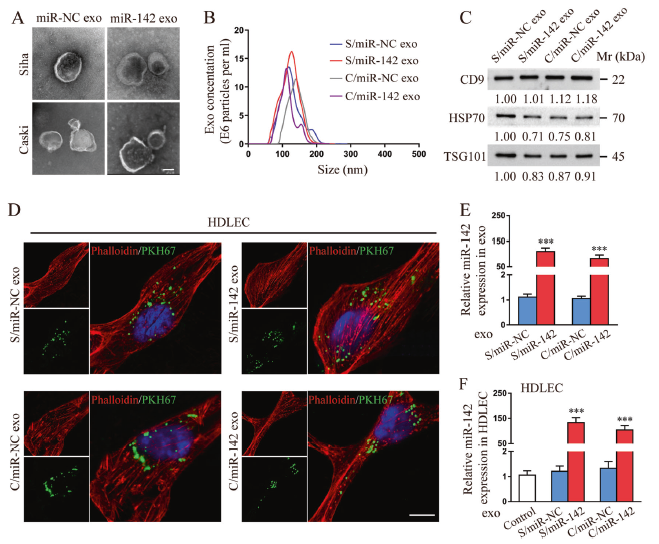
图2 miR-142-5p可以通过CSCC分泌的外泌体转移到HDLECs
3、CSCC分泌的外泌体miR-142-5p上调淋巴管IDO的表达
进一步分析外泌体miR-142-5p介导的淋巴管IDO表达的生物学功能,分析了HDLEC细胞与CSCC外泌体孵育48小时后的IDO的表达。结果显示,与对照组相比,经miR-142-5p mimics处理的或者外泌体miR-142-5p处理的HDLEC细胞中IDO的表达显著升高(Fig. 3a)。由于IDO酶降解色氨酸并生成色氨酸分解代谢产物犬尿素,作者使用高效液相色谱法测定培养基中色氨酸和犬尿素的浓度。犬尿素比色氨酸(K:T)的比例升高,表明IDO活性升高,这在miR-142-5p mimics处理的或者外泌体miR-142-5p处理的HDLEC细胞上清中都能观察到(Fig. 3b)。这与IDO蛋白质水平的趋势一致。
为了评估外泌体miR-142-5p在体内淋巴表型重塑中的作用,将Siha细胞与Siha/miR-142-5p或miR-142-5p mimics的外泌体处理的条件HDLECs混合,皮下注射到小鼠右侧。15天后,Siha细胞组显示更高水平的淋巴管IDO和miR-142-5p表达以及血浆K:T的比例(Fig. 3c–f)。总之,CSCC分泌外泌体miR-142-5p上调淋巴管IDO表达。

图3 CSCC分泌的外泌体miR-142-5p上调淋巴细胞IDO表达
4、CSCC分泌的外泌体miR-142-5p在HDLECs细胞中直接靶向ARID2
随后,使用三个数据库共同预测到6个miR-142-5p的靶基因,经qPCR验证后只有ARID2的表达发生显著改变。荧光素酶实验证实miR-142-5p与ARID2的在3’UTR存在直接相互作用,并且这种相互作用在用包含miR-142-5p的外泌体中也可检测到,而在对照组外泌体检测不到(图4a-f)。进一步发现,干扰ARID2后IDO的表达显著升高,而同时转染miR-142-5p mimics则导致IDO的表达显著下调;类似的,干扰ARID2后与外泌体对照组共孵育,IDO的表达显著升高,而与包含miR-142-5p的外泌体孵育则显著抑制IDO的表达(图4g)。不仅如此,HDLEC细胞上清中K:T的比例也具有相同的变化趋势(图4h)。由于IFN-γ可诱导IDO表达,所以作者评估了IFN-γ的表达是否受到miR-142-5p/ARID2诱导。结果显示,miR-142-5p过表达或ARID2干扰都导致淋巴管中IFN-γ的表达显著上调,反之则下调。

图4 CSCC分泌的外泌体miR-142-5p在HDLECs细胞中直接靶向ARID2
5、ARID2通过招募DNMT1增强IFN-γ启动子的甲基化
鉴于ARID2介导IFN-γ的表达,作者进一步探究两者间是否存在直接连接。如图5a,荧光素酶结果显示在ARID2沉默或过表达细胞中IFN-γ的启动子驱动的荧光素酶活性增加或减少。ChIP-PCR实验显示在ARID2中只有一个结合位点(−201 to −360 bp)与IFN-γ的启动子具有强烈的结合作用 (Fig. 5b)。因此,ARID2直接抑制IFN-γ的转录。
作为PBAF的一个亚基,ARID2具有表观调控和调节基因转录的潜力。有研究表明DNMT1作为表观调节者被ARID2招募以增强Snail启动子的甲基化。这个结果促进了学者对ARID2- DNMT1复合物在IFN-γ转录调节中的理解。本文ChIP-RE-CHIP结果发现ARID2和DNMT1共同占用了IFN-γ的同一个启动子区域(Fig. 5c)。并且,在ARID2过表达的HDLEC细胞中DNMT1与IFN-γ启动子的结合增加了,ARID2干扰则相反,表明ARID2募集DNMT1只IFN-γ启动子(Fig. 5d)。此外,本文还发现CpG(−153 to −277 bp)与ARID2- DNMT1复合物在IFN-γ结合位点重叠(−201 to −360 bp) (Fig. 5e)。实验显示,在ARID2过表达或干扰的HDLECs细胞中IFN-γ启动子的甲基化会随之上调或下调(Fig. 5f)。总之,这些结果表明ARID2抑制IFN-γ转录通过招募DNMT1至IFN-γ启动子,进而上调启动子的甲基化。

图5 ARID2通过招募DNMT1增强IFN-γ启动子的甲基化
6、miR-142-5p激活的HDLECs诱导IDO耗竭CD8+ T细胞
研究报道IDO促进免疫抑制通过减低CD8+ T细胞的响应。为了检测HDLEC细胞暴露miR-142-5p是否促进CD8+ T细胞的免疫抑制作用,使用miR-142-5p和miR-142-5p mimics外泌体预处理的HDLEC细胞与CD8+ T细胞共孵育。结果发现被含有miR-142-5p外泌体预处理的HDLEC细胞会显著降低CD69+(激活)的组分和 IFN-γ+ CD8+(影响子)T细胞组分(Fig. 6a, b),同时升高了PD-1+(抑制)和V+(凋亡)标记的CD8+T细胞组分(Fig. 6c, d)。此外,使用IDO阻断剂或miR-142-5p抑制剂处理则显著反转了上述对CD8+ T细胞的抑制作用(Fig. 6a, d)。因此,IDO导致的免疫抑制是由miR-142-5p暴露介导的。
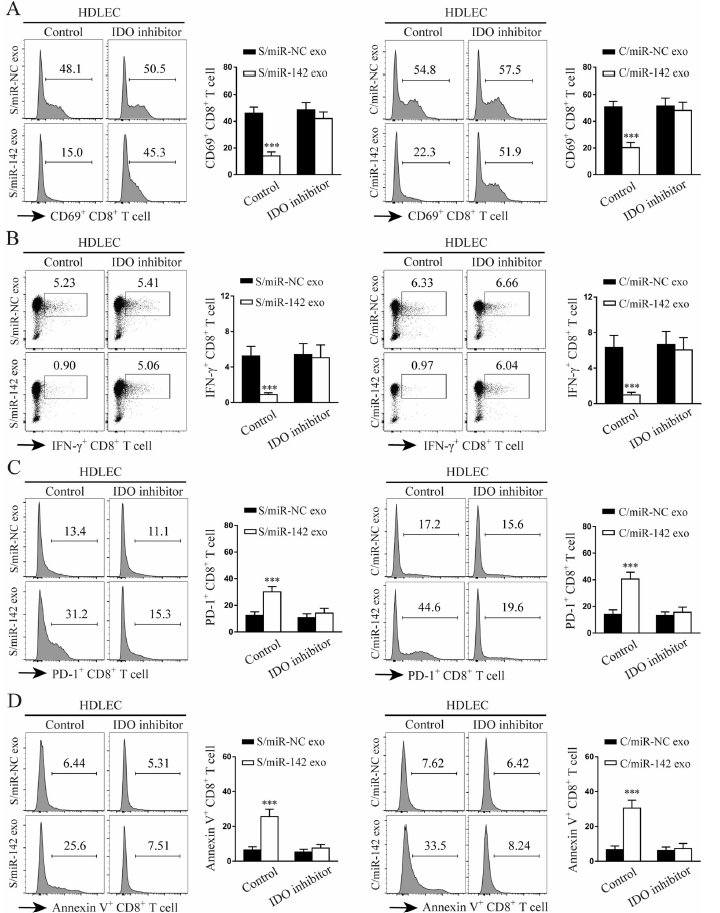
图6 miR-142-5p激活的HDLECs诱导IDO耗竭CD8+ T细胞
7、血浆外泌体miR-142-5p水平与系统IDO活性和临床CSCC病理进展相关
为了检测肿瘤分泌的miR-142-5p能否再CSCC患者血浆中被检测到,作者分离了27例早期和17例晚期CSCC患者以及8例健康人的外泌体,这些外泌体都具有典型的外泌体表型。进一步qPCR结果显示,与健康组外泌体相比,CCC患者血浆分离的外泌体中miR-142-5p的表达显著升高,其晚期的要显著高于早期的(Fig. 7b),类似的趋势也在K:T的比例中观查到(Fig. 7c)。此外,血浆外泌体中miR-142-5p的表达与血浆中K:T的比例呈正相关(Fig. 7d)。

图7血浆外泌体miR-142-5p水平与系统IDO活性和临床CSCC病理进展相关
总之,本文的结果表明CSCC分泌的外泌体miR-142-5p下调淋巴管中ARID2的表达,抑制DNMT1募集至IFN-γ启动子,并增强IFN-γ转录通过抑制启动子甲基化,导致IDO活性升高随后造成耗竭。






