不要再昼夜颠倒了 可能会得结肠炎
溃疡性结肠炎(UC)和克罗恩病统称为炎症性肠病(IBDs),是一种全球性疾病,在发达国家发病率很高(0.3%),在发展中国家发病率正在迅速升高,导致大量的医疗保健费用和工作生产力的损失。本文发现了由循环和NF-κB驱动的lncRNA(Lnc-UC)通过表观遗传修饰了生物钟基因Rev-erbα的转录,从而将生物钟与结肠炎联系起来。本文于2020年10月发表于《Science Advances》IF:13.116。
技术路线如下:

该文主要结果如下:
1、Lnc-UC是一个循环和大肠杆菌相关的lncRNA
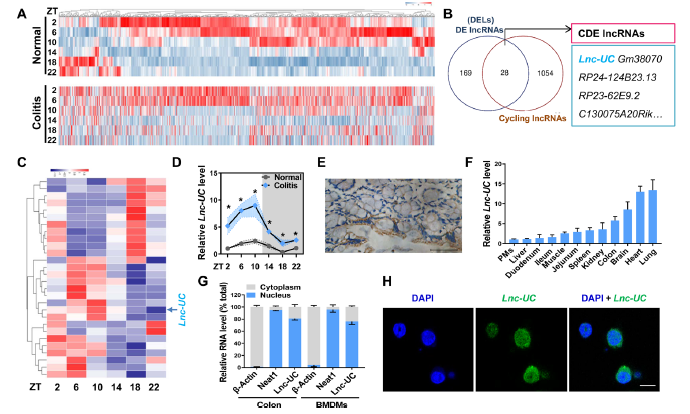
结肠炎和正常小鼠RNA测序,筛选到197个差异表达的lncRNA,其中有28个是循环相关的,包括Lnc-UC (ENSMUST00000124503.1)(图1A-C)。Lnc-UC的表达具有明显的昼夜性,在ZT10时显著高表达,原位杂交(CISH)证实了小鼠结肠中存在Lnc-UC,且在其它组织中也存在表达,包括肺、心、脑、肾、腹膜巨噬细胞(PMs)等(图1D-F)。Lnc-UC主要分布于结肠细胞和骨髓来源巨噬细胞(BMDMs)的细胞核中(图1G-H)。
2、NF-κB驱动结肠炎小鼠表达Lnc-UC
KEGG揭示结肠炎与NF-κB通路及其相关通路的激活有关,如NF-κB靶向基因Ptgs2,IL-1β和Cxcl2的表达升高(图2A-B)。无论是BMDMs中还是血浆BMDMs 或者PMs中Lnc-UC的表达与LPS诱导的剂量和时间有依赖性(图C-F)。此外,重组Tnfα蛋白(NF-κB激活剂)和p65(NF-κB亚基)的过表达质粒都能诱导BMDMs中Lnc-UC的表达,而JSH-23(NF-κB抑制剂)则抑制Lnc-UC的表达(图2G-I)。双荧光素酶实验鉴定到两个Lnc-UC启动子与p65结合的区域,而重组Tnfα蛋白增强了p65募集至结合位点(图2)。总之,NF-κB驱动Lnc-UC的表达通过转录激活机制。
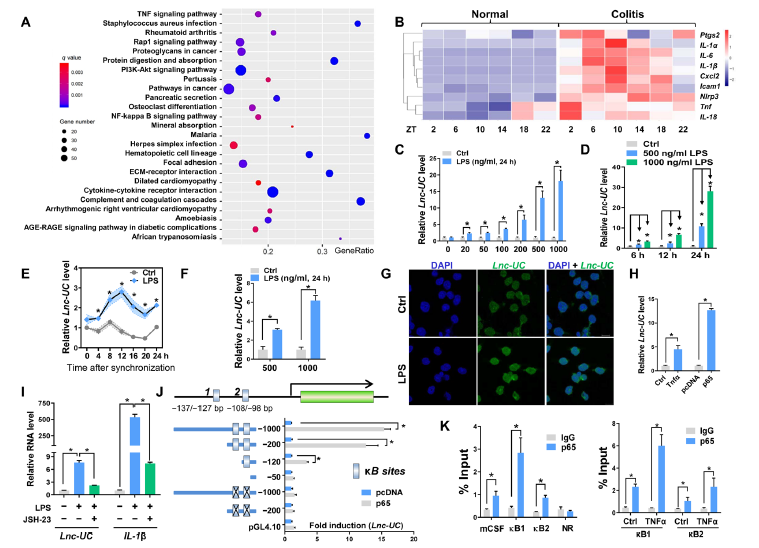
图2 NF-κB驱动结肠炎小鼠表达Lnc-UC
将Lnc-UC过表达和对照的BMDMs细胞用于RNA测序,发现Lnc-UC诱导免疫应答相关基因表达发生显著变化(图3A-B)。通过获得与缺失实验证实Lnc-UC是NF-κB靶向基因(包括Nlrp3, IL-6, Tnfα, IL-1β, and IL-18))的负调节剂(图3C-D)。Lnc-UC敲除诱导的NF-κB靶向基因表达的改变可以通过Lnc-UC过表达恢复,表明Lnc-UC对NF-κB有特殊的作用(图3E)。与此一致,Lnc-UC抑制NF-κB的转录活性(图3F-G)。这表明Lnc-UC在NF-κB信号和炎症中扮演抑制作用。

图3 Lnc-UC作为炎症调节因子
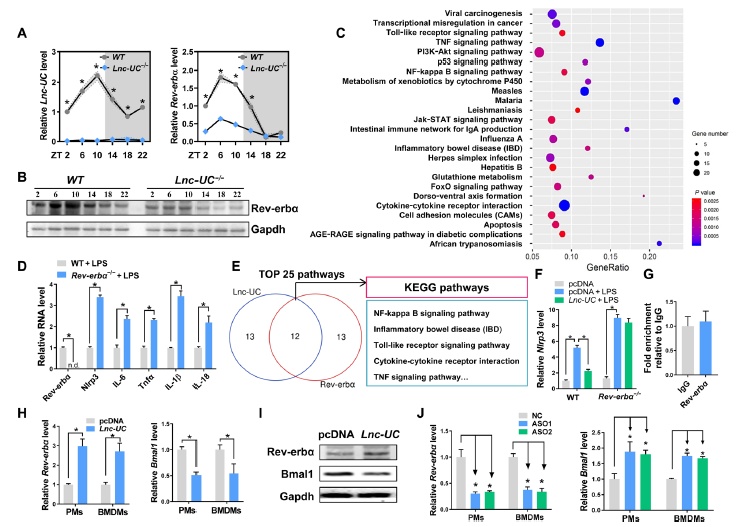
作者构建了Lnc-UC敲除小鼠(Lnc-UC−/−),然后和WT鼠一起药物诱导发生实验性结肠炎,结果显示Lnc-UC−/−小鼠对结肠炎的敏感性增加,体重丢失更大,疾病活性指标更高,结肠更短(图3H-K)。并且,Lnc-UC−/−小鼠结肠炎病理更严重,此外,其预后与昼夜节律性显著相关(图3L-P)。总之,这些结果表明Lnc-UC调节小鼠昼夜性结肠炎。
Lnc-UC调节生物钟基因Rev-erbα和炎症。Lnc-UC缺失导致生物钟基因表达中断,特别是Rev-erbα(图4A-B)。据报道Rev-erbα通过NF-κB信号通路和Nlrp3炎性小体参与生物钟和结肠炎的调节。因此探究其在Lnc-UC炎性机制中的作用。结果显示过表达Rev-erbα导致免疫响应相关基因表达改变,敲除Rev-erbα则导致炎性分子表达上调(图4C-D)。作者观察到,在BMDMs中,Lnc-UC和Rev-erbα相关的炎症富集通路高度重叠(图4E)。此外,Lnc-UC减少了Rev-erbα靶基因Nlrp3的表达,而这种抑制作用在Rev-erbα敲除小鼠中不存在(图4F)。由于RIP显示Lnc-UC和Rev-erbα不存在相互作用(图4G),所以作者进一步探究了其作用机制,结果发现过表达Lnc-UC导致细胞中Rev-erbα表达升高但是其靶基因Bmal1的表达减少,敲除则相反(图4H-I)。这些数据表明Lnc-UC获得的抗炎效果可能通过调节Rev-erbα的表达。
5、Lnc-UC通过与Cbx1相互作用,表观遗传调控Rev-erbα
Lnc-UC包括4个茎环结构可能用于靶向调控其它蛋白,实验表明Cbx1作为一个核蛋白可以与Lnc-UC相互作用(图5A-E)。结合位点位于1-74nt和326-432nt片段区域,一旦该区域突变,则不能调控Rev-erbα的表达和抑制炎症反应(图5F)。Lnc-UC敲除增强了H3K9的三甲基化,增加了对Rev-erbα的表观遗传调控的可能性(图5G)。ChIP实验显示Cbx1,Suv39h1和H3K9me3在Rev-erbα启动子区域显著富集,而Lnc-UC敲除增强了这种富集作用(图5H)。此外,Cbx1敲除则减少了H3K9me3在Rev-erbα启动子区域富集,促进了Rev-erbα的表达和转录(图5I-J)。总之,Lnc-UC通过减弱Cbx1介导的H3K9三甲基化来调控Rev-erb转录(图5K)。具体地说,Lnc-UC可能作为诱饵,吸引从Rev-erb启动子中去除Cbx1及其伙伴Suv39h1(图5K)。因此,H3K9的三甲基化减弱,Rev-erb转录被激活(图5K)。
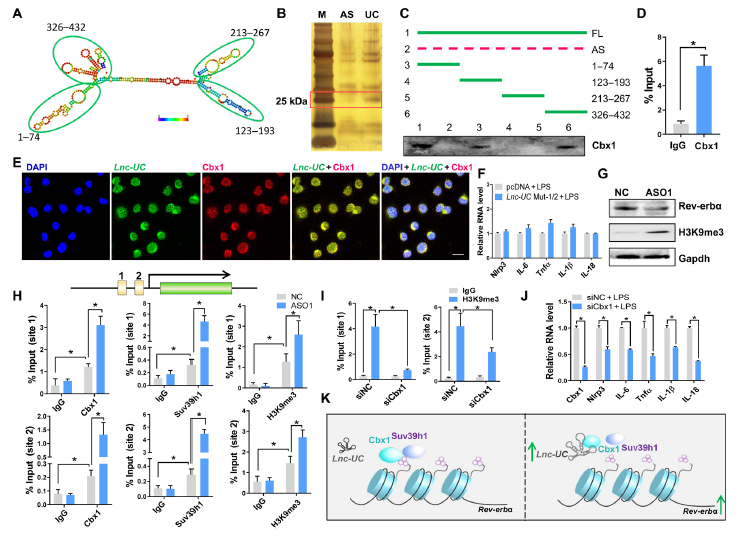
图5 Lnc-UC与Cbx1和调节Rev-erbα转录通过减少H3K9的三甲基
探究Lnc-UC在小鼠中的功能能否由于高度的物种保守而存在于人类中,是很有意义的。因此,在人的样本中检测其是否存在,如图6A,人Lnc-UC(hLnc-UC)被扩增出来。并且hLnc-UC能在人结肠中检测到,结肠炎患者表现出hLnc-UC,NLRP3,IL-1β表达升高(图6B-C)。hLnc-UC在血清的THP-1细胞中有规律地表达,其模式类似于BMAL1(图6D)。 此外,hLnc-UC在THP-1细胞中的过表达导致Rev-erbα表达增加和Rev-erbα依赖性炎症因子水平降低(图6E-G)。在单核细胞衍生的巨噬细胞中也观察到了类似的结果(图6H-I)。 总之,这些数据表明,与结肠炎相关的hLnc-UC可能像在小鼠中一样促进Rev-erbα表达以抑制炎症。
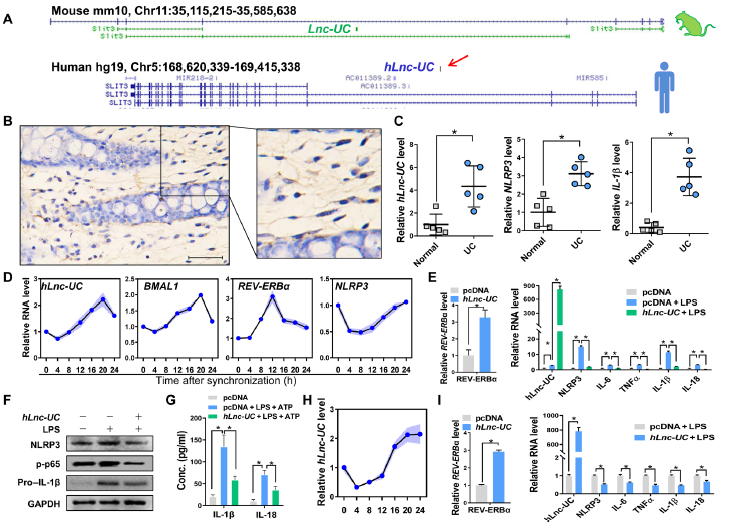
图6 hLnc-UC是一种循环、抗炎的lncRNA
NF-κB驱动的Lnc-UC充当Rev-erbα的表观遗传调控因子,从而协调了昼夜节律和结肠炎。 Lnc-UC可能在干预炎症和昼夜节律之间的交流并控制结肠炎。
参考文献:
Wang Shuai., Lin Yanke., Li Feng., Qin Zifei., Zhou Ziyue., Gao Lu., Yang Zemin., Wang Zhigang., Wu Baojian.(2020). An NF-κB-driven lncRNA orchestrates colitis and circadian clock. Sci Adv, 6(42), undefined. doi:10.1126/sciadv.abb5202






