被逼无奈的帮凶:M2巨噬细胞促进食管癌进展
FOXO1对于调节细胞因子和趋化因子非常关键,但是它在肿瘤微环境中的功能一直未能明确。在这篇文章中,作者表征了FOXO1的预后价值,以及肿瘤来源的FOXO1和M2巨噬细胞在ESCC中的相互作用。本文于2020年9月16发表在《Theranostics》IF:8.579。
技术路线:

主要实验结果如下:
1、过表达FOXO1预示ESCC的不良预后和高M2巨噬细胞浸润
52对ESCC病人样本中检测FOXO1的表达,结果显示肿瘤组织中显著高于对照,随后在144例样本中验证了该结果。生存曲线表明FOXO1高表达与患者不良预后相关(图1A-C)。
随后使用RNA测序从三株ESCC肿瘤中鉴定到22种免疫细胞浸润,其中CD4记忆检测T细胞,M2巨噬细胞,和单核细胞在ESCC中的浸润水平最高(图1D)。但是TCGA和实验数据分析显示,免疫细胞中只有M2巨噬细胞标志物CD206在FOXO1高表达组显著上调,随后组织(图1E-F)。肿瘤组织的病理评估揭示更多的巨噬细胞,尤其是CD206阳性的巨噬细胞,会在肿瘤高表达FOXO1的肿瘤间质边缘浸润(图1G-H)。

图1在ESCC病人中,过表达FOXO1与较差的生存结果和高M2巨噬细胞浸润相关
2、FOXO1促进M2巨噬细胞浸润异种肿瘤
作者将FOXO1(+)和FOXO1(-)肿瘤细胞注射于裸鼠两侧,3周后取肿瘤进行检测。结果显示FOXO1(+)组的M2巨噬细胞浸润水平显著高于FOXO1(-)组。此外,CD68在FOXO1(+)肿瘤组织中过表达,提示肿瘤来源的FOXO1在体内可促进巨噬细胞浸润。FOXO1(+)肿瘤组织中浸润的巨噬细胞主要为CD206阳性。
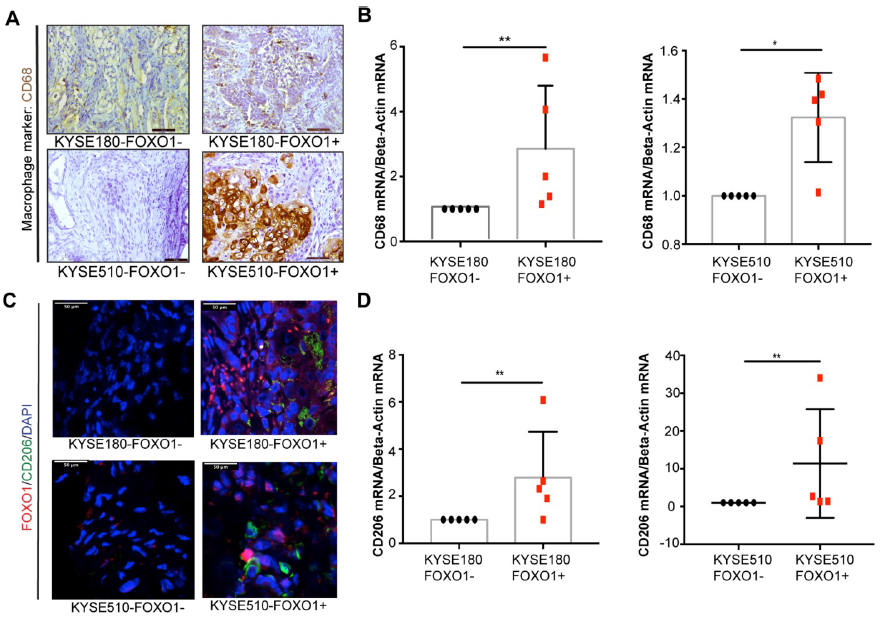
图2 M2巨噬细胞浸润小鼠模型
3、FOXO1调节CCL20的表达
此前的研究表明,TNF-α刺激FOXO1过表达会显著放大NF-κB依赖的CCL20的产生。此外,CCR6是CCL20的受体,在多种髓细胞系表达,包括巨噬细胞。所以进一步研究FOXO1是否影响CCL20的表达,结果显示在FOXO1(+)的肿瘤细胞中CCL20上调表达,干扰FOXO1则CCL20的表达下调(图3A-D)。
4、FOXO1(+)的肿瘤细胞通过CCL20分泌促进M2巨噬细胞募集
作者发现当与FOXO1(+)的肿瘤细胞孵育后M2巨噬细胞的迁移显著增加了(图3E)。随后用CCL20的重组蛋白处理M2巨噬细胞发现其迁移也显著增加,但是使用CCL20的抗体预处理后则M2巨噬细胞的迁移降低了。与此一致,干扰FOXO1(+)的后M2巨噬细胞的迁移也显著下降(图3E-G)。这些结果表明FOXO1是通过分泌CCL20介导M2巨噬细胞迁移。
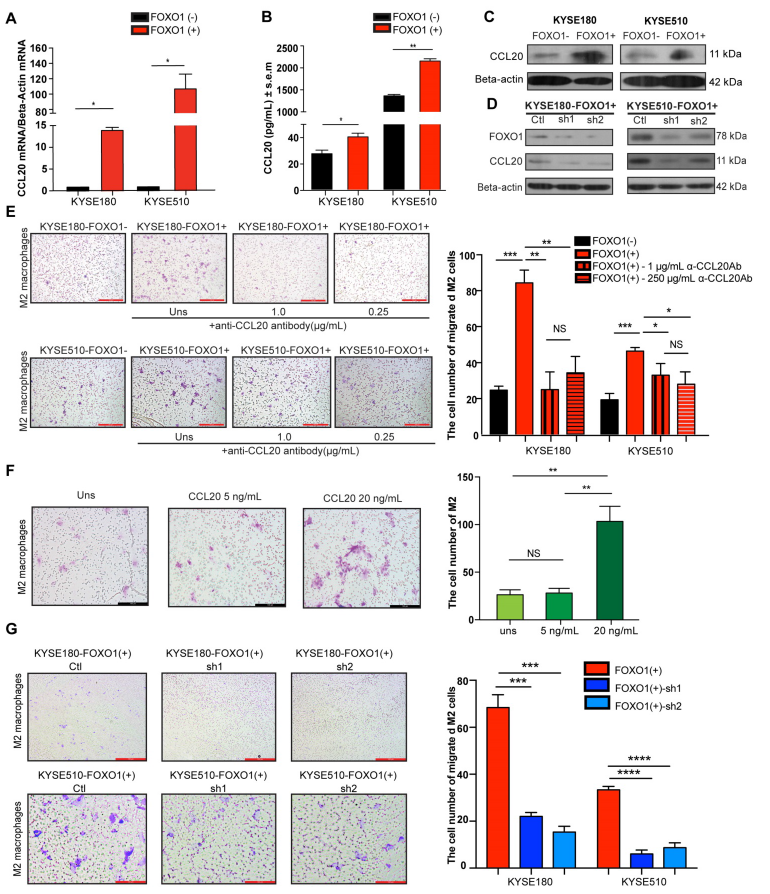
图3 FOXO1(+)肿瘤细胞通过分泌CCL20促进M2巨噬细胞募集
5、FOXO1(+)肿瘤细胞促进M0巨噬细胞向M2巨噬细胞极化
作者构建了ESCC肿瘤细胞与M0巨噬细胞的共培养系统,流式检测结果显示当两者共培养时M2巨噬细胞的组分(CD163+/CD68+)显著增加了(图4A)。相反,敲除FOXO1则M2极化显示受损(图4B)。为了全面评估诱导M2巨噬细胞极化表型,分析了其标志物的表达。结果发现FOXO1诱导的M2巨噬细胞显著高表达CD206, CD163, IL10, CCL18, CLEC7A,和STAT6(图4C)。而GSEA结果显示FOXO1诱导的M0巨噬细胞具有与IL-4刺激的M2巨噬细胞类似的分子特征(图4D-E)。表明FOXO1诱导的巨噬细胞都是M2巨噬细胞。
6、CSF-1介导FOXO1诱导的M0巨噬细胞极化
CCL20是作者发现的FOXO1诱导M0巨噬细胞向M2极化的第一个细胞因子,但是作者发现CCL20并不能显著影响M2巨噬细胞标志物的表达。于是作者依据前人的研究猜测CSF-1可能也在M2巨噬细胞分化中扮演了重要作用。结果表明CSF-1在FOXO1(+)肿瘤细胞中显著上调(图4F-H)。随后还发现,沉默FOXO1后CSF-1的过表达显著减少了,并且FOXO1抗体显著参与了CSF-1启动子的片段的富集(图4FI-J)。随后,将FOXO1(+)肿瘤细胞与M0巨噬细胞在CSF-1抗体存在的情况下进行共培养,结果发现,CD163+/CD68+的比例显著下降,而CSF-1刺激后CD206,CD163和CCL18的表达显著上调,CD163+/CD68+的比例也显著升高(图4K-L)。

图4 FOXO1(+)肿瘤细胞通过产生CSF-1促进M0巨噬细胞向M2巨噬细胞极化
7、FOXO1通过M2巨噬细胞介导FAK/PI3K/AKT信号促进肿瘤细胞增殖和迁移
M2巨噬细胞分泌肿瘤促进因子,包括Arg-1,TGF-b和CCL18,这些都与肿瘤进展相关。为了探究M2巨噬细胞对肿瘤的促进作用,作者将M2的条件培养基与ESCC肿瘤细胞共培养,结果显示其显著促进ESCC细胞的增殖和集落形成(图5A-B)。进一步在体内验证其促肿瘤作用,结果发现与对照相比,M2条件培养基处理过的ESCC细胞的成瘤更大(图5D)。接着作者探究了M2促进肿瘤生长的通路。结果显示,M2调节培养基处理过后,增强了FAK,PI3K和 AKT的磷酸化(图5E)。为了验证M2介导的激活,使用PI3K抑制剂LY294002阻断结果发现AKT的激活被显著抑制(图5F)。LY294002处理后经M2条件培养基诱导的集落形成,细胞活力和增殖都显著减少了(图5G)。这些结果表明M2巨噬细胞激活了FAK/PI3K/AKT通路促进肿瘤增殖。
据报道CCL18参与了多种癌症的FAK/PI3K/AKT通路和上皮间质转化,因此,收集M0,M2和FOXO1(+)/(-)诱导的M0巨噬细胞以检测CCL18的浓度。结果显示,M2巨噬细胞中CCL18的表达显著上调(图J)。此外,CCL18重组蛋白能激活FAK/PI3K/AKT通路(图K)。总之,尽管M2巨噬细胞和肿瘤细胞间的相互影响较为复杂,但是这些结果表明由M2巨噬细胞分泌的CCL18是其相互关联的因子之一。
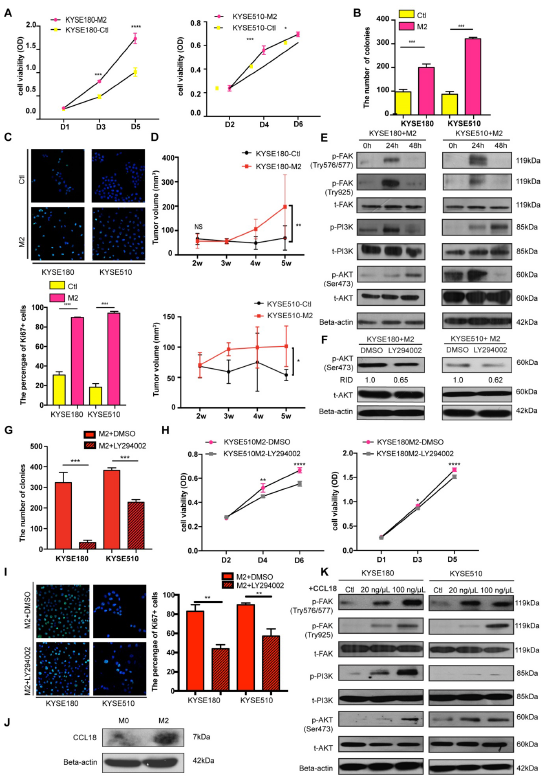
图5 M2巨噬细胞通过FAK/PI3K/AKT信号通路促进肿瘤细胞增殖和迁移
参考文献:
Wang Ying., Lyu Zhaojie., Qin Yanru., Wang Xia., Sun Liangzhan., Zhang Yu., Gong Lanqi., Wu Shayi., Han Shuo., Tang Ying., Jia Yongxu., Kwong Dora Lai-Wan., Kam NgarWoon., Guan Xin-Yuan.(2020). FOXO1 promotes tumor progression by increased M2 macrophage infiltration in esophageal squamous cell carcinoma. Theranostics, 10(25), 11535-11548. doi:10.7150/thno.45261






