circCUL2调控胃癌的恶性转化和顺铂耐药
circRNAs是一类非编码RNAs,可通过与miRNA结合调节基因表达;此外,circRNAs已经被证明参与了几个病理过程。然而circCUL2在胃癌(GC)中的表达及生物学功能尚不清楚。那么小编为大家带来近期发表于影响因子15.302的“Molecular Cancer”上的文章“circCUL2 regulates gastric cancer malignant transformation and cisplatin resistance by modulating autophagy activation via miR-142-3p/ROCK2”,为大家详细介绍circCUL2在胃癌中的作用和具体分子机制。

我们发现circCUL2在GC组织和细胞系中下调。circCUL2抑制GC细胞的增殖、迁移和侵袭。此外,circCUL2在耐顺铂GC细胞系中下调,并调节了顺铂的敏感性。circCUL2可能通过竞争性结合miR-142-3p、调节ROCK2表达和自噬激活,参与肿瘤发生和化疗耐药性。
技术路线:

结果:
1) circCUL2在GC组织和细胞中的表达和特征
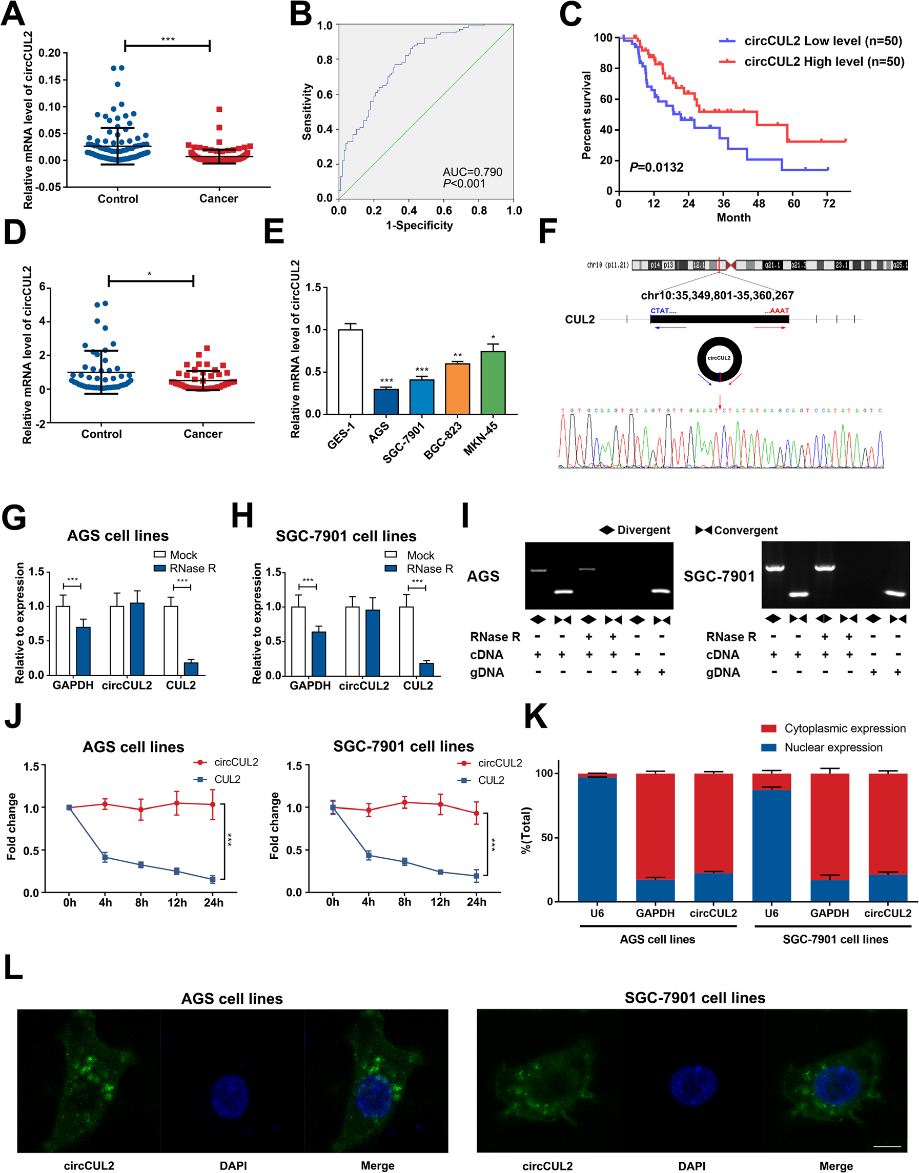
我们应用芯片技术来探索几种circRNAs在胃癌组织和邻近组织之间的差异表达。基于差异表达的基因以及GO和KEGG分析结果,我们选择circCUL2进行进一步研究。与成对的非癌组织相比,胃癌组织中circCUL2的表达明显降低(图1a)。通过ROC分析circCUL2对GC的诊断价值,ROC曲线下面积为0.790 (图1b)。Kaplan-Meier分析显示circCUL2水平低的胃癌患者总生存率较差(图1c)。然后,通过qRT-PCR检测,与正常血清相比,GC血清中circCUL2水平明显降低(图1d)。此外,AGS和SGC-7901细胞株中的circCUL2水平降低,选择进行进一步研究(图1e)。
随后,我们通过Sanger测序对circCUL2 qRT-PCR产物序列进行了验证,靶区为头尾剪接位点,序列与circBase数据库中的序列一致(图1f)。circCUL2可以抵抗RNase R的处理(图1g-i),聚合引物扩增的线性CUL2被RNase R消化(图1g-i)。此外,在经转录抑制剂放线菌素D处理的AGS和SGC-7901细胞系中,CUL2的线性转录本的半衰期比circCUL2短(图1j)。核质RNA qRTPCR和FISH抗circCUL2的结果显示,circCUL2优先定位于细胞质中(图k-l)。这些结果表明circCUL2可能参与了GC的发生发展,circCUL2稳定且主要分布在细胞质中。
2) circCUL2抑制GC细胞的恶性转化
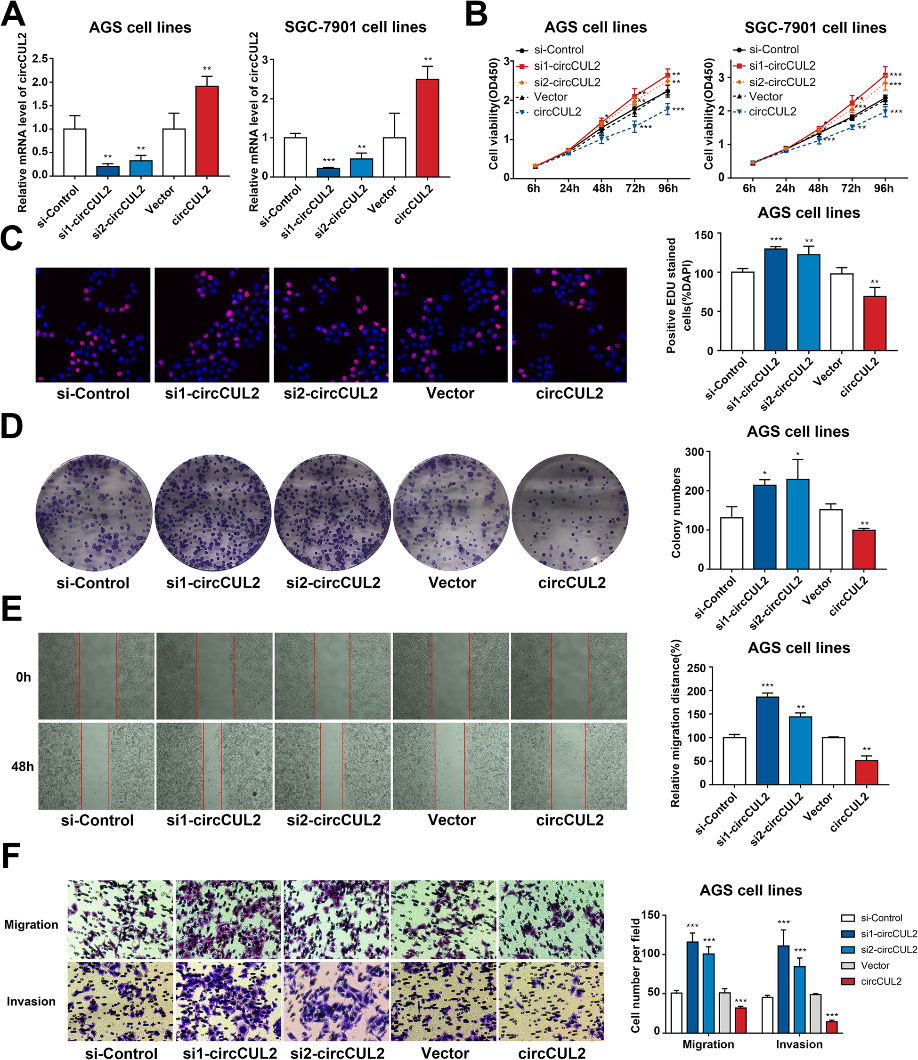
为了进一步探究circCUL2对GC细胞的功能作用,我么利用RNA干扰和过表达质粒进行以下实验(图2a)。CCK-8和EdU实验证实circCUL2下调增强了GC细胞的增殖能力(图2b-c)。circCUL2抑制也增强了对菌落形成的影响(图2d)。此外,通过Transwell和伤口愈合检测细胞迁移,发现circCUL2特异性siRNA增加了细胞迁移(图2e和f)。在circCUL2过表达的细胞中,细胞浸润被抑制,而在circCUL2表达降低的细胞中,细胞浸润被促进(图2f)。过表达circCUL2则产生相反的效果,它抑制了细胞的增殖、迁移和侵袭(图2b-f)。
3) circCUL2作为miR-142-3p海绵
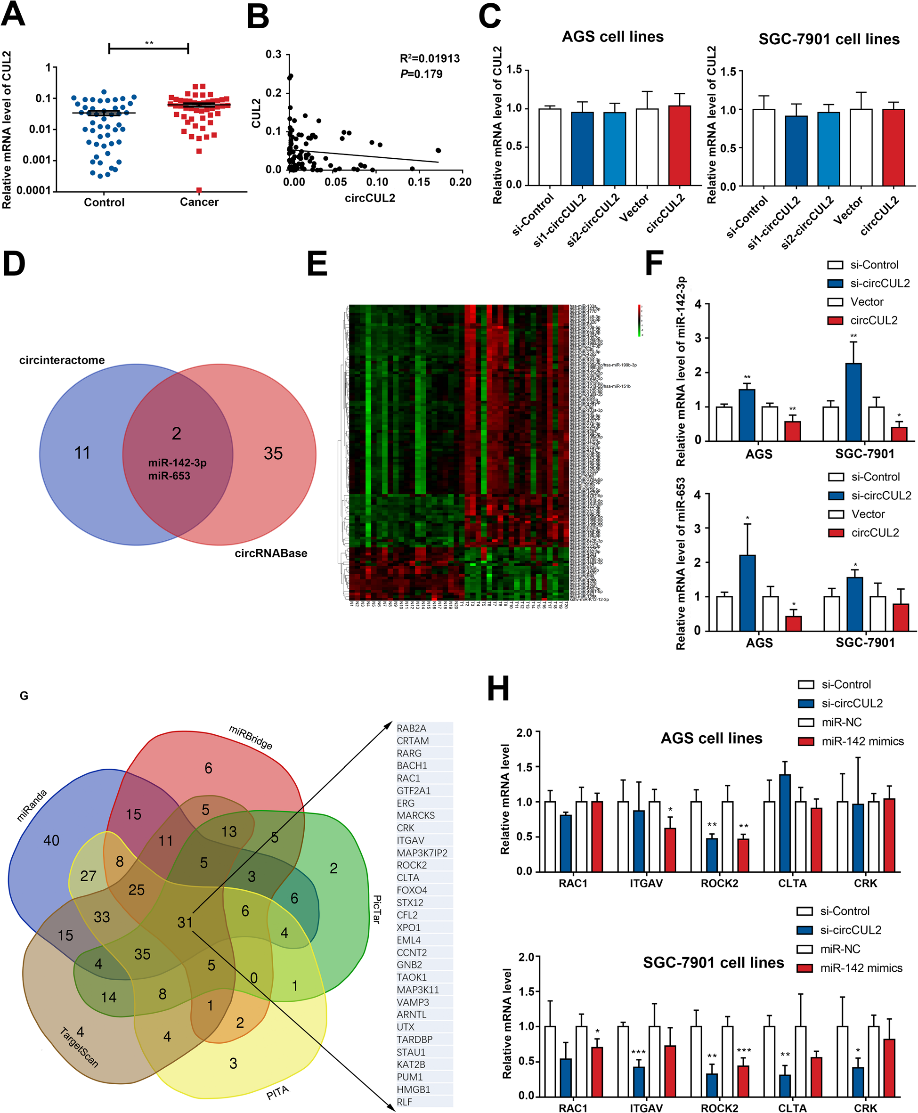
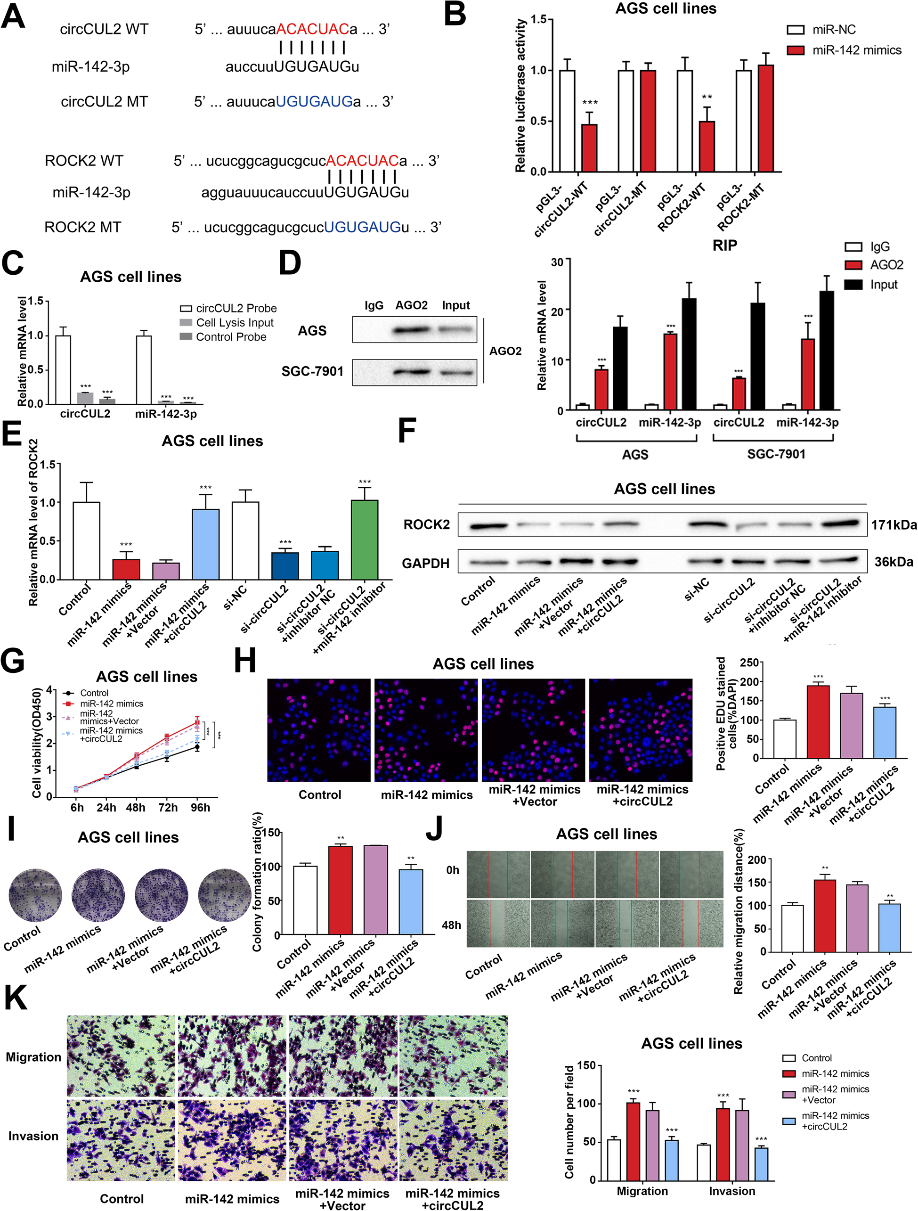
circCUL2的细胞质定位提示circCUL2可能在转录后水平参与了GC的发展。为了研究选择性剪接机制,我们检测了CUL2在GC组织中的线性表达。qRT-PCR结果显示CUL2在GC组织中升高,但与circCUL2无相关性(图3a-b)。此外,抑制或过表达circCUL2均不会改变线性CUL2的mRNA表达水平(图3c)。在排除了选择性剪接机制后,我们下一步研究了circCUL2结合miRNAs的能力。CircInteractome和circRNABase工具用于预测可能与circCUL2序列结合的潜在靶标miRNAs(图3d)。结合GC组织的miRNA芯片(图3e),选择miR-142-3p和miR-653。在circCUL2 siRNA或circCUL2过表达质粒处理的细胞中,只有miR-142-3p水平升高或降低(图3f)。然后,利用NCBI数据库进行功能分析,筛选出miRanda、miRBridge、PicTar、PITA和TargetScan预测的miR-142-3p的靶基因(图3g)。只有ROCK2被发现受到circCUL2和miR-142-3p的调控(图3h)。基于这些结果,我们推测circCUL2可能作为miR142-3p海绵调节ROCK2。
4) 体内circCUL2、miR-142-3p和ROCK2的表达
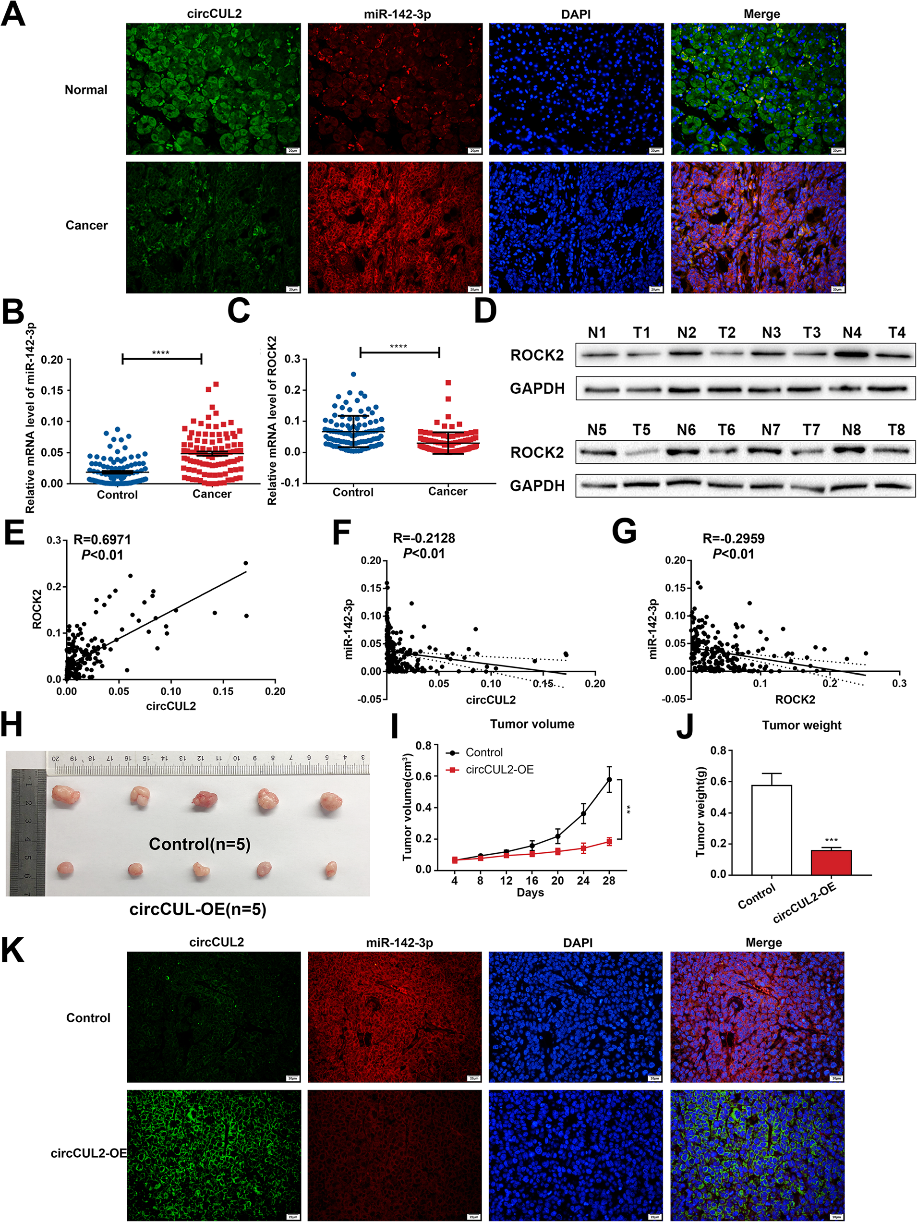
为了研究circCUL2、miR-142-3p和ROCK2在体内的作用,我们对circCUL2和miR-142-3p在GC组织中的作用进行了FISH检测。结果显示,circCUL2和miR-142-3p共局域化,表达相反(图4a)。在GC组织中,miR142-3p的miRNA水平显著上调(图4b),而ROCK2的mRNA和蛋白水平显著降低(图4c-d)。此外,miR-142-3p与circCUL2或ROCK2表达水平呈显著负相关,而circCUL2和ROCK2表达水平呈显著正相关(图4e-g)。接着,将稳定转染circCUL2OE或空载体的细胞皮下接种于裸鼠,密切监测裸鼠肿瘤生长4周。我们的结果表明,来自circCUL2-OE细胞的肿瘤明显小于来自空载体-的肿瘤转染细胞(图4h)的体积和重量(图4i-j)。基于FISH(图4k)观察了circCUL2和miR-142-3p的共定位。
5) circCUL2在体外通过miR-142-3p/ROCK2调控恶性转化
在体外我们进一步研究了circCUL2/miR-142-3p/ROCK2是否能够调控肿瘤的发生和恶性转化。生物信息学数据库分析预测circCUL2和ROCK2可以与miR-142-3p结合(图5a)。荧光素酶报告基因实验结果进一步证实,miR-142-3p可以直接结合circCUL2和ROCK2的3'UTR位点(图5b)。RNA下拉结果显示,与对照组相比,circCUL2特异性探针下拉样品中circCUL2和miR-142-3p显著富集(图5c)。接下来,我们在AGS和SGC-7901细胞系中使用抗AGO2抗体进行RIP。结果显示circCUL2和miR-142-3p被抗AGO2抗体沉淀后显著富集(图5d)。此外,我们还探讨了circCUL2/miR-142-3p调控GC进展的潜在机制。miR-142-3p模拟物或circCUL2 siRNA诱导的ROCK2 mRNA和蛋白水平下降,分别通过过表达circCUL2或转染miR-142-3p抑制剂逆转(图5e和f)。此外,在AGS和SGC-7901细胞中过表达miR-142-3p可提高增殖率(图5gh)、迁移能力和侵袭能力(图5j-k)。为了进一步确定circCUL2是否通过与miR-142-3p相互作用发挥其功能,我们将miR-142-3p模拟物和circCUL2表达质粒共转染到GC细胞中。过表达circCUL2的细胞中,miR-142-3p对GC细胞生长和运动促进的影响被逆转(图5g-k)。这些数据表明circCUL2通过吸附miR-142-3p抑制GC细胞的生长和转移。
6) circCUL2调节胃癌细胞对顺铂的敏感性
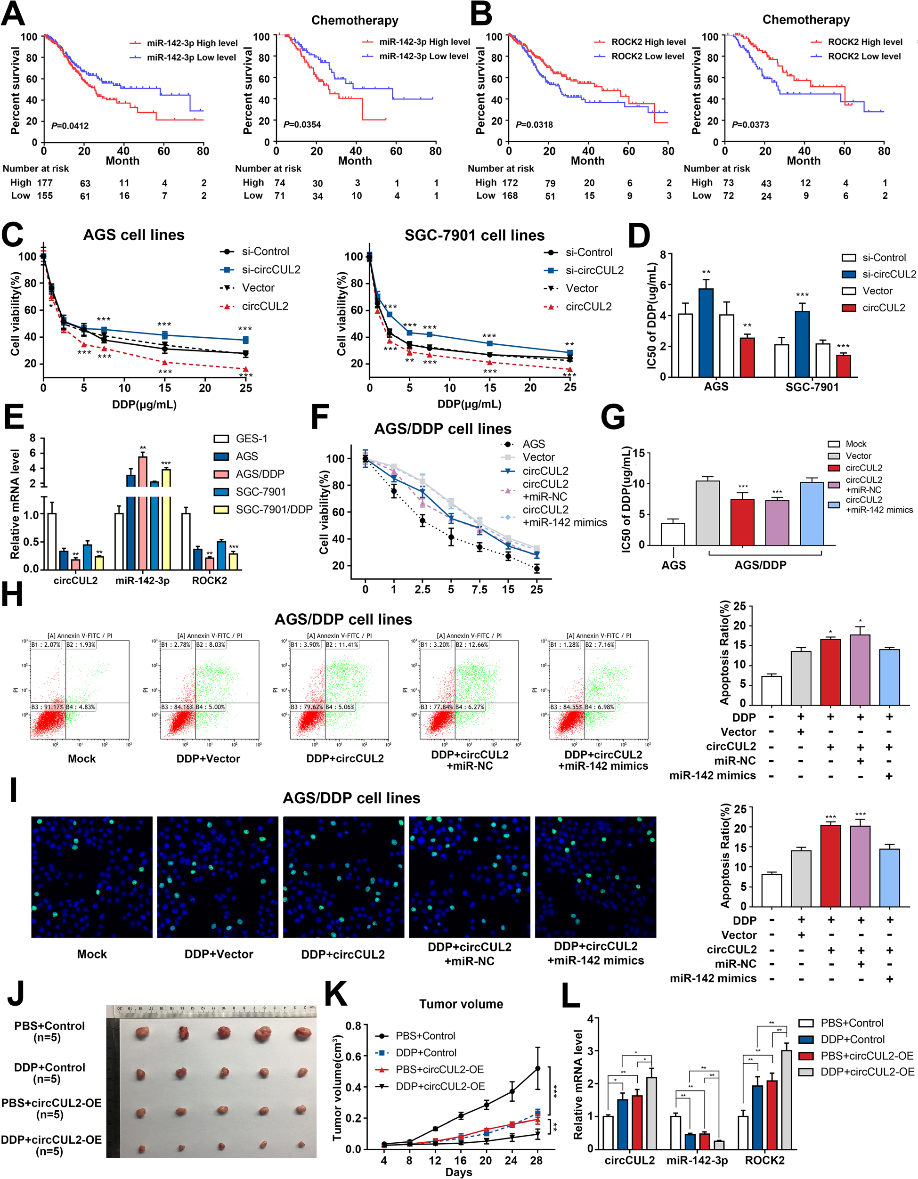
由于circCUL2下游的miR-142-3p和ROCK2可能与胃癌预后相关,我们分析了TCGA数据库,发现miR-142-3p的高表达和ROCK2的低表达可导致无病生存(DFS)或DFS联合化疗缩短(图6a-b)。提示circCUL2可能参与了GC细胞的化疗耐药性。因此,我们筛选顺铂、5-FU、DOX和MMC,以确定circCUL2对其敏感性影响最大的药物。结果显示,升高的circCUL2主要抑制顺铂处理的细胞活力,而降低的circCUL2主要诱导顺铂耐药(图6c)。干扰circCUL2可以提高IC50,而过表达circCUL2可以降低IC50(图6d)。
为了验证circCUL2调控顺铂敏感性的假设,我们构建了顺铂耐药AGS/DDP和SGC-7901/DDP细胞系。与正常GC细胞系相比,顺铂耐药GC细胞系circCUL2和ROCK2表达显著降低,miR142-3p表达显著升高(图6e)。随后,共转染miR-142-3p模拟物和circCUL2表达构建物后,顺铂处理AGS/DDP和SGC-7901/DDP细胞系。当细胞过表达miR-142-3p时,circCUL2诱导的增殖抑制和凋亡促进作用被逆转(图6f-i)。此外,异种移植瘤数据显示,高水平的circCUL2显著降低了异种移植瘤的生长,并使细胞对顺铂治疗敏感(图6j-k)。qRT-PCR结果显示,circCUL2的上调可显著诱导circCUL2和ROCK2的mRNA水平,而异种移植标本中miR-142-3p的水平则受到抑制(图6l)。这些数据表明,过表达的circCUL2通过吸附miR-142-3p促进顺铂的敏感性。
7) circCUL2通过靶向顺铂耐药GC细胞中的miR-142-3p抑制自噬
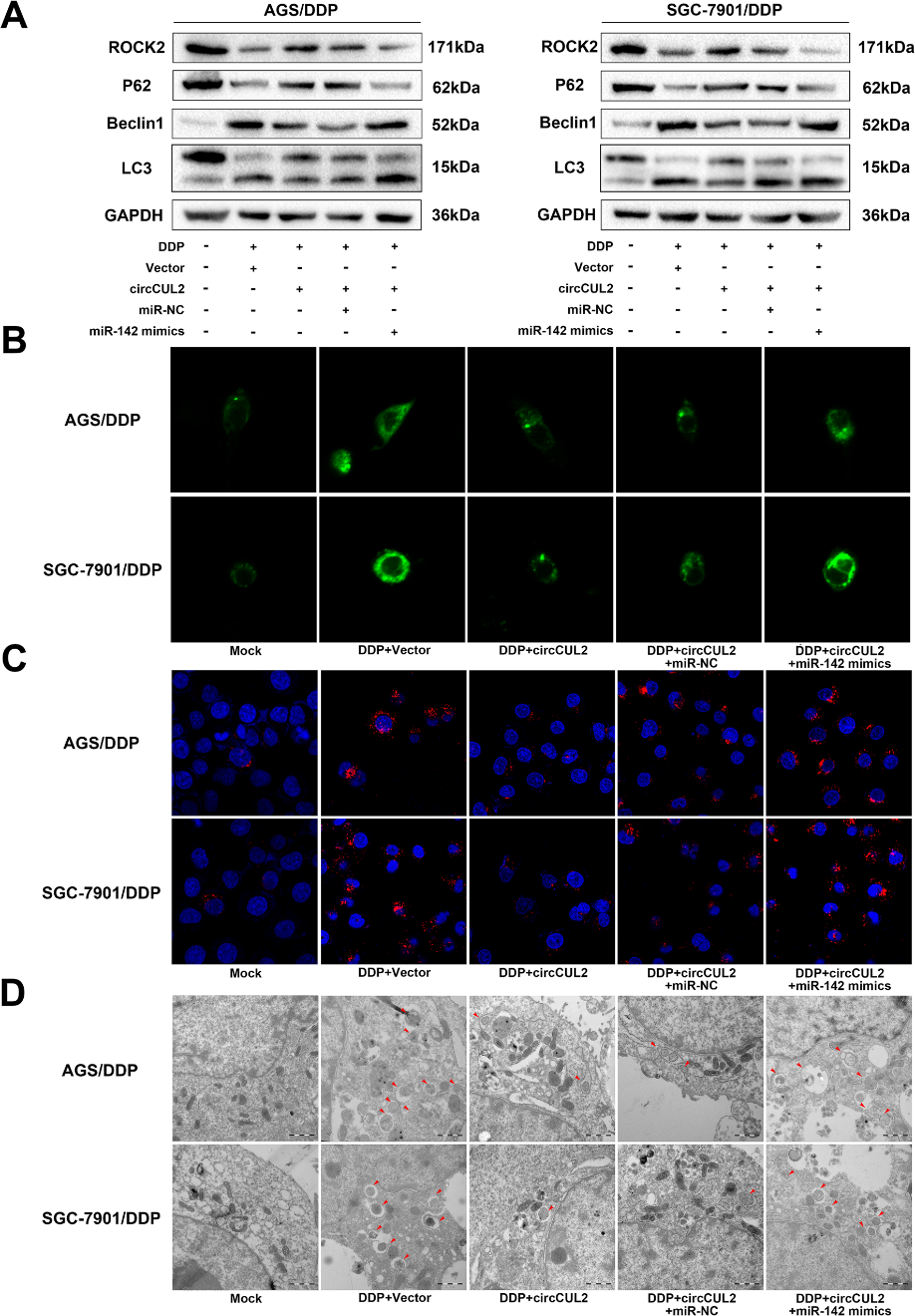
自噬与miR-142-3p和ROCK2的差异表达相关。circCUL2提高了顺铂在GC中的敏感性,因此我们有兴趣研究circCUL2是否通过miR-142-3p在AGS/ DDP和SGC-7901/DDP细胞系中抑制自噬。与预期一样,WB分析显示,过表达circCUL2增加了ROCK2和p62的表达,而miR-142-3p模拟物则挽救了它们(图7a)。此外,circCUL2抑制了自噬活性的标记物LC3和Beclin1的表达,但在顺铂耐药的GC细胞中过表达miR-142-3p时,这种作用被逆转(图7a)。与模拟细胞相比,外源GFPLC3B质粒预处理后的DDP处理细胞中,GFP-LC3B斑点显著增加,表明自噬小泡形成(图7b)。此外,过表达circCUL2的细胞自噬小泡的形成比载体处理的细胞少。自噬小泡形成的减少可以被miR-142-3p模拟物逆转(图7b)。同样,免疫荧光法计算的LC3蛋白表达量(图7c)和透射电镜观察的自噬小体数(图7d)与GFP-LC3B质粒转染结果的趋势相同。因此,这些结果表明circCUL2通过miR-142-3p/ROCK2在顺铂耐药GC细胞中抑制自噬。
结论:circCUL2可能通过miR-142-3p/ROCK2介导的自噬激活作为肿瘤抑制因子和顺铂敏感性调控因子,可能是胃癌的关键机制和治疗靶点。






