单细胞测序揭示ETP-ALL共存的致瘤状态和免疫逃逸的发育可塑性

Dana-Farber癌症研究所Praveen Anand课题组发现,通过对恶性和微环境细胞的全长单细胞RNA测序,研究了携带活化NOTCH1突变的复发/难治性早期t细胞祖细胞急性淋巴细胞白血病的耐药机制。我们发现了两种高度不同的干细胞样状态,它们在细胞周期和致癌信号传导方面存在显著差异。快速循环的干细胞样白血病细胞表现出Notch激活,通过Notch抑制可有效消除患者体内的Notch,而缓慢循环的干细胞样细胞不依赖于Notch信号通路,而是依赖于PI3K信号通路。该研究还发现这两种干细胞样状态都可以分化为更成熟的白血病状态,具有显著的免疫调节功能,包括LGALS9检查点分子的高表达。这些细胞通过表达LGALS9的同源受体HAVCR2,功能失调的CD8+ T细胞克隆积累促进免疫抑制白血病生态系统。研究确定了信号程序、细胞可塑性和免疫程序之间复杂的相互作用,这些程序是T-ALL的特征,并说明了肿瘤异质性的多维性。相关论文于2020年11月23日发表在《Blood》杂志上。
急性T淋巴细胞白血病(T-ALL)是一种侵袭性的恶性血液肿瘤,主要发生了儿童和青年人。虽然T-ALL患者的总体预后较好,但仍有20%左右的患者对常规治疗无应答,大部分这类患者都属于复发性或难治性疾病。多种破坏正常胸腺细胞发育的细胞遗传学和分子遗传都可导致T-ALL,大部分病例可根据胸腺细胞不同的成熟状态划分亚组。
早期急性T前体淋巴细胞白血病(ETP-ALL)是一种特殊的T-ALL亚型,显示出独特的遗传和转录特征,表明它们与髓系前体细胞和髓系恶性肿瘤有密切的关系。目前还不清楚这些特征是否同时存在于单个ETP-ALL细胞中,是否能够反映肿瘤细胞群中离散的、异质的细胞状态。
样本信息:
收集NCT01363817试验(应用了Notch抑制剂BMS-906024)招募的携带NOTCH1激活突变的复发性/难治性ETP-ALL患者的血液或骨髓样本。建立了T-ALL的移植瘤动物模型(PDX),采用了多种肿瘤细胞系:DND-41、KOPT-K1、HPB-ALL、Loucy、MOLT-4、NALM-6、SEM、KG-1、Jurkat 和HL-60。
技术路线:
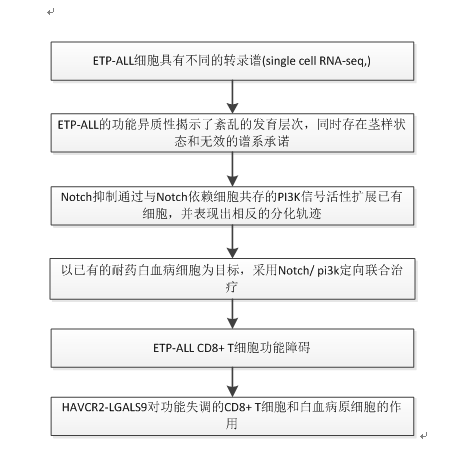
一、难治性ETP-ALL细胞表达与正常淋巴细胞和造血祖细胞相关的转录因子
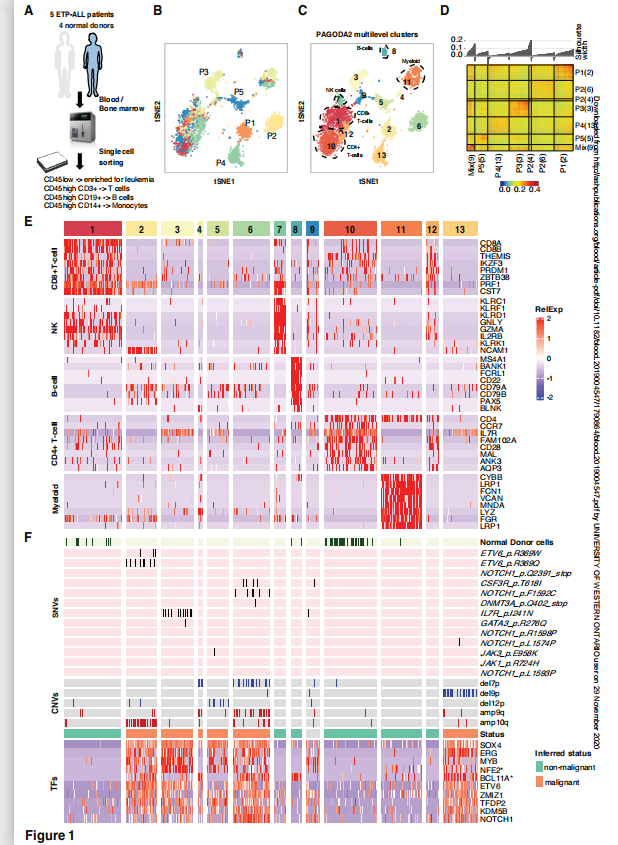
A-D通过进行PAGODA2聚类和t随机邻居嵌入(t-SNE)可视化,发现13个不同的细胞簇(图1B, C)。5个簇(簇1,簇7,簇8,簇10和簇11)在不同的患者和正常供者之间是常见的,而其余的大多数簇是针对个别患者特异性的,显示出高度的内相关性(图1A, C, D)。
由于clusters 2、3、4、5、6和13是患者特有的,在正常供体中看不到(图1B、C),假设这些是恶性细胞,因为患者特异性的恶性细胞聚集是典型的单细胞分析,可能是因为存在特定于单个肿瘤的遗传/表观遗传改变。使用互补的方法来明确区分恶性和非恶性免疫细胞(t细胞、b细胞和单核细胞)(图1F)。SNVs和CNVs与临床测序结果一致,仅在假定的恶性细胞群中检测到,值得注意的是,没有检测到等位基因频率为40%的SNVs和低水平表达的基因中的SNVs,可能是由于退出事件。
二、ETP-ALL表现出错乱的发育层次,谱系承诺无效,同时存在茎样状态
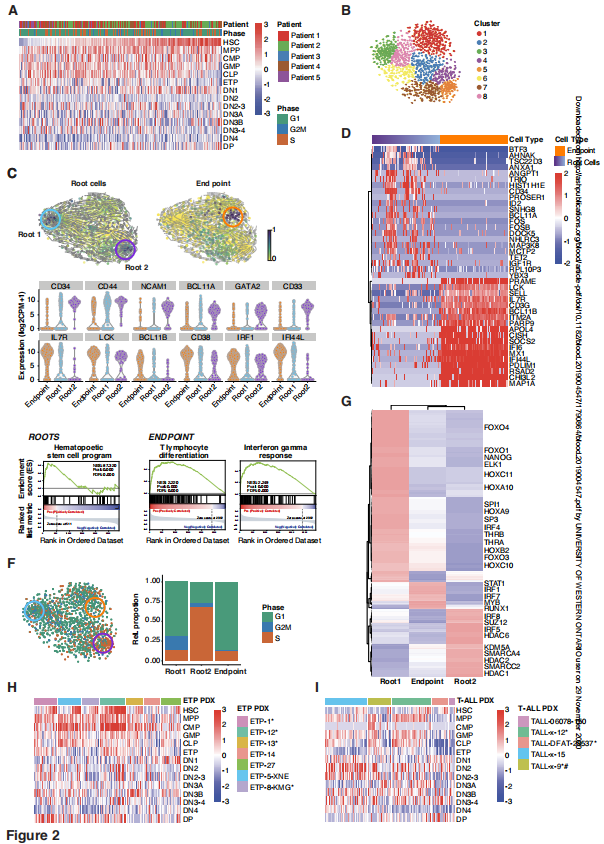
为了进一步探索单个细胞内的谱系失真,寻找表达HSC(造血干细胞),MPP(多能祖),CMP(常见的髓系祖)、GMP (granulocyte-monocyte祖)和CLP(常见的淋巴祖)早期家族signatures,按照BLUEPRINT consortium,以及胸腺前体signatures(ETP, DN1, DN2、DN3 DN4和DP), ImmGen定义的研究。大多数白血病细胞表现出高表达的DN1 signatures,与他们的临床注释ETP-ALL一致.
尽管干细胞和谱系标记物在几乎所有被研究的细胞中都有共表达,但仍可能有一种细胞亚群具有更强的干细胞样特征。为此,我们首先使用t-SNE根据与造血干细胞和祖细胞程序相关的基因表达对所有白血病细胞进行聚类。
然后,我们利用RNA速度,基于未剪接/剪接转录本的水平,沿着成熟轨迹识别细胞。t-SNE维度上的速度投影显示了两种不成熟的根状态和一种单一的端点状态(图2C)。这些状态分为不同的无监督集群,由来自所有患者的细胞组成,表明它们是由独立的转录回路控制的。
E.两种root states 都富含与造血干细胞相关的基因,如CD34, CD44, NCAM1, BCL11A和GATA2. 相反,终点状态的特征是与t细胞分化相关的基因的表达,如IL7R, LCK, BCL11B和CD387,通常在 stem-like root 细胞中低水平表达.终点细胞也表现出强烈的免疫调节信号富集,表现为IRF1、IFITM3和IFI44L的表达.
细胞周期分析表明,root 1细胞不循环,而root 2细胞富集于S期细胞(图2F, S14)。如果这些根状态反映了不同的类茎状态,那么应该有不同的转录调控因子驱动着每个状态。因此,我们利用SCENIC24识别出这两种根状态中最显著的转录调节因子(转录因子及其靶基因)
所有这些ETP-ALL模型也显示了在同一细胞中多个前体信号和更成熟的胸腺细胞信号的共表达,不依赖于Notch突变状态(图2H).
虽然成熟T-ALL细胞也同时表现出HSC和CLP signatures,同时表现出更成熟的胸腺signatures,但髓系程序(GMP, CMP)的激活比ETP-ALL PDX模型中少见(图2I)。
三、干细胞样状态的特征是通过Notch或PI3K来反对致癌信号
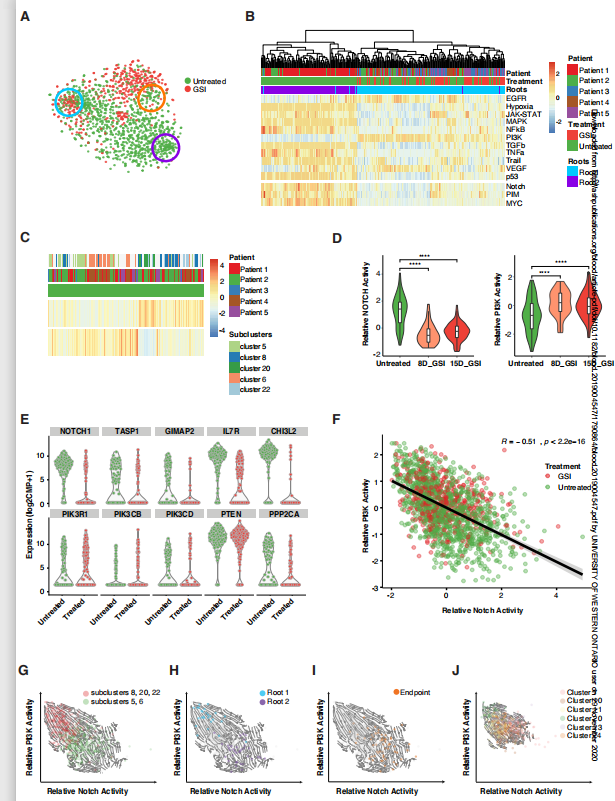
假设茎状种群的持久性存在可能是Notch抑制剂对复发/难治性切口突变T-ALL患者疗效有限的原因。事实上,Notch抑制消除了循环的茎样根细胞(root 2),而非循环的根细胞(root 1)在Notch抑制剂处理后仍然存在(图3A)。
该分析表明,PI3K激活是Notch信号通路中最抗相关的通路,PI3K激活在非循环根细胞中强烈富集,而在循环根细胞中几乎不存在.
有趣的是,PI3K信号活性高而Notch信号活性低的细胞已经在预处理前出现(图3C), PI3K活性随着处理的增加而增加,而Notch活性则下降(图3D, E, F, S14;表S14).
G.进一步分析这些亚群的转录动力学发现,在未经处理的细胞中有两种状态,具有较高的Notch活性或较高的PI3K活性,通过RNA速度,拮抗分化轨迹均指向与中间PI3K和Notch活性共享的状态(图3G)。
H-I. 茎样根细胞分为Notchactive和PI3K活性群(图3H,相关系数R = -0.7, p = 2.2e-16),而端点态细胞在界面处富集,而Notch与PI3K活性无相关性(图3I, R = -0.28, p = 1.2e-07)。
J. 在治疗过程中,PI3K活性较高的亚簇占优势,但它们向界面中间端点状态的分化轨迹没有任何变化(图3J)。
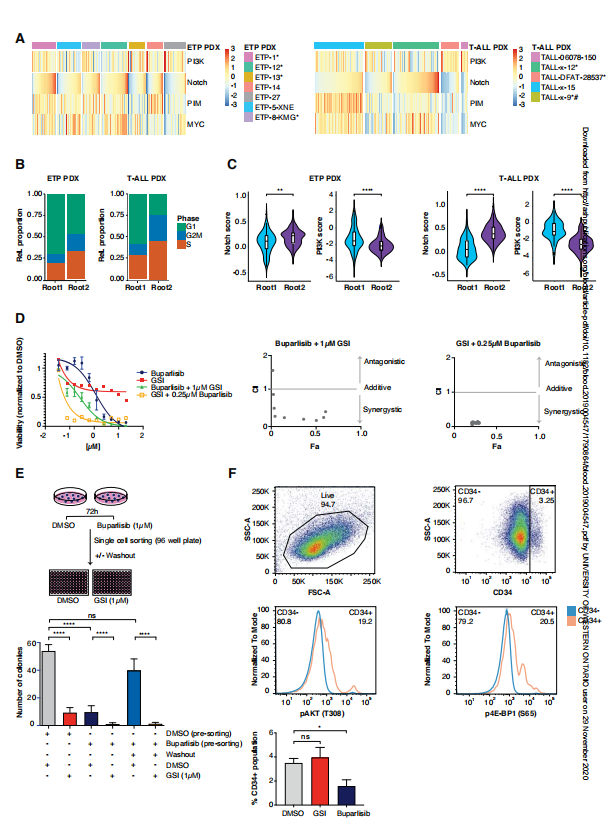
到目前为止,分析主要集中在具有NOTCH1突变的复发/难治性ETP-ALL患者,接下来,我们研究是否可以在PDX模型中检测到分化的Notch和PI3K状态,该模型是在治疗前的诊断时获得的样本建立的。
A.在7个ETP-ALL PDXs和5个成熟T-ALL PDXs中(见表2),具有高Notch表达特征的细胞PI3K激活特征较低,反之亦然。
B-C.在两种根状态下,我们发现Notch信号和PI3K信号的激活信号存在差异,低循环状态的根细胞表达高PI3K激活信号,高循环状态的根细胞表达更高的Notch激活信号。这些发现独立于NOTCH1突变或PTEN缺失的存在,这与作为这些细胞状态基础的转录重组是一致的.
D. 结合靶向Notch和PI3K信号通路可能同时靶向干细胞样状态。为了验证这一假设,我们首先在体外证实了Notch抑制(GSI)和PI3K抑制(Buparlisib)联合在T-ALL细胞系中的协同效应(图4D, S19A-C)。
E. 我们推断这一群体可能反映了先前存在的PI3K依赖性细胞。使用单细胞克隆,我们确认了已经存在的gsi耐受细胞群体(图4E)。这些细胞高度依赖PI3K信号通路,在GSI存在下单细胞克隆之前,通过Buparlisib预处理几乎完全消除了这些细胞(图4E).
F.在未处理的KOPT-K1细胞中检测到一小群CD34+细胞(图4F, S19D),约20%的细胞通过磷酸化流分析显示PI3K激活,而CD34- KOPT-K1细胞这些标记物呈阴性。此外,当GSI处理KOPT-K1细胞时,该群体扩大,而PI3K抑制具有相反的作用(图4F).
四、白血病微环境中Galectin-9的HAVCR2相互作用导致的免疫逃避

ETP-ALL是否与免疫微环境中t细胞功能的改变有关。值得注意的是,与正常供体t细胞相比,白血病患者中内源性t细胞的t细胞受体(TCR)库偏向于使用 oligoclonal TCR(图5A)。
D.为了确定CD8+ t细胞分化状态,我们使用monocle 2进行了非监督伪时间分析,并确定了六种t细胞状态沿着共同的轨迹发展(图5B)。状态1主要由来自正常供者的CD8+ t细胞组成,这些细胞表达幼稚CD8+ t细胞的标志物(CCR7, IL7R, NELL2, SELL, TCF7)(图5C, D).
相比之下,状态5和状态6主要包含患者CD8+ t细胞,CD8+ t细胞表现出t细胞耗竭标志物(PDCD1、TIGIT、LAG3、HAVCR2、CD244)的表达增加,提示这些细胞存在功能障碍(图5D)。RNA速度分析证实了从状态5向功能更失调状态6的分化方向(图5E)。
为了确定衰竭的程度,我们分析了所有CD8+ t细胞的衰竭评分。高衰竭评分主要出现在ETP-ALL患者使用寡克隆TCR的细胞中,而高衰竭评分的CD8+ t细胞在正常供者中则不常见(图5F)。

B.为了确定哪些配体和受体可能与ETP-ALL中的t细胞功能障碍相关,我们测定了它们的表达水平,并计算了白血病细胞中CD8+ t细胞表达的抑制性受体及其各自配体之间的相互作用scores70(图6A, B)。发现HAVCR2 (TIM-3)及其配体LGALS9 (Galectin-9)的相互作用得分最强,LGALS9在所有白血病细胞中普遍表达(图6B, S20A)。
C.ETP-ALL患者骨髓活检免疫组化(IHC)染色证实白血病原细胞上LGALS9表达,散在单核细胞上HAVCR2表达(图6C)。
D. 为了检验T-ALL细胞是否会引起t细胞功能障碍,我们首先通过流式细胞术证实了LGALS9蛋白在T-ALL细胞系中的表达(图6D, S21).
E. 然后,我们将来自正常供者的活化的CD8+ t细胞(含和不含T-ALL上清液(含LGALS9))培养三天。暴露于T-ALL上清液的CD8+ t细胞显示出主要的CD8+ t细胞效应分子GZMB (granzyme B)的下调,衰竭标志物HAVCR2和TIGIT的上调(图6E),而这一作用被一种中和性抗lgals9抗体所消除(图S22)。
【总结】
该研究明确了可表征T-ALL的信号程序、细胞可塑性和免疫程序之间复杂的相互作用,并阐明了肿瘤异质性的多维性。在这种情况下,针对不同致癌状态和免疫生态系统的联合治疗似乎最有希望通过共存的转录程序成功消除免疫逃逸的肿瘤细胞。






