癌症治疗福音——41.444分的m6A修饰circRNA靶点
Circular RNA ( circRNAs )是一类缺乏5′cap结构和poly ( A )尾的闭环非编码RNA。N6-甲基腺苷(m6A)修饰可增强结合mRNA/long noncoding RNAs(lncRNAs)转化为microRNAs(miRNAs)的能力。结直肠癌(colorectal cancer , CRC)是中国女性癌症死亡的第二大原因,死亡人数仅次于肺癌,但是机制尚不清楚。本研究的目的是研究circALG1是否能够成为CRC的潜在治疗靶点和预后标志。结果证实:m6A修饰可增强circALG1与miR-342-5p的结合能力,促进circALG1的ceRNA功能,circALG1可能成为CRC的潜在治疗靶点和预后标志。本研究于2022年3月发表在《Molecular Cancer》IF:41.444期刊上。
技术路线:
主要研究结果:
1、 circALG1在CRC中高表达
circRNA的芯片分析结果显示,353个circRNAs在CRC患者癌组织中的表达水平明显高于癌旁组织(图1A),54个circRNAs在CRC患者外周血中的表达水平高于健康人(图1B)。通过分析circRNAs在结直肠癌组织和外周血中的高表达,研究鉴定了2个circRNA,即circALG1和circCOL6A3 (图1C)。然后使用在线网站SRAMP ( http://www.cuilab.cn/sramp)发现这两个circRNAs都可以经历这种修饰。由于circALG1在CRC患者的组织和外周血中的整体表达水平高于circCOL6A3,所以,选择了circALG1作为后续研究的重点。此外,作者利用基因表达谱(Gene Expression Omnibus,GEO)中的GSE126094数据集进行验证,发现在CRC癌组织中circALG1的表达水平明显高于癌旁组织(图1D)。从CRC患者、术前及术后收集40对癌组织及癌旁组织,20例CRC患者术后1周血标本,15例健康人外周血标本进行qRT-PCR实验。结果显示,circALG1在CRC患者的癌组织(图1E)和外周血(图1F)中均高表达。更有趣的是,CRC患者术后1周外周血中circALG1的表达水平显著降低(图1G)。受试者工作特征曲线(ROC)分析显示,circALG1在CRC患者癌组织及癌旁组织(图1H)、CRC患者及健康体检者外周血(图1I)、CRC患者术前及术后外周血(图1J)中的表达水平均有较好的区分。

图1 circRNA表达谱分析显示,circALG1在CRC中高表达。
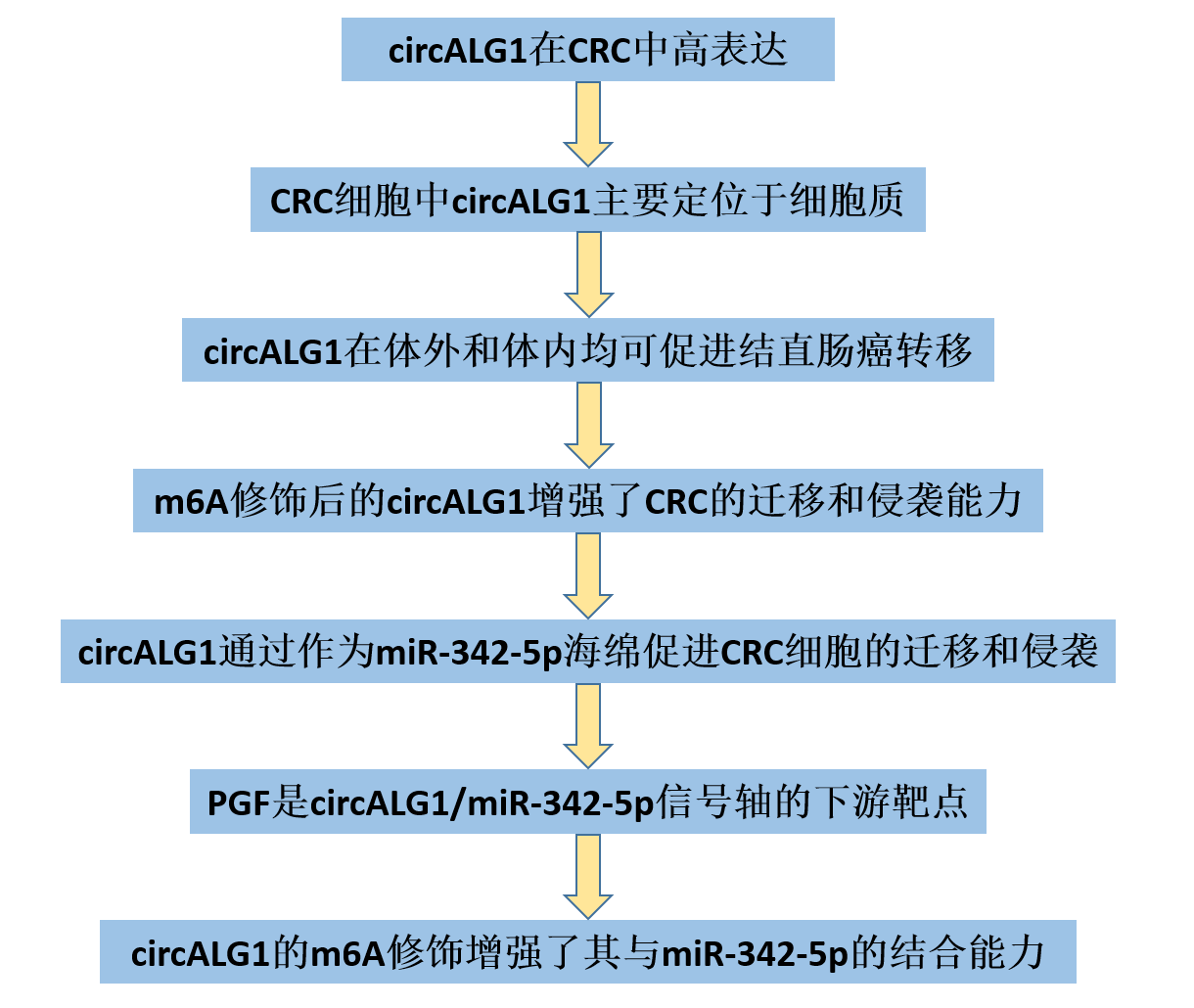
2、 CRC细胞中circALG1的特征
针对circALG1的成环位点设计了聚合引物和发散引物。琼脂糖凝胶电泳显示,聚合引物在cDNA和gDNA中均扩增出条带,而发散引物只在cDNA中扩增出条带。进一步的cDNA测序发现有成环存在(图2A),表明circALG1具有循环性。与亲本基因ALG1 mRNA相比,circALG1对RNase R消化表现出抵抗性(图2B)。经放线菌素处理后,circALG1在细胞中的降解速率明显慢于ALG1 mRNA (图2C),说明circALG1是稳定的。核质分离实验显示,circALG1主要定位于细胞质(图2D)。同样的结果也来自于circALG1 FISH (图2E)。
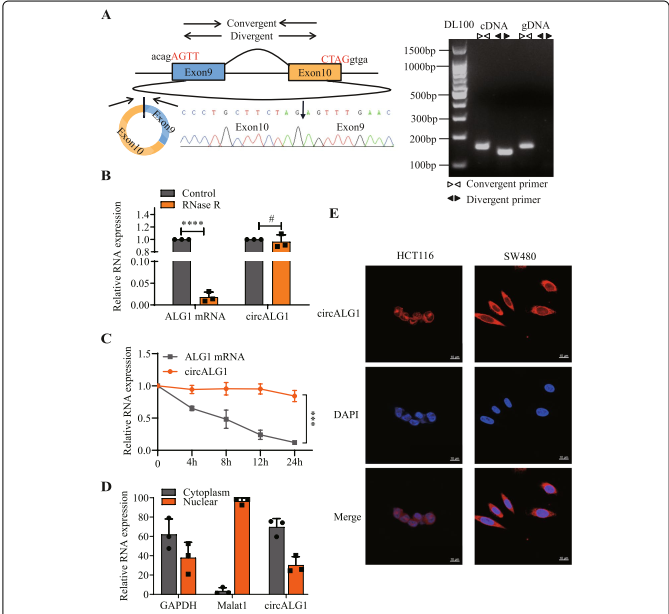
图2 CRC细胞中circALG1的特性。
3、 circALG1在体外和体内均可促进结直肠癌转移
研究检测了circALG1在5种细胞系(FHC、HT29、HCT116、SW480和SW620)中的表达水平。与FHC细胞相比,circALG1在HT29和HCT116细胞中表达较低,在SW480和SW620细胞中表达较高。选取circALG1表达量最低的HCT116细胞和circALG1表达量最高的SW480细胞进行后续功能实验。研究构建了稳定过表达circALG1的HCT116细胞,其过表达效率见。作者设计了3个针对circALG1干扰的siRNA,敲低效率见。利用si-3序列构建干扰circALG1表达的慢病毒,并构建稳定转染细胞系。Transwell实验结果显示,过表达circALG1后HCT116细胞的迁移和侵袭能力增强(图3A),沉默circALG1后SW480细胞的迁移和侵袭能力减弱(图3B)。
然后,检测亲本线性ALG1是否会影响circALG1的功能,q RT-PCR结果显示,circALG1的过表达和干扰对线性ALG1 m RNA的表达没有影响。还构建了ALG1过表达质粒并转染HCT116和SW480细胞。作者设计了3个针对ALG1干扰的siRNA,其敲除效率如附图2B所示。在HCT116裸鼠转移瘤模型中,circALG1过表达组肝、肺转移数目较高(图3C);在SW480裸鼠转移瘤模型中,干扰circALG1的表达减少了肝、肺转移瘤的数量(图3D)。这些结果表明,circALG1与CRC转移密切相关。
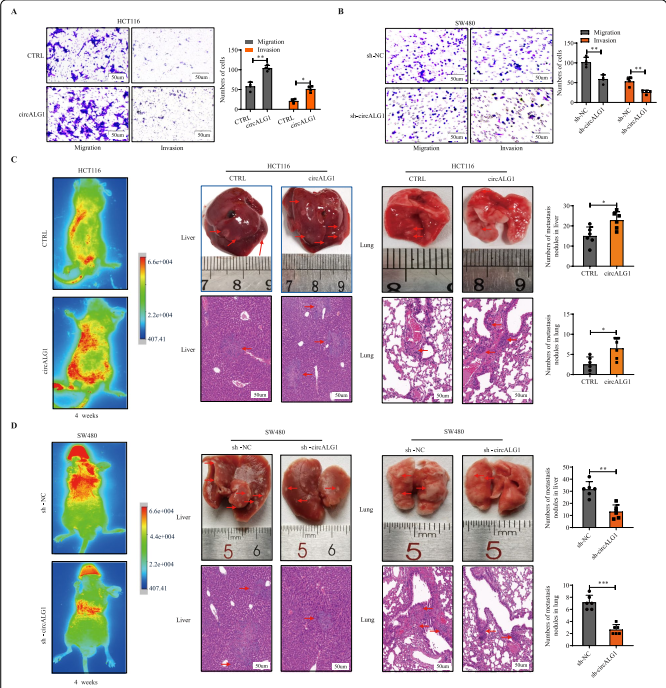
图3 circALG1在体内促进CRC转移。
4、 m6A修饰后的circALG1增强了CRC的迁移和侵袭能力
使用在线网站SRAMP,发现circALG1极有可能进行m6A修改;此外,在甲基化RNA免疫沉淀( MeRIP )实验中还观察到了circALG1的富集,证实了circALG1确实发生了m6A修饰(图4A)。作者研究了circALG1的m6A修饰水平对circALG1功能的影响:将circALG1中2个可能的m6A修饰位点突变后,构建野生型和突变型质粒(图4B)。用等量的野生型和突变型质粒转染circALG1稳定沉默的SW480细胞株。qRT-PCR分析显示,不同组别之间的circALG1表达水平无差异(图4C);突变1个位点后,m6A修饰的circALG1细胞内水平降低,而突变2个位点后,细胞内均未见m6A修饰的circALG1(图4D)。功能实验表明,circALG1突变减少了肿瘤细胞的迁移和侵袭(图4E)。这些结果表明,circALG1 m6A修饰水平与CRC细胞的迁移和侵袭能力呈正相关。
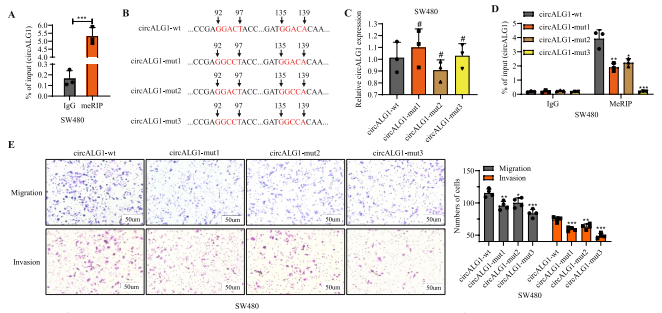
图4 m6A修饰的circALG1促进SW480细胞的CRC转移。
5、 circALG1通过作为miR‑342‑5p海绵促进CRC细胞的迁移和侵袭
circRNA通过多种机制发挥作用。最常见的机制是ceRNA;即通过竞争性结合miRNA,解除miRNA对靶基因mRNAs的抑制作用,这一过程在细胞质中进行。之前的研究显示,circALG1主要定位于胞浆内,表明circALG1可能通过ce RNA介导CRC转移。作者使用Arraystar miRNA靶预测软件( Arraystar,Rockville,MD,USA )对miRNA应答元件( MREs )进行预测,得到5个最可能与circ ALG1结合的miRNA:miR-302d-3p、miR-342-5p、miR-372-3p、miR-483-5p和miR-520d-3p。
为了研究这5个miRNA与circALG1的相互作用,进行了如下实验:构建含有circALG1野生型序列的SV40-firefly_Luciferase-MCS质粒,与miRNA模拟物和Renilla荧光素酶质粒共转染。miR-342-5p组荧光活性减弱(图5A),提示miR-342-5p可能与circALG1结合。然后检测miR-342-5p在CRC组织中的表达水平,发现miR-342-5p在CRC组织中低表达。根据预测的circALG1与miR-342-5p的结合位点,设计了含有circALG1突变序列(图5B左)的SV40 -萤火虫_荧光素酶MCS质粒。双荧光素酶报告基因检测结果显示,转染含有circALG1野生型序列的萤火虫荧光素酶质粒后,miR-342-5p模拟物显著降低了荧光强度,而miR-342-5p抑制剂增强了荧光强度。与含有circALG1突变序列的质粒( 图 5B,右)相比,miR-342-5p与circALG1特异性结合。
在circALG1的RAP检测中,作者也观察到miR-342-5p富集(图5C)。功能实验显示,在HCT116细胞中,miR-342-5p过表达逆转了circALG1过表达诱导的迁移侵袭能力增强(图5D),而在SW480细胞中,miR-342-5p抑制逆转了circALG1沉默诱导的迁移侵袭能力降低(图5E)。这些说明circALG1通过海绵吸附miR-342-5p促进CRC细胞的侵袭和迁移。
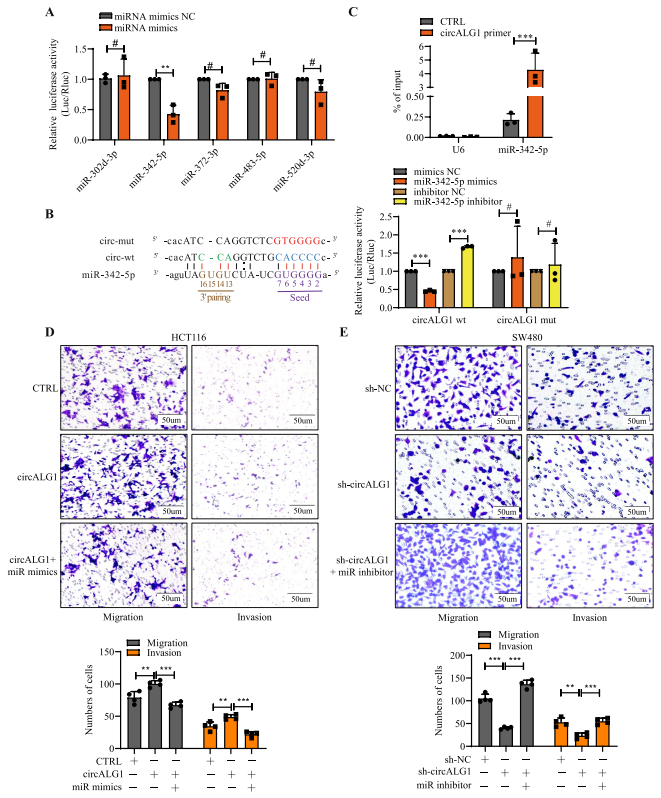
图5 circALG1通过miR-342-5p促进CRC的迁移和侵袭。
6、 PGF是circALG1/miR‑342‑5p信号轴的下游靶点
为了确定circALG1 / miR-342-5p信号轴的下游靶基因,作者从circALG1沉默前后的SW480细胞中提取RNA进行RNA测序。共获得76个表达量> 2倍上调的基因。对这76个基因的GO分析也显示它们富集在与转移相关的通路中。根据TargetScan网站和RNA测序预测,共有7个基因被鉴定为miR-342 - 5p下游靶基因(图6A )。通过检索生物信息学网站UALCAN ( http://ualcan. path.uab.edu / ),作者发现只有PGF在CRC中高表达,提示预后不良(图6B-C,PGF在本研究收集的CRC标本中也高表达)。
相关性分析显示,CRC组织中PGF的表达水平与miR-342-5p( R=-0.547 , p < 0.001 )呈负相关(图6E)。双荧光素酶报告基因检测结果表明,转染含有PGF3’UTR野生型序列的萤火虫荧光素酶质粒后,miR-342-5p模拟物降低了荧光素酶活性,而miR-342-5p抑制剂提高了荧光素酶活性。转染含有PGF3′UTR突变序列的萤火虫荧光素酶质粒后未观察到类似现象,说明miR-342 - 5p能特异性结合PGF3′UTR,抑制其表达(图6F)。在本研究中,PGF过表达显著上调CRC细胞中ERK的磷酸化水平,降低和增加上皮间质转化( epithelial-mesenchymal transition,EMT )相关标志物E-cadherin和vimentin的表达;PGF沉默后观察到相反的结果(图6I)。因此,PGF通过调控EMT影响CRC转移。
在CRC标本中,作者也观察到PGF高表达,p-ERK水平和vimentin表达增加,E-cadherin表达降低(图6L)。综上所述,PGF是circALG1/ miR-342-5p信号轴的下游靶基因。
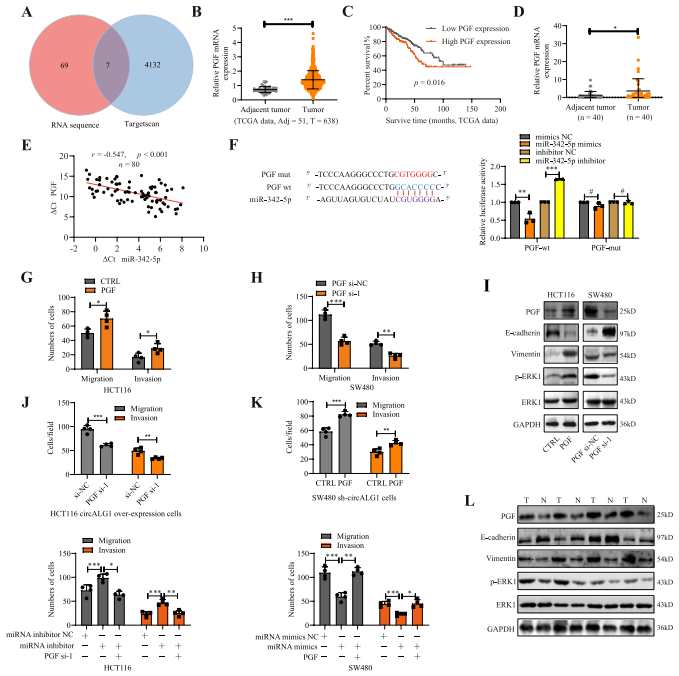
图6 PGF是circALG1/ miR-342-5p信号轴的下游靶点。
7、circALG1的m6A修饰增强了其与miR‑342‑5p的结合能力
研究利用稳定沉默了circALG1的SW480细胞,转染构建的野生型和m6A修饰的突变体circALG1质粒,进行了circALG1的RAP检测。结果显示,circALG1 m6A修饰的减少,减弱了其与miR-342-5p的结合(图7A)。作者还基于野生型和m6A修饰的突变体circALG1序列构建了相应的萤火虫荧光素酶质粒。双荧光素酶报告基因实验表明,circALG1 m6A修饰位点的突变增强了荧光素酶的表达,且当m6A修饰位点同时突变时,荧光强度最高。这些结果表明miR-342-5p mimics对含有m6A修饰位点突变序列的circALG1萤火虫荧光素酶质粒表达的抑制作用减弱,说明m6A修饰调控了circALG1与miR-342-5p的结合(图7B)。
然后研究了m6A修饰影响circALG1与miR-342-5p结合的具体机制。在下调蛋白中也观察到YTHDF1的存在(图7C)。此外,在YTHDF1 RIP实验中检测到circALG1的富集(图7D)。当circALG1 m6A修饰位点发生突变时,YTHDF1 RIP检测结果显示,富集的circALG1显著降低,说明circALG1与YTHDF1的结合依赖于m6A修饰(图7E)。在含有circALG1-mut3序列的萤火虫荧光素酶质粒中,由于缺少m6A修饰位点,METTL3沉默后对荧光素酶活性没有影响(图7J)。这一结果也提示m6A修饰可以增强circALG1与miR-342-5p的结合能力。
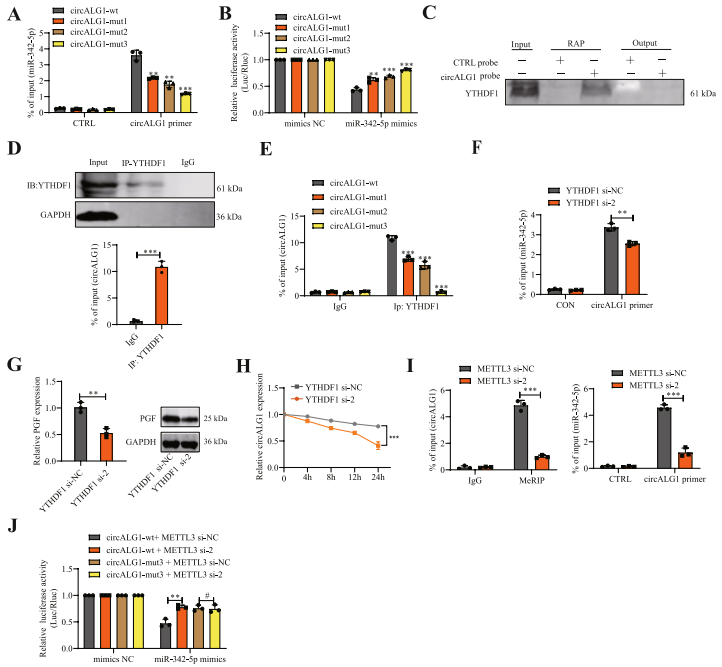
图7 circALG1的m6A修饰增强了其与miR-342-5p的结合能力
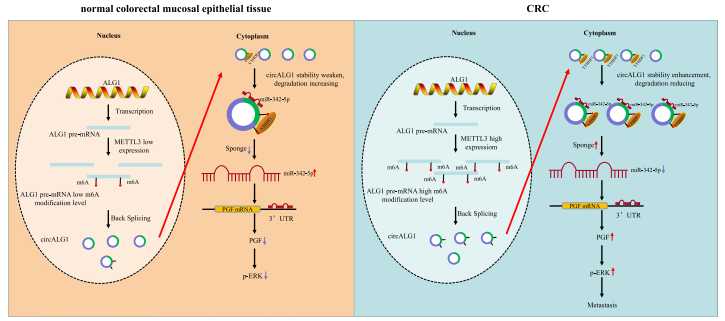
图8 研究机制图
结论
本研究首先通过人circRNA芯片技术和生物信息学分析发现circALG1 circALG1通过竞争性结合miR-342-5p,解除miR-342-5p对PGF mRNA表达的抑制作用,促进PGF表达,导致CRC侵袭性增强。YTHDF1在CRC中的高表达增加了ALG1 pre-mRNA的m6A修饰水平,进而增加了circALG1的m6A修饰水平。circALG1的m6A修饰增强其与miR-342-5p的结合能力,并通过增强其稳定性促进circALG1的ceRNA作用。进一步促进了其ceRNA机制。这些实验结果提示,circALG1可作为早期诊断和抗肿瘤转移治疗的潜在靶点。
参考文献:
Lin, C., Ma, M., Zhang, Y. et al. The N6-methyladenosine modification of circALG1 promotes the metastasis of colorectal cancer mediated by the miR-342-5p/PGF signalling pathway. Mol Cancer 21, 80 (2022). https://doi.org/10.1186/s12943-022-01560-6






