BMP4通过Ube2s和Chmp4b介导的染色体稳定性保护mESCs的发育潜力
化学定义培养基被广泛用于培养小鼠胚胎干细胞(mESCs),其中N2B27作为血清的替代品,GSK3β和MEK抑制剂(2i)有助于促进基态多能性。最近的研究表明,MEKi可能导致不可逆的缺陷,损害了mESCs的发育潜力。我们证明了在化学条件下骨形态发生蛋白(BMP)信号的缺乏是多能性受损的主要原因之一。机制上,BMP4激活BMP信号通路可通过调控下游靶点Ube2s和Chmp4b来维护mESCs的染色体完整性和增殖能力。BMP4具有明显的体内发育潜力和长期的多能性保存。BMP4驱动的多能性改善优于减弱MEK抑制。综上所述,我们的研究表明BMP信号的适当激活在调节功能多能性方面是必不可少的,揭示了BMP4应应用于无血清培养系统。本文于2022年8月发表于Protein & Cell (IF=15.328)上
技术路线:

主要研究结果:
(1) 与S/2i-mESC相比,N/2i-mESCs具有有限的多能性
我们首先从携带Oct4-ΔPE-EGFP (OG2)报告子的囊胚中衍生出传统血清条件下的mESC系。本研究的株系具有正常核型和高效力(图1A-D)。将三个细胞系分别适应S/2i和N/2i条件15天,并与S条件下相同传代后的原细胞系进行比较(图1A)。在三种条件下培养的mESCs都表现出紧密填充和圆顶的菌落,并显示出显著的Oct4-EGFP的一致维持(图1B)。然而,N/2i-mESCs的菌落形态明显变小,表明增殖能力受损(图1B)。这些N/2i-mESC表现出严重的非整倍性,并随着培养时间的延长而恶化(图1C)。相比之下,在S/2i-mESCs中未发现这些异常,提示无血清条件下缺乏的一些因素可能是导致这些缺陷的原因。与相应的S-mESCs相比,所有S/2i-mESCs在皮肤和种系中的嵌合性显著增强(图1D-F)。四倍体胚胎互补(TEC)试验进一步证实,N/2i-mESCs在体内的发育严重受损,因为无法产生全ESC小鼠(图1G)。综上所述,我们发现S/2i-mESCs具有非常好的发育潜力,而在N/2i条件下,由2i驱动的功能改善被削弱,N/2i-mESCs表现出染色体不稳定、增殖紊乱和发育潜力受限。
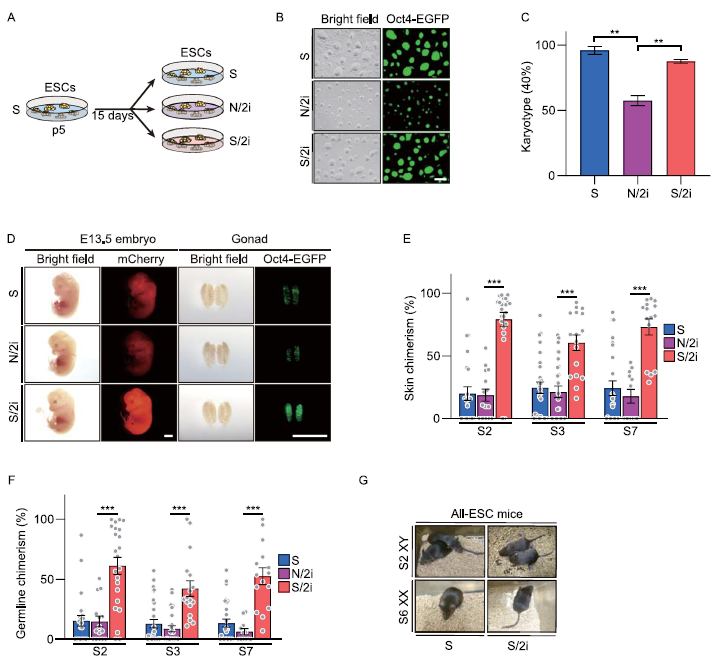
图1:与N/2i-mESCs相比,S/2i-mESCs具有更好的发育潜力。
(2) N/2i条件下失活的TGFβ、BMP、AKT信号通路在S/2i条件下得到改善
为了揭示N/2i-mESCs与S/2i-mESCs相比发育潜力受限的潜在分子机制,我们进行了RNA测序。主成分分析(PCA)表明N/2imESCs的转录组与S/2i-mESCs的转录组有很大的不同(图2A)。差异表达基因(DEGs)分析显示,男性N/2i-mESCs与男性S/2i-mESCs相比,有3233个基因发生显著变化(图2B)。干细胞分化、细胞周期、干细胞维持和胚胎发育等过程主要在N/2i-mESCs中被下调,说明N/2i-和S/2i-mESCs在许多方面是不同的(图2C)。我们对多个关键信号通路进行了基因集富集分析(GSEA)(图2D)。通过基因本体论分析,我们分析了两性S/2i mESCs中特异上调的1581个基因(图2E),发现TGFβ和PI3K-Akt信号通路明显富集(图2F)。通过motif调用分析发现,这些上调的基因中有许多是Klf和Smad家族成员的靶点(图2G)。上述三个信号通路的代表性基因的表达确实在N/2i-mESCs中下调,在S/2imESCs中恢复(图2H)。综合来看,N/2i-mESCs中tgf-β、BMP和AKT信号通路被灭活。作为对比,这些通路在S/2i-mESCs中被恢复,这可能是观察到的发育改善的原因(图1D-G)。
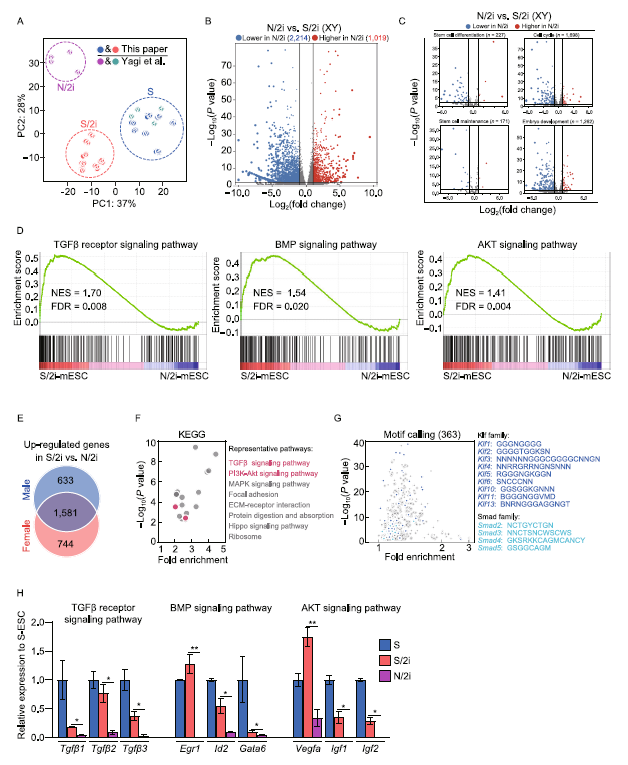
图2:S/2i条件下TGFβ、BMP、AKT信号通路的失活得到改善。
(3) BMP4保护了染色体的完整性,并保留了mESCs的发育潜力
我们对已被证明可分别激活TGFβ、BMP或AKT信号通路的生长因子进行了小范围筛选。将mESC在添加特异性生长因子的N/2i条件下培养15天,用于分析和比较(图3A)。BMP4的效果最好,其次是BMP7和BMP2,说明在N/2i条件下,BMP信号通路对维持染色体完整性至关重要(图3B)。BMP信号的重新激活可以进一步恢复N/2i-mESCs的增殖能力;受损的细胞周期得到恢复,停留在G1期的细胞减少,细胞周期持续时间缩短(补充图未展示)。我们随后研究了BMP信号的激活是否能从功能上提高N/2i-mESCs的发育潜力。在N/2i mESCs中添加BMP4可显著提高皮肤中的嵌合率180%(图3C,E)和种系中的嵌合率150%(图3D,E)。这种改善在所有测试的mESC系中都是一致的(图3F,G)。随着BMP4的补充,异常高的N/2i-mESCs的吸收率显著降低(补充图未展示)。最后,我们进行了TEC试验,以测试这些mESC的自主发育潜力。与N/2i-mESC形成对比,N/2i+BMP-mESC可以有效地生成活的all-ESC小鼠(图3H)。综上所述,BMP4的激活可以保留mESCs的发育潜力,并维护其染色体完整性。
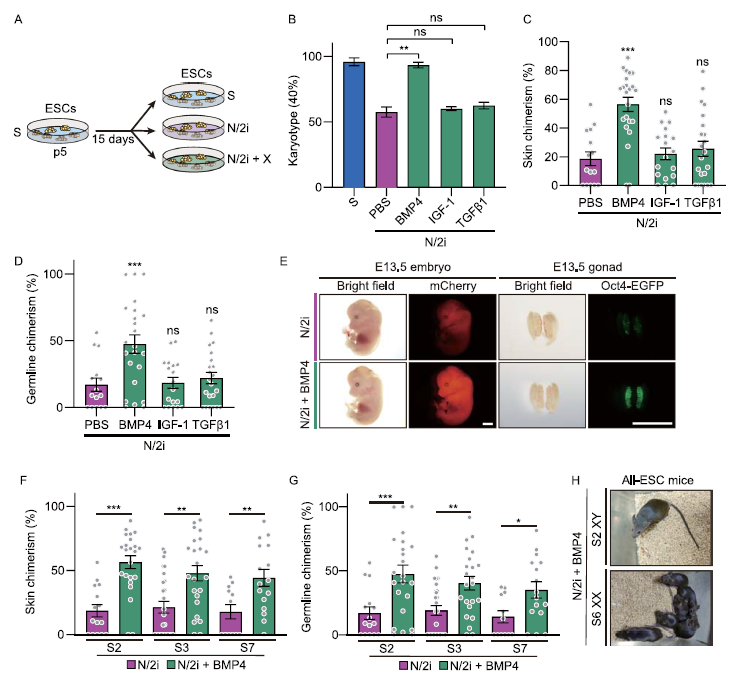
图3:BMP4保护了染色体的完整性,并保留了mESCs的发育潜力。
(4) Ube2s和Chmp4b对BMP4介导的染色体完整性维护和多能性维护至关重要
N/2imESCs中相对于S/2i-mESCs中失调的染色体分离和细胞周期的相关基因可能是BMP信号通路的潜在下游靶点(图4A,B)。Timp2等5个基因仅在N/2i-mESCs中异常表达,补充BMP4可以恢复这些基因,其中Ube2s和Chmp4b最为明显(图4C)。Ube2s和Chmp4b与调控染色体分离和细胞周期密切相关(图4A,B)。我们通过shRNA介导的基因敲除在N/2i+BMP4条件下生成Ube2s-和Chmp4b缺陷的mESCs,并通过免疫印迹和RT-qPCR分析验证这些基因的敲除(图4D)。shUbe2s- or shChmp4b-mESCs表现出严重的非整倍性和DNA损伤。这些缺陷在含有BMP4的条件下不能被修复,表明Ube2s和Chmp4b是BMP4的关键靶点(图4E,F)。ishUbe2s-或ishChmp4b-mESCs产生的畸胎瘤比对照mESCs产生的畸胎瘤小得多(图4G),说明这些mESCs的增殖受到严重损害。与具有明显三种层分化细胞的对照组畸胎瘤相比,这些微小的畸胎瘤分化较差(图4G),说明Ube2s或Chmp4b的短期敲除足以引起非整倍体,从而进一步破坏mESCs的分化能力(图4E)。在嵌合试验中应用ishUbe2s-mESCs或ishChmp4b-mESCs作为供体细胞后,只能获得少量嵌合胚胎,并且这些胚胎在皮肤和性腺中分别呈现出较低的mCherry+和Oct4-EGFP+细胞比例(图4H,I)。我们生成了Ube2s-和Chmp4b过表达的N/2i-mESC并进行了分析(图4J)。这两种细胞系在N/2i条件下表现出较高的整倍体细胞比例和恢复的增殖能力(图4K)。Ube2s过表达的N/2i-mESCs在体内发育潜力增强,吸收速率降低,而Chmp4b过表达的影响相对适中(图4L,M)。综上所述,Ube2s和Chmp4b是BMP4的关键下游靶点,它们对BMP4介导的染色体完整性保护,正常增殖能力和发育潜能的维持至关重要。
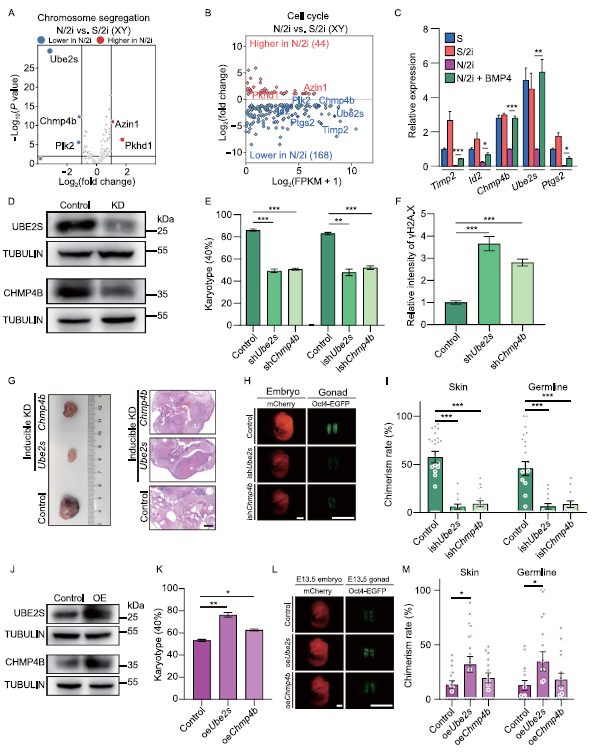
图4:Ube2s和Chmp4b对BMP4介导的染色体完整性和多能性维护至关重要。
(5) BMP4可恢复N/2i-mESCs的转录组失调,并长期保持其多能性
我们发现N/2i+BMP4条件可以在较长培养时间下保持mESCs的发育潜力。N/2i+BMP-mESC在培养55天后产生的嵌合胚的嵌合率甚至高于仅培养15天的N/2i-mESC(图5A)。这种多能性保存对mESC的种系传递能力非常重要,因为长时间培养的N/2i-mESC产生的嵌合胚胎几乎失去了性腺中的Oct4-EGFP信号(图5A)。我们通过RNA-Seq分析BMP4对转录组的影响。PCA和分层聚类图表明,N/2i+BMP4-mESCs的转录组与N/2i-mESCs的转录组差异很大,与血清条件下的转录组(S-和S/2imESCs)相似(图5B)。许多在N/2i-mESCs中异常下调的多能性关键基因只有在BMP4补充的条件下才能成功恢复(图2C)。DEG分析进一步显示,在N/2i条件下,受BMP4影响的1975个显著变化基因中,有1633个基因上调(图5C)。1633个上调基因的KEGG通路上的基因本论显示,TGFβ和PI3K-Akt信号通路明显富集,通过motif调用分析,这些基因中有许多是Klf和Smad家族成员的下游靶点(图5D,E)。这一发现与在S/2i-mESCs和N/2i-mESCs中的结果相似(图2F,G),进一步证实了BMP4在血清系统中的关键作用。GSEA研究表明,N/2i-mESCs中受损的tgf-β、BMP和AKT信号通路在BMP4补充后显著恢复(图2D,5F)。综上所述,BMP4在化学定义的条件下很大程度上恢复了关键基因和信号通路的失调,并可以在长期培养中维持mESCs的增强发育潜能。
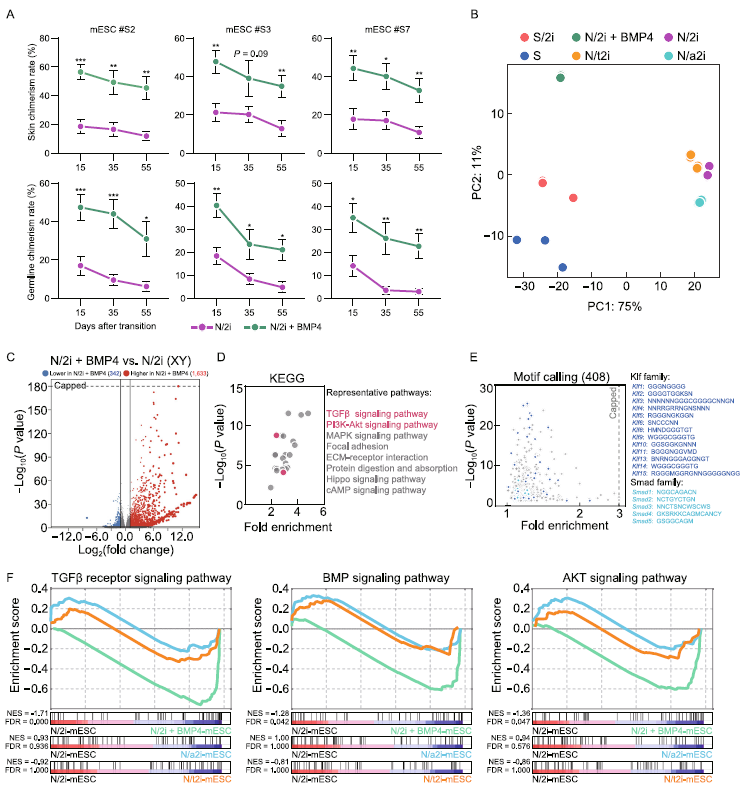
图5:BMP4可恢复N/2i-mESCs的转录组失调,并长期保持其多能性。
(6) 与N/a2i-和N/t2i-mESCs相比,N/2i+BMP4-mESCs表现出明显的多能性特征
N/2i+BMP4-mESCs比N/2imESCs具有更强的发育潜力。将mESC系#S2分别适应N/2i+BMP4、N/a2i和N/t2i条件15天。在这三种无血清条件下培养的适应的mESCs均表现出一致的Oct4-EGFP维持。与N/a2i-mESCs或N/t2i-mESCs相比,N/2i+BMP4-mESCs在体内发育潜力最高(图6A,B)。免疫印迹和ELISA表明,BMP4几乎不影响ERK1/2的磷酸化(图6C,D)。全基因组亚硫酸氢盐测序(WGBS)表明BMP4对DNA甲基化恢复没有影响。S/2i、N/2i和N/2i+BMP4均导致mESCs中明显的全基因组低甲基化,而减弱MEK的抑制则维持亲本差异甲基化区域(DMRs)(图6E)。印迹控制区域(ICRs)甲基化在15天的培养条件转换后,所有组均未显示出很大的变化(图6F)。为了进一步了解N/2i+BMP4-、N/a2i-和N/tt2i-mESCs之间的转录差异,我们进行了RNA-seq分析。与N/2i+BMP4相比,N/a2i或N/t2i引起的基因表达变化相对温和(图5C)。N/2i-、N/a2i-和N/tt2i-mESCs表现出非常相似的转录组和相对不活跃的全局转录水平,这与N/2i+BMP-mESCs不同(图5B,6G,H)。减弱MEK的抑制并不能恢复mESCs中受损的tgf-β、BMP和AKT信号通路(图5F,6I,J)。综上所述,与N/a2i-和N/tt2i-mESCs相比,N/2i+BMP4-mESCs表现出更好的多能性,我们推荐在无血清体系下,N/2i+BMP4条件下mESCs的质量最好。
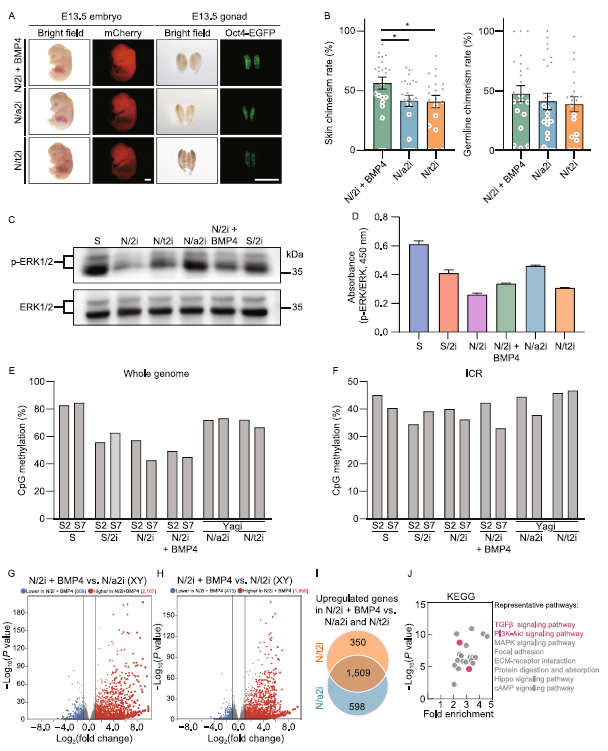
图6:与N/a2i-和N/t2i-mESCs相比,N/2i+BMP4-mESCs表现出明显的多能性特征。
结论:综上所述,BMP4在无血清条件下维持mESCs染色体完整性和多能性方面具有不可替代的作用。不断改进培养条件的组成部分将有助于增强多能性的维持,并对多能性调控有更多的了解,更重要的是,如何在基础研究和再生医学中进一步利用这一特性。
参考文献:
Wang, M., Zhao, K., Liu, M., Wang, M., Qiao, Z., Yi, S., Jiang, Y., Kou, X., Zhao, Y., Yin, J., Li, T., Wang, H., Jiang, C., Gao, S., & Chen, J. (2022). BMP4 preserves the developmental potential of mESCs through Ube2s- and Chmp4b-mediated chromosomal stability safeguarding. Protein & cell, 13(8), 580–601. https://doi.org/10.1007/s13238-021-00896-x.






