抗癌物紫杉醇的发育路,还看ALDH2的介导帮助
紫杉醇是治疗非小细胞肺癌的主要手段,其耐药性严重影响病患的生存。然而,其内在机制和潜在的反转策略还需要进一步探索。本研究探讨了ALDH2在非小细胞肺癌PTX的耐药中的功能作用、临床意义及异常调控机制。并通过一系列研究证明了ALDH2能帮助预测病患对PTX治疗的反应,ALDH2抑制在临床上是一种克服PTX耐药的有前途的策略。本研究于2022年4月发表在《Molecular Cancer》IF:41.444期刊上。
技术路线:

主要研究结果:
1. ALDH2在NSCLC细胞中被鉴定为紫杉醇耐药相关基因。
作者对NCI-H460和NCI-H460/PTX细胞进行了基因芯片分析,研究差异表达的基因。通路分析显示,与茎干和耐药相关的通路显著富集,表明在肺癌中,茎干的变化包含在PTX的耐药中(图1A)。接下来,作者进一步分析了NSCLC细胞和NSCLC/PTX细胞的生物学特征。克隆形成实验、球体形成实验和Transwell迁移实验表明NSCLC/PTX细胞的自我更新和迁移的能力比NSCLC细胞更强(图1B)。以上所有结果表明,NSCLC/PTX细胞的生物样特征增强。然后,作者分析了干细胞转录因子的蛋白表达。结果表明Sox2、Nanog和Oct4在NSCLC/PTX细胞中的表达比在NSCLC细胞中的更高(图1C)。
作者发现,在NSCLC/PTX细胞中ALDH活性明显高于NSCLC细胞(图1D)。在ALDH亚型中,ALDH2在NSCLC/PTX细胞中的蛋白表达高于NSCLC(图1E)。作者利用CCLE和GDSC数据库分析ALDH2与肺癌PTX之间的关系。结果表明,ALDH2的表达水平与对PTX的敏感性线性相关。ALDH2表达水平越高,细胞对PTX的敏感性越低(图1F)。作者测定了46例NSCLC患者PTX治疗后组织标本中ALDH2的表达水平,证实ALDH2与NSCLC患者PTX敏感性的关系。结果表明,与低ALDH2组相比,ALDH2蛋白高表达水平与整体存活率差显著相关(图1G)。综上所述,ALDH2在NSCLC细胞的成茎特性积累和PTX耐药过程中起重要作用。

图1非小细胞肺癌紫杉醇耐药相关基因ALDH2的鉴定
2. 当ALDH2在NSCLC细胞中受到药物抑制剂或基因干预时,PTX的疗效会发生改变。
作者敲低ALDH2后NSCLC/PTX细胞中PTX的疗效显著升高,而过表达ALDH2的NSCLC细胞中PTX的疗效显著降低(图2A-B)。作者敲除ALDH2后,NSCLC/PTX细胞迁移和自我更新能力明显下降(图2C)。过表达ALDH2后NSCLC细胞的迁移和自我更新能力明显增强(图2D)。ALDH2特异性抑制剂DZN在非细胞毒性浓度下显著抑制NSCLC/PTX细胞中ALDH活性。此外,在非细胞毒性浓度下,DZN联合PTX可显著增加NSCLC/PTX细胞对PTX的敏感性(图2E)。作者暂时沉默ALDH2和其他CSCs相关的ALDH亚型(ALDH1A1和ALDH3A1),并测定NSCLC/PTX细胞对PTX的敏感性。结果表明,其他ALDH亚型的瞬时沉默对PTX敏感性无显著影响。但当ALDH2瞬时沉默后,NSCLC/PTX细胞对PTX的敏感性明显增强(图2F)。综合以上结果,说明ALDH2是与PTX耐药相关的重要ALDH亚型。
研究通过慢病毒转染,分别建立了单独表达荧光素酶(空载体组)或荧光素酶+ ALDH2(ALDH2过表达组)的NCI-H1299和NCI-H460细胞。然后通过尾静脉注射Balb/c-nu小鼠细胞。结果表明,注射ALDH2过表达细胞的小鼠肺、脑和骨转移率均高于空载体组(图2G)。此外,体内数据显示,ALDH2过表达的NCI-H1299异种移植瘤对PTX的耐药性(抑制率39.36%)高于未过表达ALDH2的NCI-H1299异种移植瘤(抑制率53.19 %)(图2H)。同样,在NCIH460异种移植瘤模型中也得出了此结论。综合以上结果,说明ALDH2与体内PTX耐药有关。
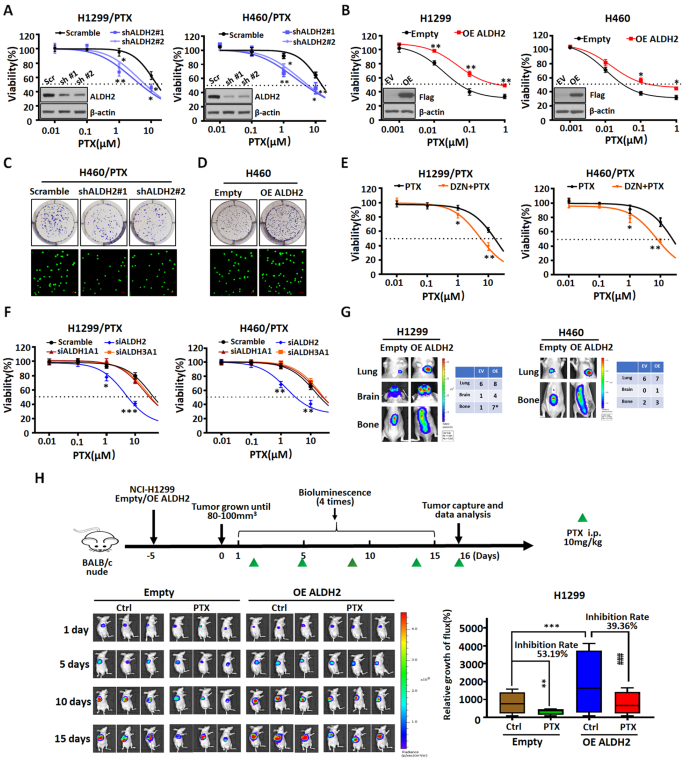
图2当ALDH2通过药物或基因干预调控NSCLC细胞时,PTX的疗效会发生改变。
3. NFYA转录因子参与ALDH2转录的激活。
作者们分析了ALDH2的启动子区域,并根据PROMO、JASPAR等生物信息学数据库预测了转录因子结合位点。结果发现转录因子NFYA和HNF4A存在多个结合位点(图3A)。接下来,作者们采用双荧光素酶报告基因检测方法测定NSCLC和NSCLC/PTX中的报告基因活性。在NSCLC细胞和NSCLC/PTX细胞中均见到类似的转录活性模式。其中包含一个NFYA结合位点的P3区在所检测的4种细胞系中活性最高(图3B)。这表明NFYA可能是ALDH2启动子的转录激活因子。接下来,作者们测定了转录因子NFYA和HNF4A在NSCLC和NSCLC/PTX细胞中的蛋白表达水平。NSCLC/PTX细胞NFYA和HNF4A蛋白水平高于NSCLC细胞(图3C)。进一步,作者们利用双荧光素酶报告法研究了转录因子NFYA和HNF4A对ALDH2启动子的调控能力。结果表明,在转染过表达NFYA或HNF4A质粒的NSCLC和NSCLC/PTX细胞中,ALDH2启动子活性明显增强(图3D)。这为这两种转录因子在ALDH2转录调控中的关键作用提供了进一步的证据。
作者对ALDH2启动子内的NFYA和HNF4A结合位点进行突变,构建了报告基因pGL3 - ALDH2 – NFYA - M1/M2和pGL3 - ALDH2 - HNF4AM1/M2/M3,并测定了这些报告基因在细胞中的转录活性。与其他启动子突变质粒相比,pGL3 - ALDH2 - NFYA - M1在NSCLC/PTX细胞中的荧光素酶活性明显降低,表明ALDH2启动子的转录激活依赖于NFYA(图3E)。接下来构建稳定敲低NFYA的NSCLC/PTX细胞,并测定了ALDH2蛋白水平。结果表明,ALDH2蛋白在这些细胞中的表达水平降低(图3F)。此外,拯救NFYA表达时,ALDH2蛋白表达水平升高(图3F)。为明确NFYA与ALDH2之间的关系,作者采用免疫组织化学方法检测49例PTX治疗的NSCLC患者组织标本中NFYA和ALDH2的表达水平。结果显示,80 % NFYA高表达患者(n = 20)为高ALDH2表达组(n = 25),54 % NFYA低表达患者(n = 13)为低ALDH2表达组(n = 24)。由此可见,PTX治疗NSCLC患者NFYA表达与ALDH2表达呈正相关(图3G)。综合以上结果,证明了NFYA是ALDH2重要的转录激活因子。
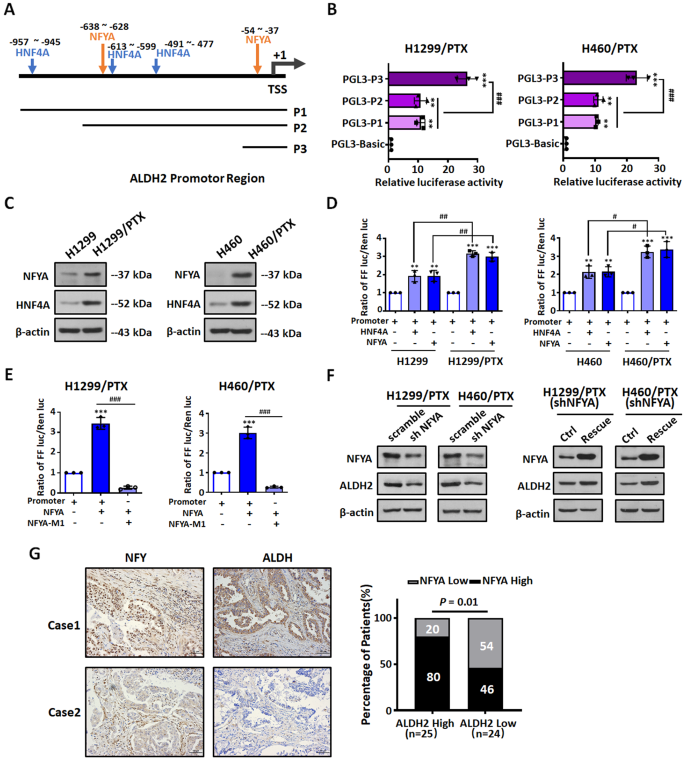
图3 NFYA转录因子参与ALDH2转录的激活
4. ALDH2的转录激活受NFYA和EHMT2的协作调控。
基因芯片结果显示,与NSCLC细胞相比,NCI-H460/PTX细胞中一些表观遗传学酶的表达发生了改变(图4A)。因此,作者测定了一系列表观遗传酶抑制剂处理的NSCLC/PTX细胞中ALDH2蛋白水平。结果表明,抑制EHMT2(组蛋白赖氨酸甲基转移酶2)的UNC0638在NSCLC/PTX细胞和NSCLC细胞中明显上调ALDH2(图4B)。EHMT2增加H3K9me2水平,对转录有抑制作用。研究推测,当EHMT2被抑制时,ALDH2的表达会上调。作者们又测定了另外三种EHMT2抑制剂(UNC0638、UNC0642、UNC0631)和JMJD抑制剂JIB04处理的NSCLC/PTX细胞中ALDH2蛋白水平。结果发现EHMT2抑制剂上调ALDH2蛋白表达,JIB04具有下调作用(图4C)。这些结果说明EHMT2和JMJD通过表观遗传学机制调控ALDH2。
作者们在UNC0638、UNCC0642和JIB04处理的NSCLC/PTX细胞中过表达NFYA。结果表明,当NFYA过表达或EHMT2被抑制时,ALDH2启动子活性显著升高;此外,NFYA过表达和EHMT2抑制共同作用于ALDH2的上调(图4D-E)。然后,作者在NCI-H460和NCI-H460/PTX细胞中,绘制了两个组蛋白标记(H3K9me2, Ac-H3)在全基因组的图谱。结果表明,NCI-H460/PTX中H3K9me2峰活性染色质信号较低,Ac-H3峰活性染色质信号较高(图4F)。此外,研究还验证了与NCI-H460相比,NCIH460/PTX中ALDH2启动子区H3K9me2的积累减少,而Ac-H3的积累则在ALDH2启动子区(图4G顶部和中部)增加。UNC0638处理的NCIH460细胞,NFYA与ALDH2启动子的结合能力增强,而JIB04则相反(图4G底)。总体而言,这些结果提示NFYA是ALDH2的重要转录激活因子,EHMT2和NFYA在ALDH2的调控中具有协同作用。
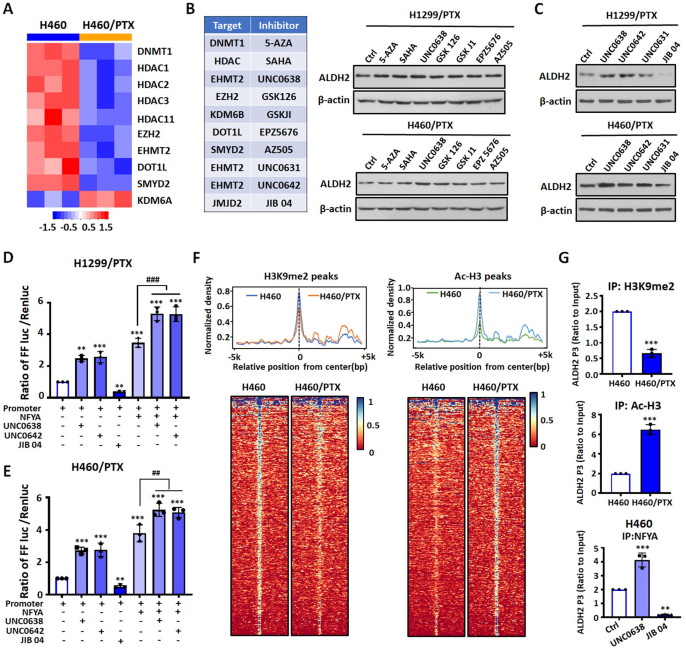
图4 ALDH2的转录激活受NFYA和EHMT2的协作调控
5. ALDH2通过RAS/RAF通路介导紫杉醇的耐药性。
对转染ALDH2或扰乱shRNA的NCI-H460/PTX细胞进行基因芯片分析,结果显示,稳定敲除ALDH2后,NCI-H460/PTX细胞中有许多基因差异表达;其中,511个shALDH2与Scramble相比有所下降(图5A)。与NCI-H460相比,NCI-H460/PTX上调基因间存在富集基因;与Scramble相比,ALDH2 shRNA转染NCI-H460/PTX下调基因间存在富集基因(图5B)。通路分析显示TGF β通路、RAF通路、EMT通路等明显富集(图5C),表明这些通路可能参与ALDH2介导的肺癌PTX耐药。接下来,作者们研究了RAS/RAF信号通路相关蛋白的表达情况,发现与Scramble组相比,ALDH2敲低的NSCLC/PTX细胞中RAS/RAF信号通路相关蛋白的表达水平持续下降(图5D)。因此,我们推测RAS/RAF信号通路参与了ALDH2介导的紫杉醇耐药。然后,作者们过表达KRAS和RAF1,并测定PTX在ALDH2敲除NSCLC/PTX细胞中的疗效。结果表明,在ALDH2敲低的NSCLC/PTX细胞中过表达KRAS和RAF1后,PTX的疗效下降(图5E-F)。综合以上结果,证明RAS/RAF信号通路参与了ALDH2介导的PTX抗性。
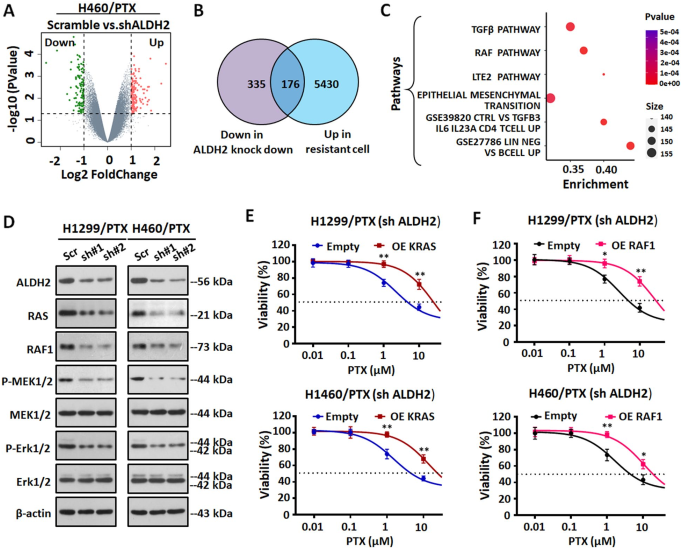
图5 敲低ALDH2可抑制NSCLC/PTX细胞中的RAS/RAF通路
6. ALDH2的药理抑制使体内外的NSCLC/PTX细胞对紫杉醇敏感。
DZN是ALDH2的特异性抑制剂,DSF是ALDH2的非特异性抑制剂。为了验证DZN + PTX或DSF + PTX对NSCLC/PTX细胞的生长抑制具有协同作用,作者采用NCI-H460/PTX异种移植模型,测定其体内靶向ALDH2的抑制效果(图6A)。结果显示,DZN + PTX组和DSF + PTX组肿瘤体积明显小于PTX单独组(图6B-C)。DZN + PTX组肿瘤重量明显低于单纯PTX(图6D)。这些结果表明,靶向抑制ALDH2逆转了PTX抗性。TUNEL染色证实,与单纯PTX相比,DZN + PTX和DSF + PTX显著增加肿瘤组织细胞凋亡水平(图6E)。此外,Western blot结果证实PTX联合ALDH2抑制剂较单独PTX能抑制Erk1/2和MEK1/2磷酸化(图6F),免疫组化结果也证实PTX联合ALDH2抑制剂较单独PTX能抑制ERK1/2磷酸化(图6G)。以上数据表明,DZN或DSF对ALDH2的药理学抑制作用可通过诱导细胞凋亡和抑制RAS/RAF信号通路逆转NCI-H460/PTX异种移植模型的PTX耐药性。
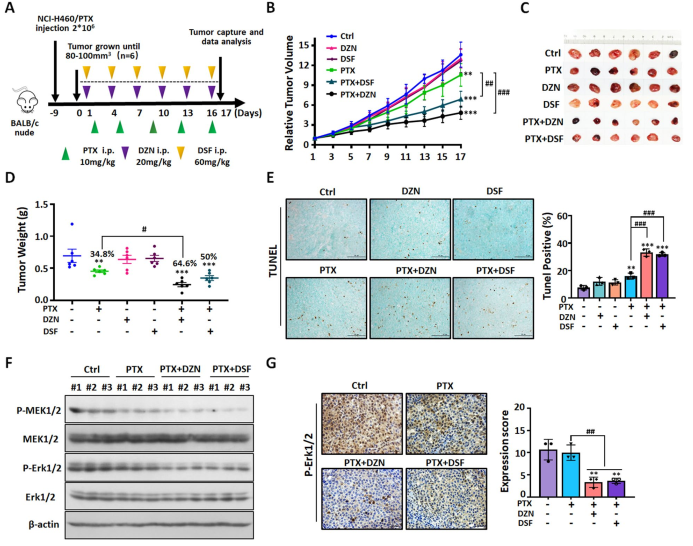
图6 DZN和DSF使体内NSCLC/PTX细胞中紫杉醇的耐药显著下降
7. ALDH2的表观遗传下调使体内外NSCLC/PTX细胞中紫杉醇的耐药性下降。
本实验构建了NCI-H460/PTX异种移植瘤模型,研究JIB04和PTX联合应用能否逆转PTX耐药(图7A)。在本模型中,JIB04 + PTX组与PTX单独组相比,明显抑制了相对肿瘤体积和肿瘤重量(图7B和C)。以上结果表明,JIB04与PTX合用,提高了PTX的抗肿瘤作用,逆转了PTX的耐药性。在NCI-H460/PTX肿瘤组织中,Western blot和免疫化学进一步证实JIB04下调ALDH2(图7D和E)。TUNEL染色也证实JIB04 + PTX显著增加肿瘤细胞的凋亡水平(图7F)。总的来说,表明JIB04与PTX联合诱导PTX耐药的NSCLC移植瘤细胞凋亡。当用EHMT2抑制剂UNC0642替代DZN上调ALDH2表达时,肿瘤体积较其他两组增大(图7G)。综上所述,ALDH2的表达可通过表观遗传学途径调控,从而影响NSCLC对PTX的敏感性。

图7 JIB04使体内NSCLC/PTX细胞中紫杉醇的耐药显著下降

图8 研究结果图
结论
本研究结果总结在一个示意图(图8)。抑制EHMT2和同时过表达NFYA可上调ALDH2的表达,该信号轴参与介导体内外对PTX的耐药。从机制上讲,NFYA是ALDH2重要的转录激活因子,EHMT2通过增加H3K9me2水平使染色质致密化。抑制EHMT2可促进NFYA与ALDH2启动子结合,从而激活ALDH2的转录。DZN、DSF或JIB04抑制或下调ALDH2可增加PTX对NSCLC/PTX细胞或移植瘤的疗效,逆转PTX耐药。本研究结果揭示了一种抑制或下调促瘤基因的新策略,可能为克服PTX耐药提供了突破口。
参考文献
Wang W, Wang J, Liu S, Ren Y, Wang J, Liu S, Cui W, Jia L, Tang X, Yang J, Wu C, Wang L. (2022). An EHMT2/NFYA-ALDH2 signaling axis modulates the RAF pathway to regulate paclitaxel resistance in lung cancer. Mol Cancer. 2022 Apr 27;21(1):106. doi: 10.1186/s12943-022-01579-9.






