长链非编码 RNA MIR4435-2HG通过重编程中性粒细胞抑制结直肠癌的发生和进展
作为全球恶性肿瘤的第三大病因,结直肠癌在起始和进展阶段受lncRNA异常表达和突变的调控。之前的研究发现MIR4435-2HG作为多种肿瘤类型的癌基因,但MIR4435-2HG在肿瘤基质或微环境中的作用及其详细的调控机制,仍然未知。髓源性抑制细胞 (MDSC) 是一种异质细胞群,包括病理活化的单核细胞和相对不成熟的中性粒细胞,lncRNAs 在 MDSCs 中的作用尚未得到详细阐明。该研究发表于《Cancer Immunology Research》,IF:12.02。
技术路线:
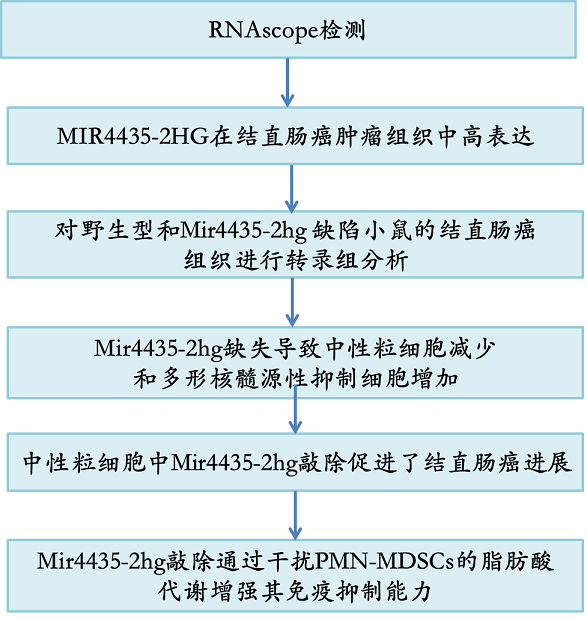
主要研究结果:
1. 肿瘤细胞内的MIR4435-2HG在体外对结直肠癌细胞没有生物学作用
为了探索MIR4435-2HG在结直肠癌中的作用,作者分析了来自癌症基因组图谱 (TCGA) 和符合条件的基因表达综合 (GEO) 数据库的 10 个公共数据集(包括 10 多对正常-肿瘤结直肠癌样本),结果显示在 7 个数据集中,与成对的相邻正常组织相比,MIR4435-2HG在肿瘤组织中上调。因此,作者进行了荟萃分析以确认MIR4435-2HG在结直肠癌中过表达(图 1A)。
接下来,作者检测了MIR4435-2HG在结直肠癌细胞系中的表达和亚细胞定位。MIR4435-2HG在 SW480 和 RKO 细胞的细胞核和细胞质中均具有较高的表达。作者通过 SW480 细胞中的 CRISPR/Cas9 敲除MIR4435-2HG,并通过 SW480 和 RKO 细胞中的 siRNA 敲低MIR4435-2HG。在结肠直肠癌细胞中敲除或敲除MIR4435-2HG对增殖、迁移或侵袭均没有影响。与这些发现一致,MIR4435-2HG的异位表达在 DLD1 和 HCT116 细胞中没有改变它们的增殖、迁移或侵袭。RNA范围显示MIR4435-2HG在肿瘤基质中高表达,但在结直肠癌细胞和邻近的正常上皮细胞中表达非常低(图1B),这可能解释了为什么MIR4435-2HG在肿瘤组织中高表达但没有生物学效应在结直肠癌细胞内。
2. Mir4435-2hg缺失促进结直肠肿瘤发生和进展
目前尚不清楚肿瘤基质中的MIR4435-2HG是否在结直肠癌发展中发挥生物学作用。作者通过 CRISPR/Cas9 删除Mir4435-2hg基因座产生了Mir4435-2hg 缺陷小鼠。与之前的报告一致,Mir4435-2hg的缺失导致中性粒细胞、单核细胞和嗜酸性粒细胞减少,但淋巴细胞不减少。删除Mir4435-2hg后未观察到其他主要器官发育或血脂异常的明显改变。然后,作者将小鼠结肠炎相关(AOM/DSS)结直肠癌模型分为三个队列,包括短期、经典长期和长期肿瘤模型(图 1C),它们在分子水平上类似于人类结直肠癌的进展,包括Apc突变和 β-连环蛋白易位。虽然短期肿瘤模型的结直肠腺瘤不足以进行肉眼观察,但 H&E 染色显示Mir4435-2hg -/-小鼠比野生型 (WT) 小鼠携带更多的结直肠腺瘤和淋巴滤泡(图 1D - F)。通过经典术语模型的大体观察和 H&E 染色,作者在Mir4435-2hg -/-小鼠中发现比 WT 小鼠更多的肿瘤、更大的肿瘤大小和更高的肿瘤负荷(图 1G - K)。然而,长期模型的大体观察和 H&E 染色均未显示Mir4435-2hg -/-小鼠和 WT 小鼠之间的肿瘤数量或肿瘤大小存在显着差异(图 1L - O)。进一步的组织学分析(图 1M)显示所有来自Mir4435-2hg -/-小鼠的肿瘤,但只有 40% 来自 WT 小鼠,已穿透黏膜肌层进入黏膜下层(图 1P ))。另一组 AOM/DSS 模型接受了生存分析(第 30 周),而Mir4435-2hg -/-小鼠的生存率较差(图 1Q)。
接下来,将Apc Min/ +小鼠(一种自发性肠腺瘤性息肉病的动物模型)与Mir4435-2hg -/-小鼠杂交以模拟自发性肿瘤。在来自Apc Min/ +小鼠的正常组织中,在肠肿瘤中检测到更高的 Mir4435-2hg表达。然而,在Apc Min/ + / Mir4435-2hg -/-小鼠中观察到更多的肠肿瘤(图 1R)。作者还发现Apc Min/ + / Mir4435-2hg-/-小鼠的预后比Apc Min/ + /WT 小鼠差(图 1S)。总之,这些数据表明Mir4435-2hg缺失有助于散发性结直肠肿瘤的发生和进展,应被视为肿瘤抑制 lncRNA。
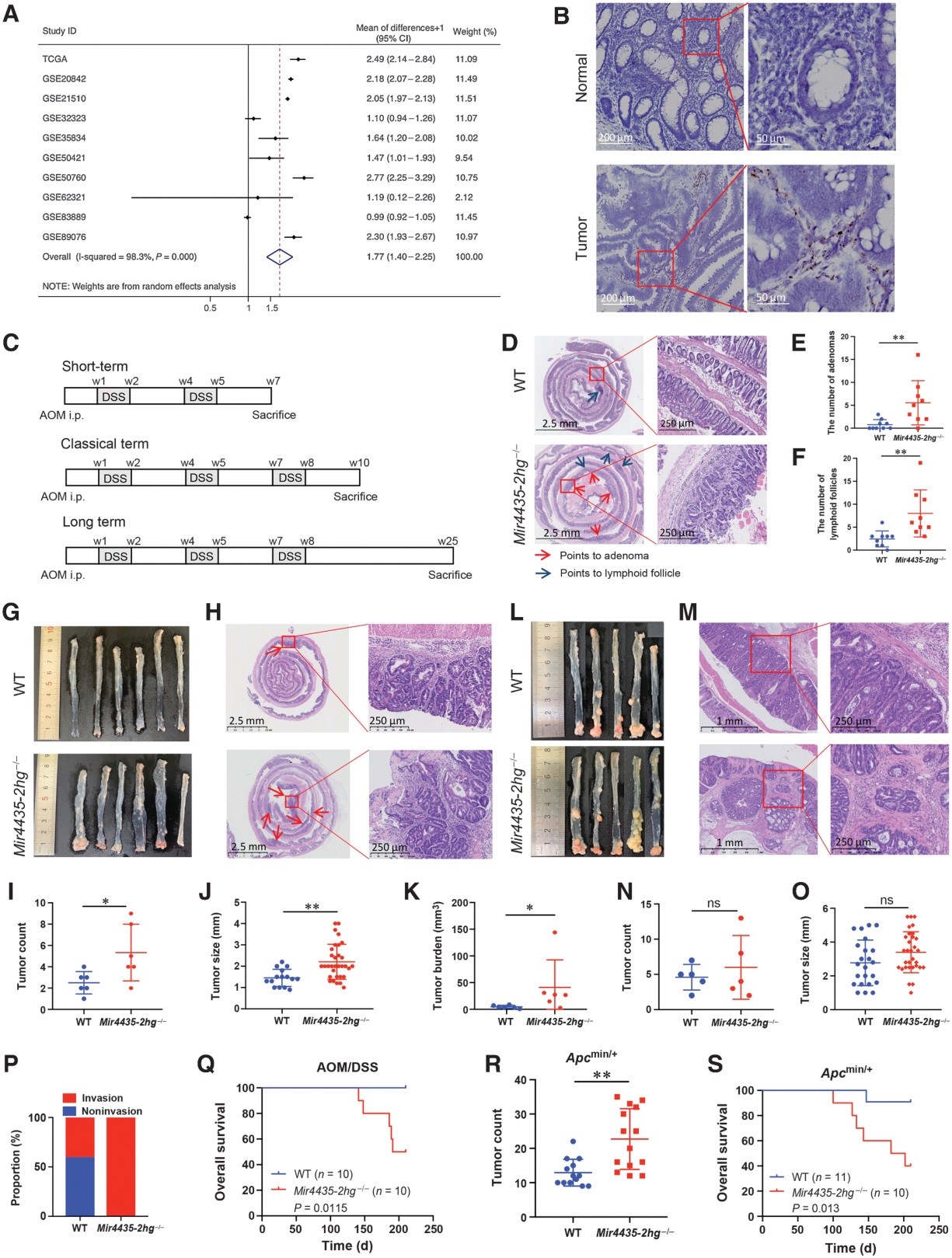
图1 Mir4435-2hg缺失促进结直肠肿瘤的发生和进展
3. MIR4435-2HG通过重塑免疫微环境来调节结直肠癌的发展
为了证明Mir4435-2hg如何调节结直肠癌的进展,作者通过 RNA-seq 对来自 WT 和Mir4435-2hg -/- AOM/DSS 小鼠的肿瘤组织进行了转录组分析。Mir4435-2hg缺失导致 92 个基因显着上调,138 个基因显着下调(图 2A),通过 qRT-PCR 进一步验证了它们的代表性基因。根据基因本体(GO)富集分析,这些差异表达的基因主要富集于免疫反应生物学过程,包括炎症反应、中性粒细胞趋化性、免疫系统过程、抗原加工和呈递(图2B和C)。
为了排除 AOM/DSS 诱导的结肠炎引起的副作用,作者还收集了Apc Min/ + / Mir4435-2hg -/-和Apc Min/ + /WT 小鼠的肿瘤组织用于 RNA-seq 分析。与 AOM/DSS 模型一致,上调基因的 GO 富集分析表明,大多数基因与肿瘤免疫相关生物学过程相关,例如淋巴细胞趋化性、对干扰素-γ 的细胞反应、炎症反应和中性粒细胞趋化性。这些数据进一步支持了Mir4435-2hg可能通过调节结直肠癌的免疫微环境发挥抑癌作用。
为了验证这一假设,将同系鼠结肠直肠癌细胞系 MC38 皮下接种到Mir4435-2hg -/-和 WT 小鼠中。作者发现肿瘤在Mir4435-2hg -/-小鼠中生长得更快(图 2D)。Mir4435-2hg -/-小鼠的肿瘤体积和重量也显着大于WT小鼠(图2E和F),Mir4435-2hg -/-小鼠的肿瘤形成率显着高于WT小鼠。
为了进一步证明肿瘤基质中而非肿瘤细胞中的 Mir4435-2hg 调节结直肠癌的发展,作者用 CRISPR/Cas9 敲除MC38细胞中的Mir4435-2hg。Mir4435-2hg敲除没有改变它们的增殖、迁移或侵袭。MC38 和 CT26 细胞中三种Mir4435-2hg变体的过表达对增殖和迁移也几乎没有影响。将 Mir4435-2hg敲除 MC38 和模拟敲除细胞同步注射到Mir4435-2hg -/-和 WT 小鼠中。淘汰Mir4435-2hg在 MC38 细胞中不影响Mir4435-2hg -/-或 WT 小鼠的肿瘤增殖;然而,Mir4435-2hg -/-小鼠的微环境显着促进了肿瘤的生长,不仅是模拟细胞,还有Mir4435-2hg敲除 MC38 细胞(图 2G)。肿瘤体积和重量也观察到类似的表型(图 2H和I)。接下来,作者从Mir4435-2hg -/-和 WT 小鼠中分离脾细胞以与 MC38 细胞共培养。正如预期的那样,与脾细胞共培养时,MC38细胞的凋亡率更高,但Mir4435-2hg的脾细胞降低了MC38细胞的凋亡率。-/-小鼠与 WT 小鼠相比(图 2J和K)。
总体而言,这些数据表明MIR4435-2HG可能通过重塑结直肠癌免疫微环境发挥抗癌作用。

图2 MIR4435-2HG通过重塑免疫微环境来调节结直肠癌的发展
4. Mir4435-2hg耗竭增加结直肠癌中的 PMN-MDSCs
Mir4435-2hg可以通过等位基因特异性抑制Bim表达来控制嗜酸性粒细胞、中性粒细胞和单核细胞的寿命。然而,目前尚不清楚结直肠癌基质中哪种类型的细胞表达Mir4435-2hg。因此,作者在人结直肠癌组织中进行了 RNAscope 分析,结果表明MIR4435-2HG主要位于中性粒细胞中(图 3A)。接下来,作者监测了皮下肿瘤生长过程中外周血中主要白细胞的数量变化。与以前的报告一致,荷瘤小鼠的中性粒细胞、单核细胞和嗜酸性粒细胞增加,淋巴细胞减少。Mir4435-2hg -/-小鼠的单核细胞和嗜酸性粒细胞仍然低于WT小鼠,但随着肿瘤的生长,Mir4435-2hg -/-小鼠的中性粒细胞数量逐渐达到与WT小鼠相同的频率(图3B)。
荷瘤小鼠中的中性粒细胞是异源的,包括经典的中性粒细胞和 PMN-MDSCs。根据作者上面的数据,作者假设Mir4435-2hg不能控制 PMN-MDSC 的寿命,并且携带肿瘤的Mir4435-2hg -/-小鼠中升高的中性粒细胞主要是 PMN-MDSC。因此,作者在无肿瘤和有肿瘤的 WT 和Mir4435-2hg -/-小鼠中检测到中性粒细胞的凋亡。无肿瘤Mir4435-2hg -/-小鼠的中性粒细胞凋亡明显多于 WT 小鼠。然而,在荷瘤小鼠中,Mir4435-2hg中的中性粒细胞凋亡减少-/-和 WT 小鼠,这可能是由 MC38 细胞产生的 GM-CSF 造成的,在荷瘤Mir4435-2hg -/-小鼠中,中性粒细胞凋亡率降低到与荷瘤 WT 小鼠相同的水平(图 3C和D)。在BM衍生的PMN-MDSCs中,作者还观察到在用MC38肿瘤细胞培养基处理后细胞凋亡率降低,尤其是在Mir4435-2hg -/-细胞中(图3E)。
因为Mir4435-2hg通过抑制Bim表达来调节中性粒细胞凋亡,作者检测到 BIM 蛋白在中性粒细胞中的表达。BIM 在无肿瘤和携带肿瘤的Mir4435-2hg -/-小鼠中均上调,并且携带肿瘤不改变 BIM 的表达(图 3F和G)。Bcl2 家族通过形成同源二聚体或异源二聚体来调节细胞凋亡。因此,作者检测到所有抗凋亡 Bcl2 家族成员的变化。其中,来自 WT 或Mir4435-2hg -/-小鼠的 BM 衍生的 PMN-MDSC 中只有Bcl2l1通过 MC38 肿瘤细胞培养基的刺激而上调(图 3H),而Bcl2和Bcl2a1a被下调,而Bcl2l2和Mcl1未改变。流式细胞术还显示来自 WT 和Mir4435-2hg -/-荷瘤小鼠的中性粒细胞中 BCL2L1 的表达升高(图 3I和J)。这些结果表明,PMN-MDSCs 中 BCL2L1 的表达升高可能会拮抗 Mir4435-2hg -/- 小鼠中增加的 BIM 的功能,帮助荷瘤Mir4435-2hg -/-小鼠中的中性粒细胞恢复到与在WT小鼠中并导致更高比例的PMN-MDSC。

图3 Mir4435-2hg消耗增加 PMN-MDSC
单细胞 RNA-seq 分析已将 CD14 鉴定为 PMN-MDSCs 的标志物,用于区分荷瘤小鼠中的经典中性粒细胞。在作者的研究中,在携带肿瘤的Mir4435-2hg -/-小鼠的脾中性粒细胞中观察到的 CD14 +细胞比例显着高于来自 WT 小鼠的那些。即使在无肿瘤小鼠中,Mir4435-2hg -/-小鼠也比WT小鼠携带更高比例的CD14 +中性粒细胞(图3K和L)。作者还通过流式细胞术研究了皮下肿瘤内几种类型的肿瘤浸润免疫细胞。在Mir4435-2hg中检测到更高比例的中性粒细胞-/-小鼠比 WT 小鼠(图 4A)。在中性粒细胞室内,CD14 +细胞的百分比在 WT 小鼠中达到平均 85.7%,在Mir4435-2hg -/-小鼠中达到 93.0%(图4B),这表明肿瘤浸润性中性粒细胞主要是增加的 PMN-MDSCs在Mir4435-2hg -/-小鼠的肿瘤内。相反,CD3 + T 细胞和 CD8 + T 细胞减少(图 4C和D)。Mir4435-2hg -/-小鼠的单核细胞/M-MDSCs 也显着减少,而总 CD45 +细胞、巨噬细胞和 M2 巨噬细胞没有改变(图4E-H)。在 AOM/DSS 结直肠癌模型中也观察到了类似的结果;通过IHC,与WT小鼠相比,Mir4435-2hg -/-小鼠的肿瘤浸润性PMN-MDSCs显着增加,CD8 + T细胞减少(图4I)。这些数据表明,Mir4435-2hg的丢失可能导致 PMN-MDSCs 的增加,这有助于免疫抑制环境。
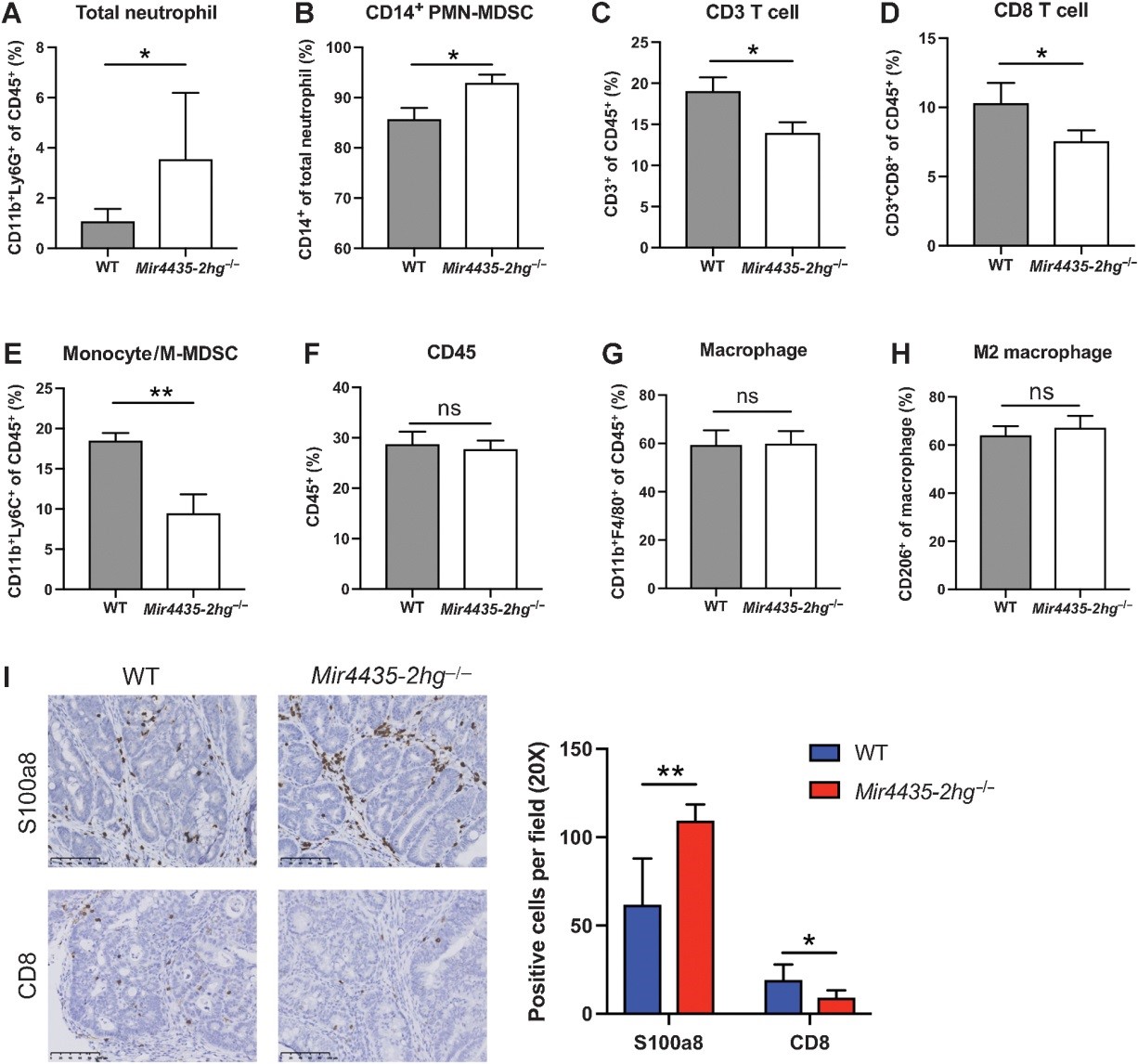
图4 Mir4435-2hg耗竭导致肿瘤浸润性 PMN-MDSC 增加和 T 细胞减少
5. Mir4435-2hg 的缺失增强了 PMN-MDSCs 的免疫抑制潜力
为了研究Mir4435-2hg调节 PMN-MDSCs 的生物学机制,作者对来自 BM 的中性粒细胞进行了 RNA-seq,结果显示 429 个下调基因和 336 个上调基因(图 5A)。GO富集分析表明,下调基因富集于有丝分裂相关的生物学过程,包括细胞分裂、有丝分裂核分裂和有丝分裂中心体分离的调节。由于 MDSCs 被认为是相对不成熟的骨髓细胞,这些结果可能表明Mir4435-2hg -/-小鼠中的中性粒细胞成熟过程紊乱,这为理解Mir4435-2hg -/-小鼠中中性粒细胞的下降和 PMN-MDSCs 的升高提供了另一个视角。
大多数与胆固醇生物合成过程相关的上调基因(图5B)和 GSEA 也表明这些基因富含胆固醇稳态和脂肪酸代谢(图 5C和D)。因为脂质积累是 PMN-MDSCs 免疫抑制功能的关键调节因子,作者推测较高的脂质积累导致 PMN-MDSCs 在Mir4435-2hg -/-小鼠中的免疫抑制作用更强。通过 BODIPY 脂质染色,作者观察到来自无肿瘤Mir4435-2hg的中性粒细胞中脂质积累的增加趋势-/-小鼠,虽然差异不显着。然而,来自携带肿瘤的Mir4435-2hg -/-小鼠脾脏的 PMN-MDSCs比 WT 小鼠具有更多的脂质(图 5E和F)。与此一致,体外由CT26和MC38诱导的Mir4435-2hg -/-小鼠BM衍生的PMN- MDSC具有比WT小鼠更多的脂质(图5G)。Mir4435-2hg -/-小鼠衍生的 PMN-MDSCs 表达更高的Arg1、Nos2、Cox2和 ROS(图 5H-K),对T细胞增殖有更强的抑制作用(图5L)。总之,这些数据表明Mir4435-2hg的缺失增强了 PMN-MDSC 的免疫抑制能力。
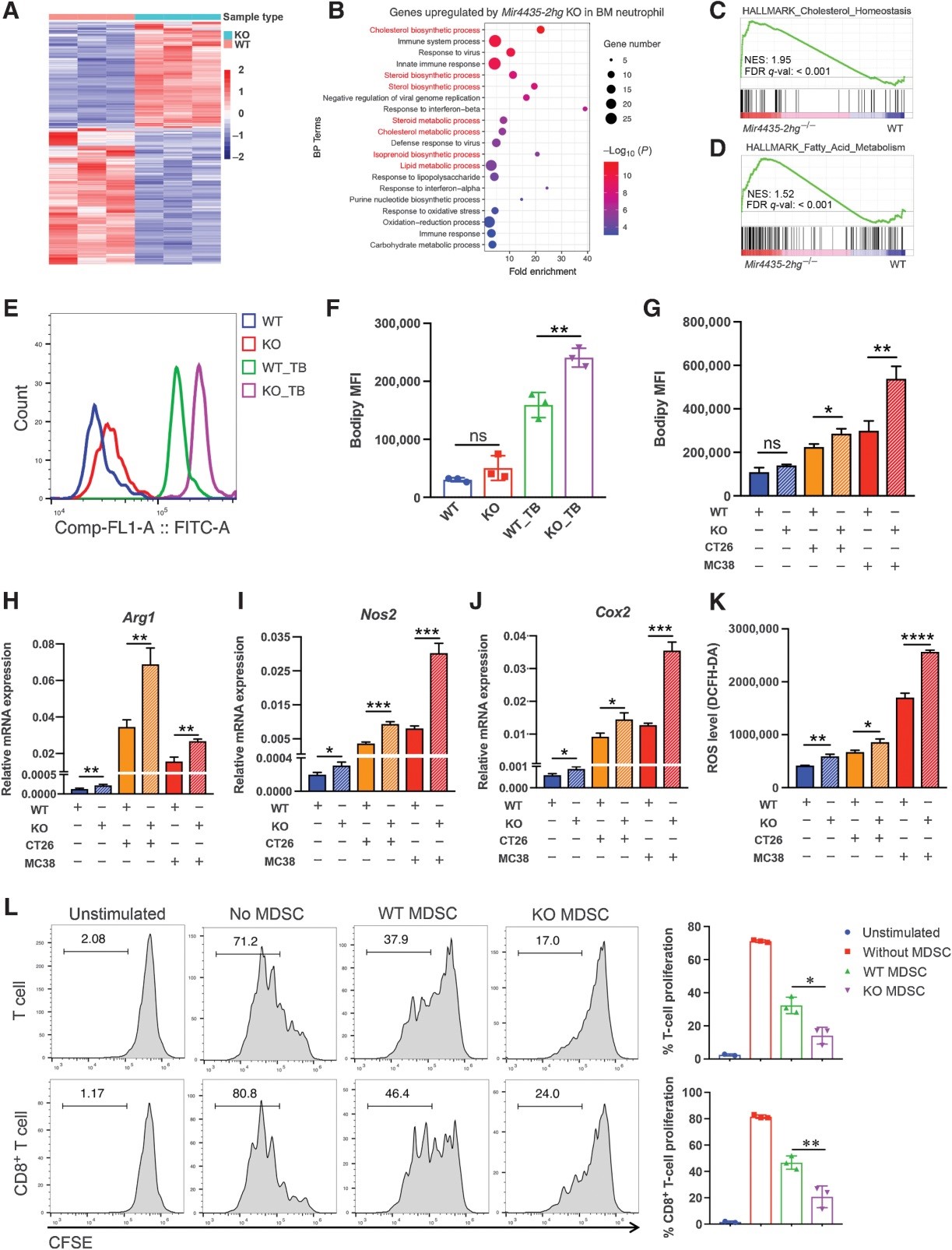
图5 Mir4435-2hg 的缺失增强了 PMN-MDSCs 的免疫抑制潜力
6. Mir4435-2hg的中性粒细胞特异性缺失促进结直肠癌进展
为了进一步证实中性粒细胞中Mir4435-2hg的消耗,而不是肠上皮细胞中的消耗,导致了在小鼠模型中观察到的表型,作者生成了条件性敲除Mir4435-2hg flox/flox小鼠,并将它们与 S100a8-Cre 小鼠或 Villin-Cre 杂交小鼠构建中性粒细胞或肠特异性Mir4435-2hg缺失小鼠(图 6A)。外周血中白细胞的流式细胞术分析显示,与Mir4435-2hg flox/flox 和 Mir4435-2hg flox/flox 相比,Mir4435-2hg flox / flox S100a8 -Cre 小鼠的中性粒细胞减少Villin-Cre 小鼠,嗜酸性粒细胞的数量在Mir4435-2hg flox/flox S100a8-Cre 小鼠中也显着减少。皮下肿瘤模型显示,Mir4435-2hg flox/flox S100a8-Cre 小鼠的肿瘤生长速度明显快于对照小鼠(图 6B),并且在中性粒细胞缺陷型小鼠中肿瘤体积和重量(图 6C和D)显着增加Mir4435-2hg小鼠。与Mir4435-2hg -/-小鼠一致,作者发现来自携带肿瘤的Mir4435-2hg flox/flox S100a8-Cre 小鼠的 PMN-MDSCs 中有更高的脂质积累(图 6E),以及在体外由 MC38 培养基诱导的 BM 衍生的 PMN-MDSCs (图 6F )。
在AOM/DSS模型中,Mir4435-2hg flox/flox S100a8-Cre 小鼠比Mir4435-2hg flox/flox Villin-Cre 和Mir4435-2hg flox/flox小鼠产生更多和更大的肿瘤(图 6G) . 虽然Mir4435-2hg flox/flox S100a8-Cre 小鼠的肿瘤计数没有显着增加(图 6H ),但Mir4435-2hg flox/flox S100a8的平均肿瘤大小和肿瘤负荷(图 6I和J)显着增加-Cre 老鼠。在Mir4435-2hg之间未观察到肿瘤计数、肿瘤大小或肿瘤负荷的明显变化flox/flox Villin-Cre 小鼠和Mir4435-2hg flox/flox小鼠。作者还观察到,与Mir4435-2hg flox/flox Villin-Cre 小鼠和 Mir4435-2hg flox/flox 小鼠相比,Mir4435-2hg flox / flox S100a8 - Cre小鼠中更多的肿瘤浸润性 PMN-MDSCs 和更少的 CD8 + T 细胞(图 6K)。总体而言,中性粒细胞/PMN-MDSCs 中Mir4435-2hg的缺失促进了结直肠癌的进展,但肠上皮细胞中没有。

图6 中性粒细胞特异性Mir4435-2hg缺失促进结直肠癌进展
结论:
该研究证明了MIR4435-2HG使用多个小鼠模型的意外作用。它通过重塑免疫微环境而不是作为肿瘤细胞中的癌基因发挥肿瘤基质中的肿瘤抑制因子的作用。MIR4435-2HG的缺乏增加了肿瘤浸润性PMN-MDSCs,增强了它们促进结直肠癌发展的免疫抑制潜力,进一步阐明了结直肠癌发病机制背后的机制,并提供了潜在的抗肿瘤免疫治疗靶点。
参考文献:
Yu H, Chen C, Han F, Tang J, Deng M, Niu Y, Lai M, Zhang H. Long Noncoding RNA MIR4435-2HG Suppresses Colorectal Cancer Initiation and Progression By Reprogramming Neutrophils. Cancer Immunol Res. 2022 Sep 1;10(9):1095-1110. doi: 10.1158/2326-6066.CIR-21-1011. PMID: 35862232.






