成年大鼠睾丸间质细胞去除和修复后的单细胞RNA测序
精子发生是一个高效、复杂和高度组织化的增殖和分化过程,它依赖于多种因素,包括间质细胞产生的睾酮。尽管睾酮在精子发生中所起的关键作用已经得到了很好的认识,但其作用机制仍不完全清楚,部分原因是无法特异性和准确地监测发育中的生殖细胞内对睾酮的依赖变化。目前,有研究首次提供了成年大鼠睾丸细胞的单细胞RNA测序数据。该研究发表于《SCIENTIFIC DATA》,IF:8.501。
技术路线:
主要研究结果:
作者使用10x Genomics Chromium平台构建单细胞RNA-seq文库,并在Illumina HiSeq PE150平台进行测序(图1a)。实验包括四个睾丸治疗组,覆盖成年大鼠的一个完整的间质细胞耗竭和替代周期。通过血清睾酮测定验证了乙烷二甲烷磺酸盐(EDS)诱导的Leydig细胞消除(E1W)和再生(E3W和E7W)的过程(图1b)。对于测序过程,饱和曲线分析表明,4个处理组的测序深度相当,足以检测到每个细胞中最多的基因(图1c,d)。测序的详细数据质量指标列于表1。所有治疗组的总读长均大于540 M。检测到的有效条形码在96.7% ~ 97.0%之间。基因组上的reads在87.3% ~ 97.3%之间,转录组上的reads在57.1% ~ 57.5%之间。4种治疗的指标非常相似,反映出由于技术原因引入的偏倚很小。
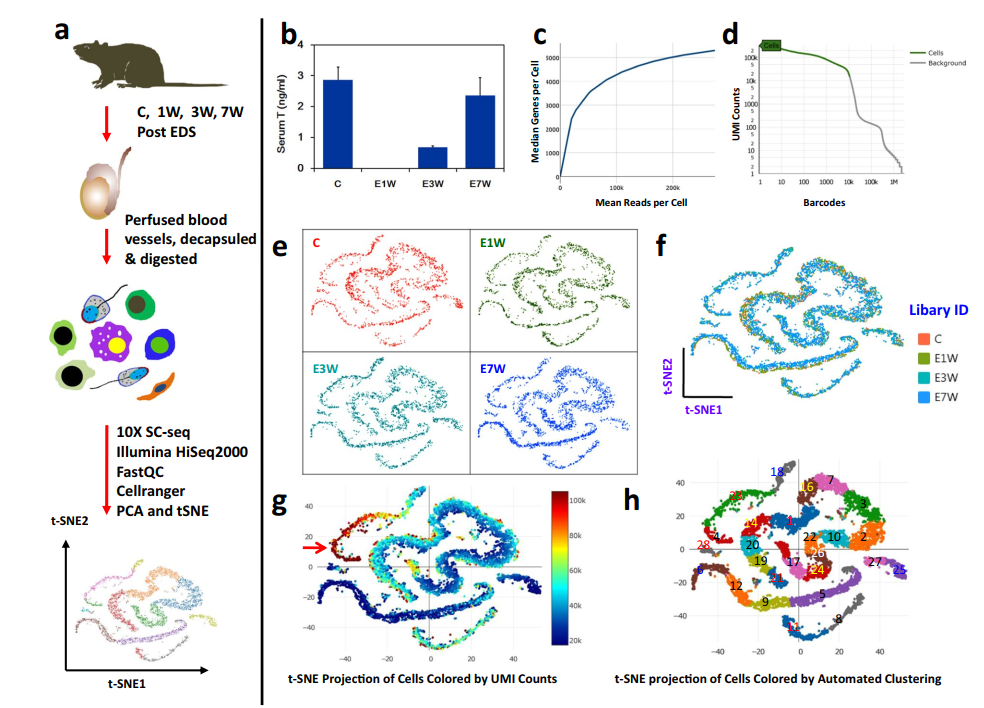
图1 EDS处理和未处理的大鼠睾丸细胞的scRNA-seq分析
表1 FASTQ文件的详细QC

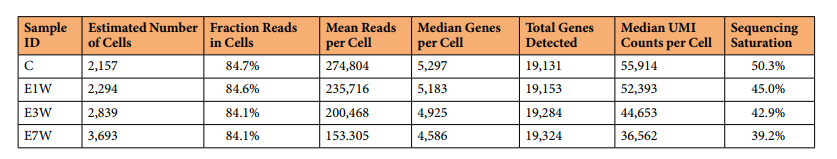
基于细胞的详细测序统计量列于表2以及图1d。获得的细胞数量估计在2,157 ~ 3,693个之间。每个细胞的中位UMI计数在36,562 ~ 55,914之间,每个细胞检测的中位基因在4,586 ~ 5,297之间。除E7W组捕获的细胞比其他组多外,其他4个处理组的这些指标非常相似。线粒体转录本的百分比是细胞凋亡的粗略指标,而血红蛋白的百分比则是污染红细胞的指标。在这个的实验中,很少有细胞超过5%线粒体转录本和0.01% HB转录本这一常用阈值,表明纯净和活细胞的质量高。总体而言,除E7W因组内细胞数较多而检测到的每个细胞的基因中位数略低外,其他指标在4组间非常相似,反映出很少的技术差异。
表2 基于细胞的测序统计
为了进一步比较4个治疗组之间的数据一致性,通过PCA将各组的特征维度进行降维,然后通过t-SNE在2个维度上进行投影(图1f)。令人惊讶的是,各组之间的细胞分布没有显著差异(图1e)。因为睾丸中各种生殖细胞群的RNA含量有很大的差异,在粗线精母细胞中发现的水平最高 (图1g和2)。包含可检测基因最多的部分(图1g,红色箭头)正是粗线精母细胞所在的区域(图2a,c)。通过自动图形聚类,作者发现了28个亚簇,这表明该数据集在生殖细胞发育阶段的识别和表征、与各阶段相关的新标志物以及细胞间涉及的特定旁分泌因子方面具有丰富的潜力(图1h)。
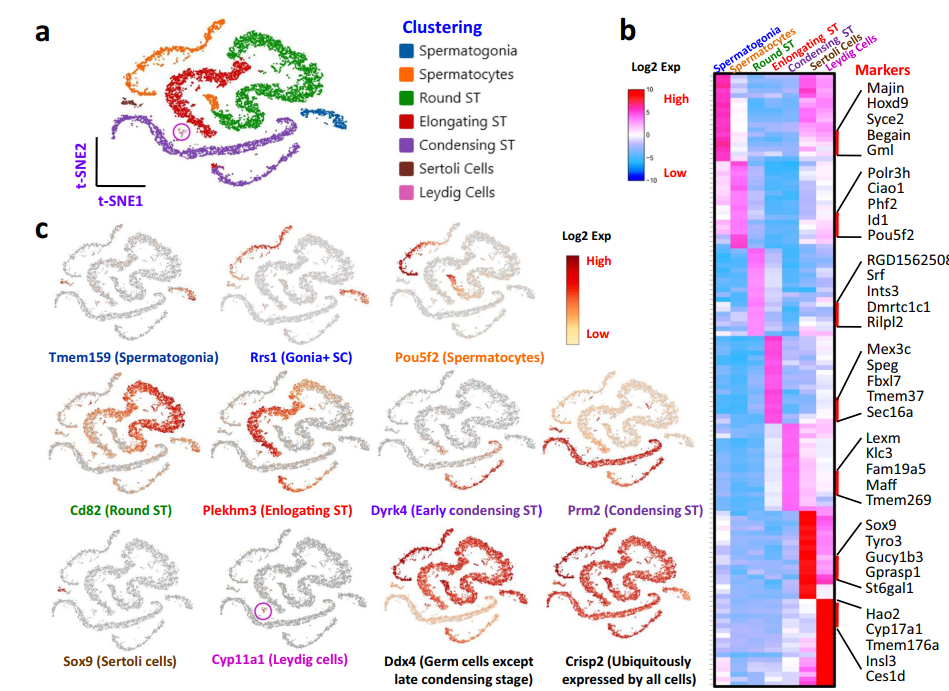
图2 通过scRNA-seq鉴定的睾丸细胞类型的标志物和属性概述
为了显示数据的质量,根据图形模式和预定义的集群数量对单元格进行了初步的聚类。借助来自大鼠、小鼠和人类的睾丸细胞标志物,作者能够将28个基于图的细胞簇合并为包含5个生殖细胞阶段的7种主要细胞类型:精原细胞(SPG)、精母细胞(SPC)、圆形精子细胞(RSPT)、伸长精子细胞(ESPT)、浓缩精子细胞(CSPT)和2种体细胞类型Sertoli和Leydig(图2a)。通过热图总结了每种细胞类型的前18个差异表达基因(图2b),其中5个代表性基因以名称显示。集群的一些特定标记也显示在t-SNE投影(图2c)或小提琴分布(图3a)。虽然大多数标记只标记一个特定的发育中的生殖细胞阶段或特定的体细胞类型,但其他基因,如众所周知的生殖细胞标记物Ddx4,标记了除凝集后期以外的整个生殖细胞群。此外,其他基因,如Crisp2或Rps16,在所有类型的睾丸细胞中普遍表达。
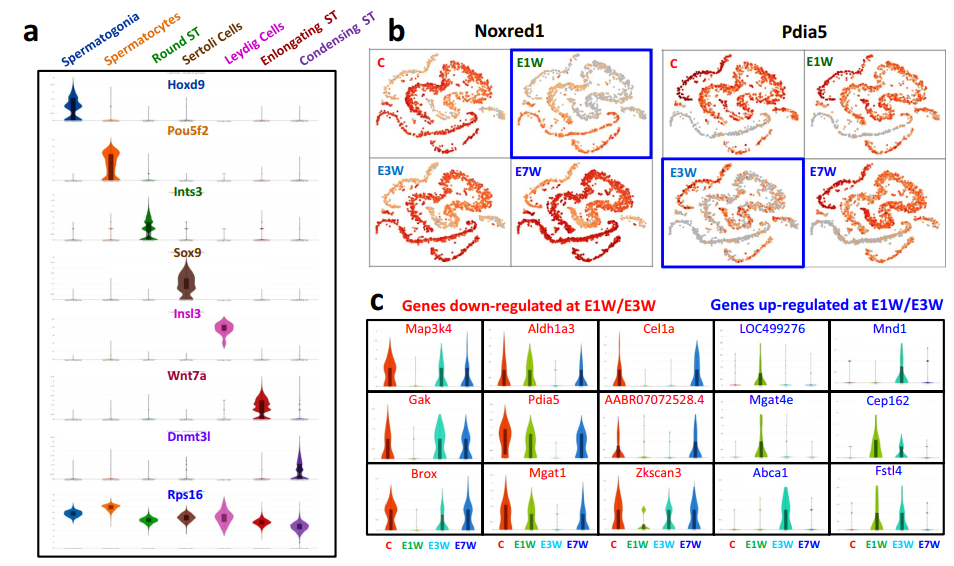
图3 标志基因和睾酮敏感基因的分布
作者又进一步分析了每种细胞类型的知名标记基因的表达模式(图s7 ~ s8)。Dazl、Sohlh2和Elavl3是已知的SPG标记,在本研究中,这些标记只在聚类中表达(图S7)。Phf、Id1和Ngfr在SPC中富集,Lrat和Spag在SPT中富集。Tnp和Prm都是众所周知的标记物。所有这些都被发现在本研究中对应的聚类中特异性表达(图S7, S8)。另外,两个主要的体细胞群,Sertoli细胞和Leydig细胞,只表达众所周知的标记物Clu和Gstm6的支持细胞和Cyp17a1和Cyp11a1的Leydig细胞。所有这些特异的表达标记都支持细胞分类准确的结论。

图S7 不同睾丸细胞特异性表达基因的小提琴图
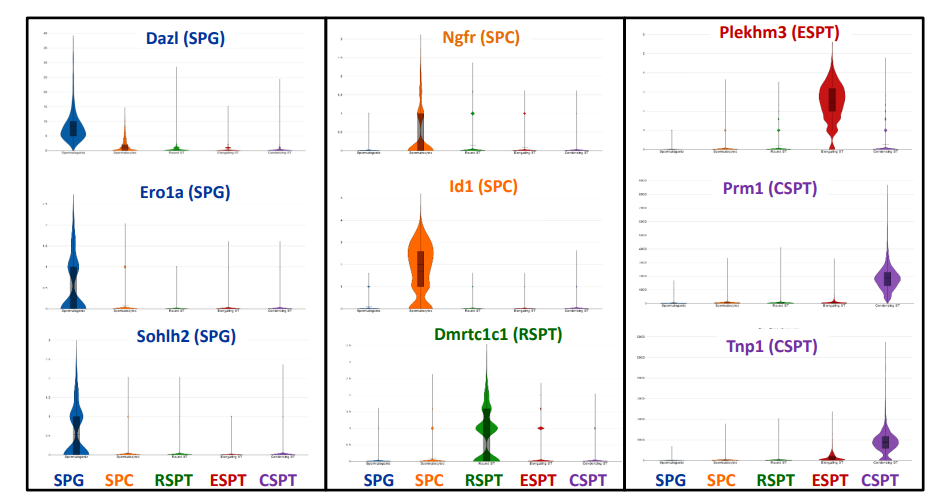
图S8 不同生殖细胞特异性表达基因的小提琴图
另一个众所周知的SPG干细胞基因是Gfra1。该基因并不是由SPG表达,而是由SPT高表达(图S9A, B)。SPT在大鼠中高表达(图S9C)。
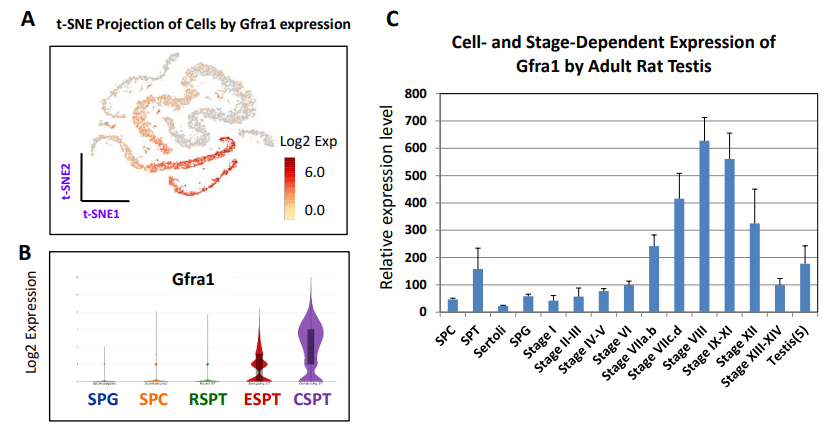
图S9 Gfra1在不同发育阶段生殖细胞中的表达
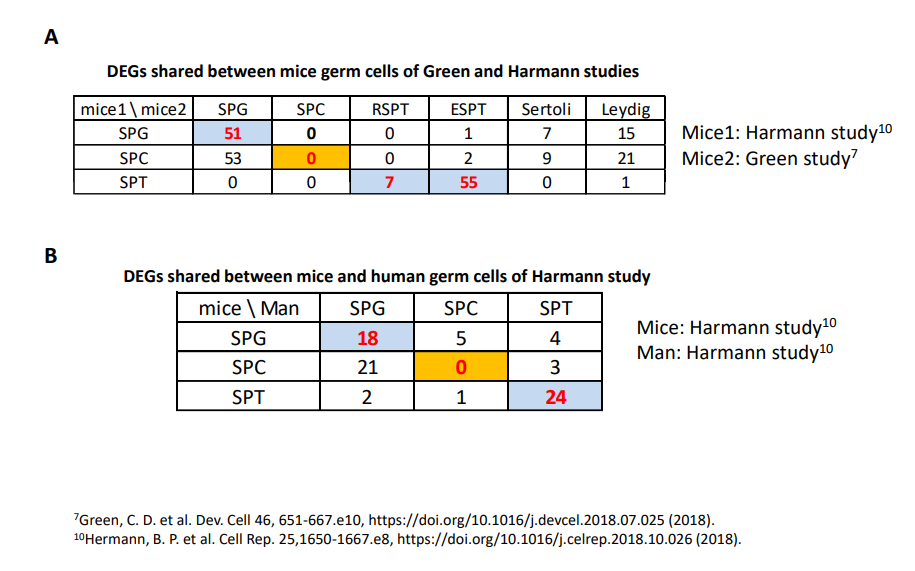
为了进一步检验大鼠睾丸细胞的分类在多大程度上与最近对小鼠和人类睾丸细胞的研究一致,作者计算了在本次研究的前200个富集基因和已发表研究的基因列表中每种细胞类型的共享基因的数量。如补充表S1所示,该研究与Green等的研究在每种细胞类型的DEGs数量上是匹配的。体细胞的基因匹配率高于生殖细胞,发育晚期的生殖细胞基因匹配率高于发育早期。不同细胞类型之间共享的基因比相同细胞类型之间共享的基因要少得多。该研究和Hermann的小鼠和人类研究之间的所有细胞也是如此,但小鼠SPC除外(表S1和S2)。这些结果表明,除了小鼠SPC之外,3项研究中其他所有细胞类型都有很高的匹配度,这表明在不同物种的精子发生中有共同的发育和调控机制。
表S1 3项scRNA-Seq研究中睾丸主要细胞的前200个差异表达基因(DEGs)中共享的基因数量
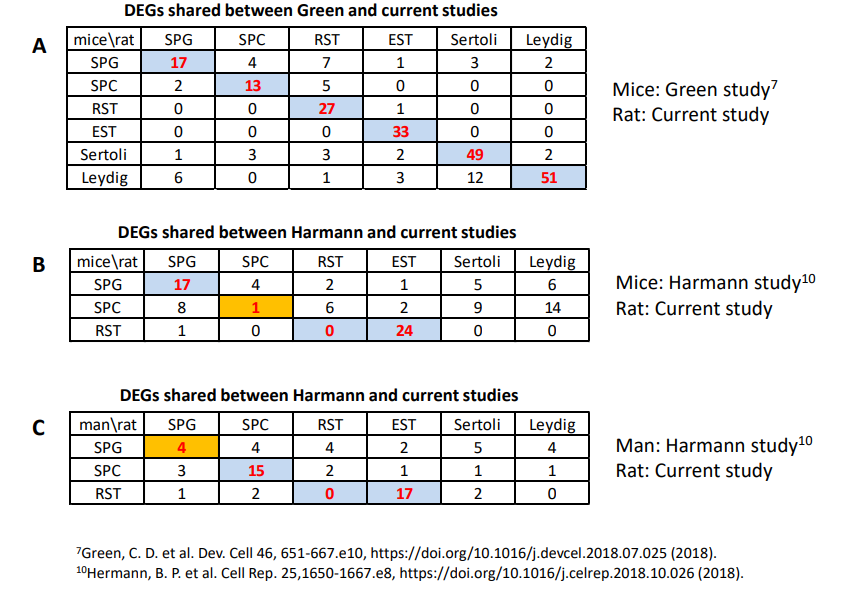
表S2 2项scRNA-Seq研究中睾丸主要细胞的前200个差异表达基因(DEGs)中共享的基因数量
该研究实验设计的一个显著特点是睾丸内睾酮的耗竭和恢复。这样一个动态的周期提供了一个机会来分析睾酮对维持和恢复精子发生的作用。为了检测睾酮的缺失和恢复是否影响生殖细胞中任何基因的表达,比较4个治疗组的基因表达(图3b)。在1周(E1W)或3周(E3W)睾酮撤退时,Noxred1和Pdia5等基因被抑制(蓝框),但在7周(E7W)时恢复正常水平。有趣的是,Noxred1在第1周开始反弹,而Pdia5在第3周开始反弹,这表明可能涉及不同的调控机制。此外,这两个基因的变化主要是在圆形精子细胞群体中,尽管这两个基因的表达并不局限于该群体。除了生殖细胞,支持细胞对EDS处理的反应中还有许多基因表达差异(图3c)。有些基因在EDS治疗后1和/或3周被完全抑制,到7周时完全恢复到control (C)水平。此外,在EDS治疗后1周和/或3周,一些未被对照组表达的基因被激活。这些基因在EDS治疗7周后被关闭。
总结:
这些数据集的主要分析进一步支持了数据的质量,以及探索新的生殖细胞特征、与特定发育阶段相关的标志物和细胞-细胞相互作用中的旁分泌因子的潜力,特别是睾酮在精子发生中的作用。
用途:
该数据集可用于(1)在单细胞水平上识别和验证大鼠睾丸细胞中的新基因和转录本,(2)开发更全面的大鼠睾丸单细胞转录组注释系统,(3)识别与大鼠精子发生特定阶段相关的新基因调控网络,以及(4)发现生殖细胞和体细胞中睾酮依赖的基因。






