OTUD4介导的GSDME去泛素化增强鼻咽癌放疗敏感性
放疗抵抗是鼻咽癌(NPC)治疗失败的主要原因。以往的研究集中在细胞凋亡缺陷作为一种放疗抵抗机制;然而,调节NPC放疗敏感性的其他潜在死亡模式尚未被探索。活细胞显像显示,40-75%的放疗诱导的鼻咽癌死亡细胞为细胞焦亡。此外,放疗诱导的焦亡是由GSDME触发的,GSDME被线粒体内通路中激活的caspase-3所裂解。此外,GSDME在放疗抵抗的鼻咽癌标本中明显下调。GSDME低表达是预后较差的预测因子,并授予鼻咽癌在体外和体内的放疗抵抗。机制上,OTUD4去泛素化并稳定GSDME,通过促进焦亡增强鼻咽癌细胞的放疗敏感性。临床上,鼻咽癌活检中OTUD4与GSDME显著相关,且OTUD4和GSDME均低表达的患者放疗效果最差,生存期最差。总之,GSDME依赖性焦亡是鼻咽癌放疗敏感性的关键决定因素,由OTUD4通过去泛素化和稳定GSDME调节。这些发现为研究鼻咽癌的放疗抵抗提供了一个有前途的新方向,并为鼻咽癌放疗敏感提供了潜在的治疗靶点。本文于2022年11月发表于“Journal of Experimental & Clinical Cancer Research”(IF=12.658)上。
技术路线

结果
1)放疗通过自身线粒体凋亡途径诱导鼻咽癌细胞GSDME依赖性焦亡
我们观察到放疗导致鼻咽癌细胞焦亡的形态学特征(图1A)。细胞死亡的性质通过乳酸脱氢酶释放的增加被进一步确定(图1B)。图1C显示了细胞焦亡、凋亡和存活的典型过程。在6个鼻咽癌细胞系中,放疗后的焦亡性细胞比例从4到24%不等(图1D)。为了确定哪一个gasdermin家族成员负责介导鼻咽癌细胞中放疗诱导的焦亡,我们在HONE1细胞中敲除GSDME和GSDMD的表达。抑制GSDME(图1E)减弱典型的焦亡形态学变化,以及LDH的释放和细胞活力的降低。同样,放疗后鼻咽癌细胞中观察到GSDME的裂解,伴随caspase-3和PARP的裂解以及从线粒体释放细胞色素c(图1F)。此外,放疗后,焦亡细胞的比例、LDH的释放、GSDME、PARP和caspase-3的裂解均呈时间和剂量依赖性增加(图1G-J)。以上数据提示,放疗通过固有的线粒体凋亡途径导致GSDME依赖性焦亡。

2)上调GSDME可增强鼻咽癌细胞的焦亡和放疗敏感性
活细胞成像分析显示,在放疗诱导的死亡细胞中,焦亡细胞占很大比例(40%)(图2A,左),焦亡细胞/死亡细胞比例与存活比例成反比(图2A,右)。此外,GSDME-N的相对蛋白水平与6 Gy放疗诱导的鼻咽癌细胞株的存活率呈负相关(图2B)。鼻咽癌细胞普遍表现出高于其他癌细胞的GSDME表达(图2C)。为了进一步评估GSDME对鼻咽癌细胞放疗敏感性的影响,我们构建了稳定过表达GSDME的SUNE1和6-10B细胞(图2D)。同时,我们使用shRNA沉默了HK1和HONE1细胞中内源性GSDME的表达(图2E)。SUNE1和6-10B细胞中GSDME的上调导致更明显的焦亡特征(图2D),增加了LDH的释放(图2D),增强了GSDME-N片段的生成(图2F),导致了较高比例的焦亡细胞(图2G),导致放疗后死亡细胞比例更高(图2J)。另一方面,HK1和HONE1细胞中GSDME的下调导致相反的效果(图2E, H, I, K)。此外,过表达GSDME增强鼻咽癌细胞的放疗敏感性(图2L),而敲除GSDME则降低了放疗敏感性(图2M)。这些数据表明,GSDME的上调通过提高GSDME-n在体外的寡聚水平,增强鼻咽癌细胞的焦亡和放疗敏感性。
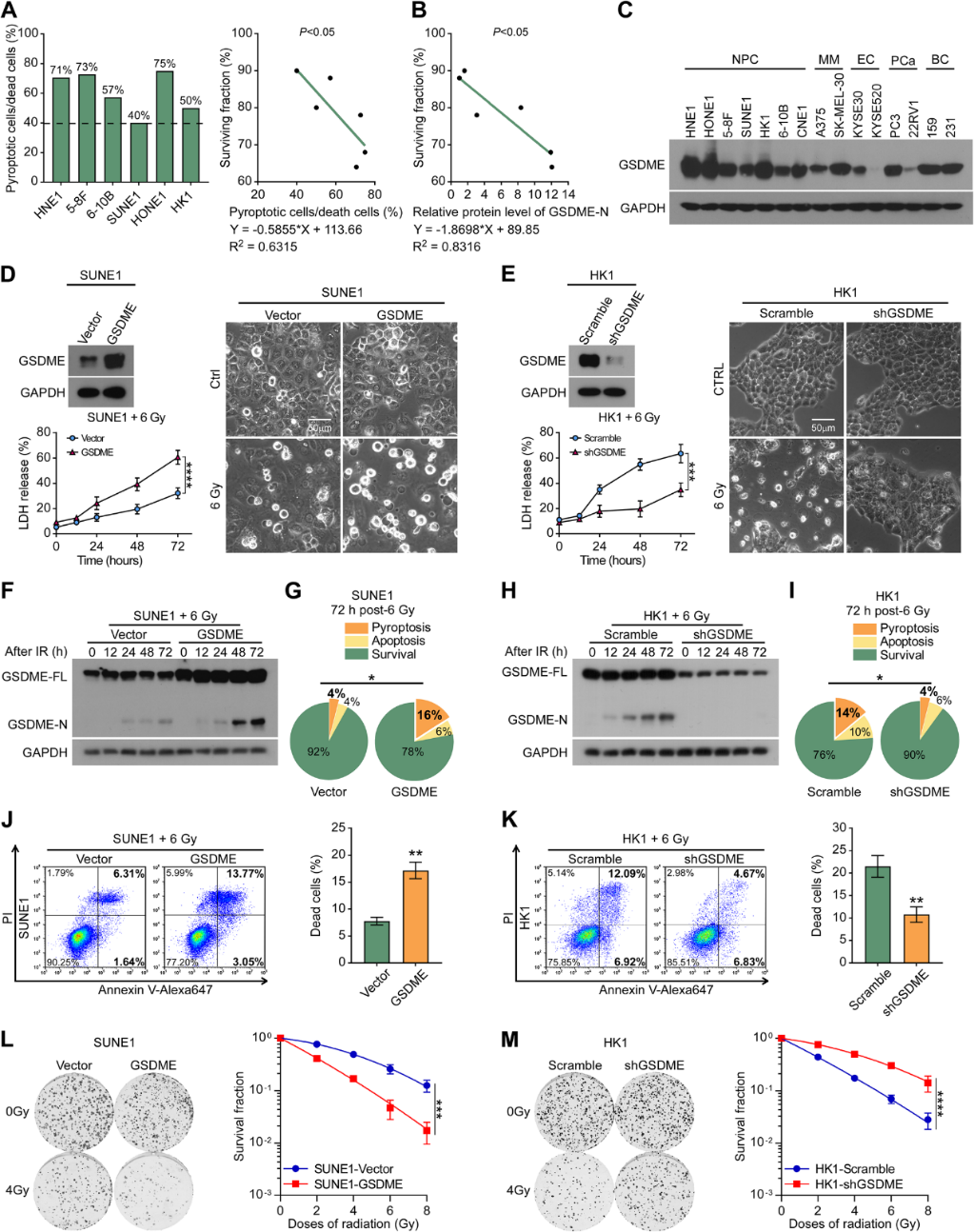
3)GSDME依赖性焦亡可使鼻咽癌在体内对放疗敏感
为了探讨GSDME是否会影响鼻咽癌在体内的放疗敏感性,我们建立了小鼠移植瘤模型。每四天测量一次肿瘤直径(图3A)。在没有放疗的情况下,与对照组相比,GSDME上调或沉默的肿瘤在生长速度(图3B)、荧光信号(图3C和D)、大小(图3E)和重量(图3F)方面没有观察到显著差异。然而,与载体组相比,放疗处理后过表达GSDME的肿瘤生长明显较慢(图3B),荧光信号较弱(图3C和D),体积较小(图3E),重量较轻(图3F),而HONE1细胞中GSDME敲除则相反。此外,放疗后,过表达GSDME组血清LDH浓度明显高于载体组,而GSDME敲除组血清LDH浓度较低(图3G)。切片肿瘤的H&E染色显示,过表达GSDME能显著增加放疗后肿瘤的炎性坏死面积,沉默GSDME则能减少炎性坏死面积(图3H)。放疗后过表达GSDME的小鼠中GSDME的裂解增加,而沉默GSDME则减少了GSDME的裂解(图3I)。这些结果表明,GSDME通过介导鼻咽癌细胞在体内的焦亡,增强了鼻咽癌细胞的放疗敏感性。

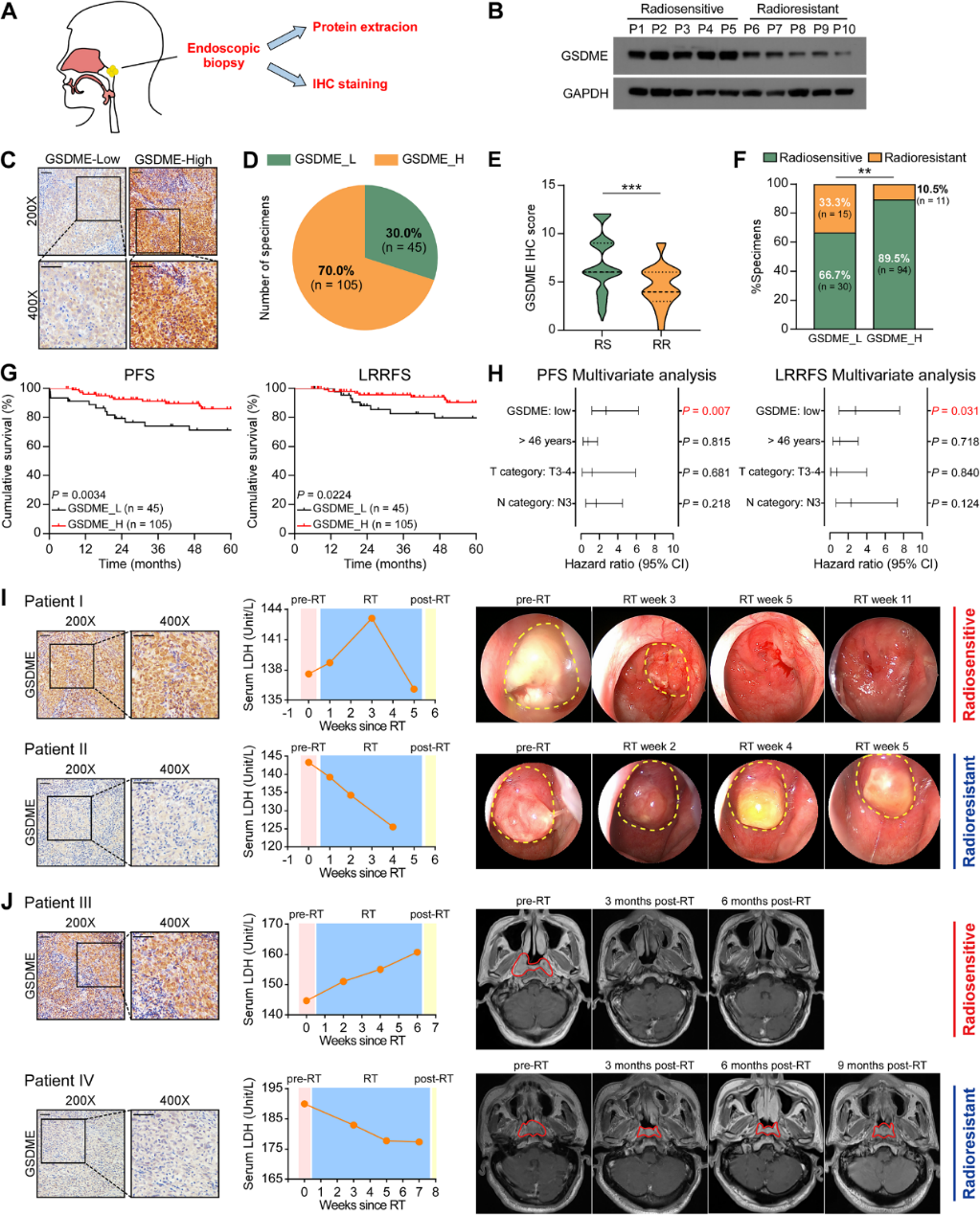
4)GSDME低表达与鼻咽癌放疗抵抗和预后不良相关
为了研究GSDME是否参与放疗反应,我们在10个新鲜冷冻组织和150个石蜡包埋组织中分析鼻咽癌中GSDME的水平(图4A)。与放疗敏感的鼻咽癌组织相比,放疗抵抗的鼻咽癌组织始终表现出较低的GSDME蛋白水平(图4B)。70.0%(105/150)患者GSDME高表达,30.0%(45/150)患者GSDME低表达(图4C,D)。放疗抵抗的组织中GSDME的IHC评分明显低于放疗敏感组织(图4E)。随后的分析显示,GSDME低表达组比GSDME高表达组放疗敏感性鼻咽癌病例比例低(图4F)。在所有鼻咽癌病例中,较低的GSDME表达与较差的PFS和LRRFS显著相关(图4G)。此外,通过多因素Cox回归分析,GSDME低表达被认为是鼻咽癌5年PFS和5年LRRFS较差的独立预后因素(图4H)。此外,在经鼻咽镜证实的部分GSDME高表达的鼻咽癌放疗敏感的患者中,放疗治疗后血清LDH水平升高(图4I,4J)。而GSDME低表达的放疗抵抗的患者的血清LDH浓度在放疗后无明显上升趋势(图4I,4J)。因此,GSDME表达可作为鼻咽癌患者放疗敏感性的前瞻性指标,放疗后血清LDH浓度的变化可动态监测鼻咽癌患者放疗疗效。
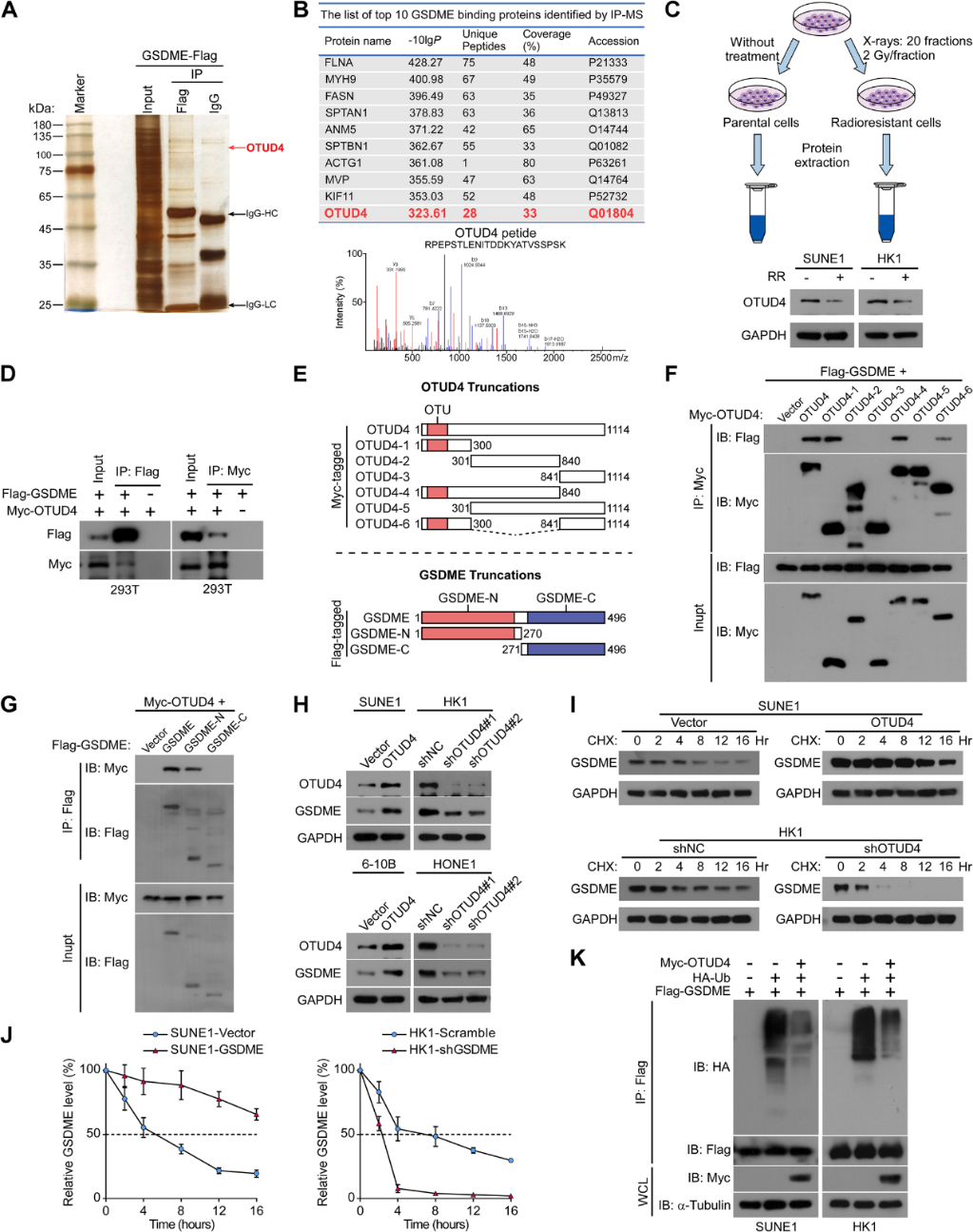
5)OTUD4去泛素化和稳定GSDME
为进一步探讨GSDME在放疗抵抗的鼻咽癌中下调的机制,采用real-time PCR方法分析GSDME在放疗敏感和放疗抵抗的鼻咽癌标本中的mRNA表达。分析显示GSDME mRNA表达在鼻咽癌放疗敏感组织和放疗抵抗的组织之间无明显差异(补充图)。这一发现表明GSDME的下调可能发生在放疗抵抗的鼻咽癌的转录后水平。有趣的是,GSDME相互作用蛋白的MS分析集中在去泛素酶OTUD4上(图5A和B)。在放疗抵抗的鼻咽癌细胞中,OTUD4蛋白表达明显下调(图5C)。OTUD4和GSDME之间的相互作用通过免疫共沉淀(co-IP)试验得到证实(图5D)。为了确定调节OTUD4和GSDME之间相互作用的区域,我们做了OTUD4截断和GSDME截断(图5E)。IP分析显示,只有截断的OTUD4包含与GSDME结合的OTU结构域,这表明OTU结构域对于GSDME是必不可少的(图5F)。此外,GSDME的N端区域负责与OTUD4的相互作用(图5G)。OTUD4的上调显著增加GSDME蛋白水平,而OTUD4的敲除则减少它的表达(图5H)。上调OTUD4显著延长了内源性GSDME的半衰期,沉默OTUD4减少了鼻咽癌细胞中GSDME的降解半衰期(图5I和J)。与这些结果一致的是,过表达OTUD4减弱了GSDME的泛素化(图5K)。这些结果表明,OTUD4促进了NPC中GSDME的去泛素化和稳定性。
6)OTUD4通过促进GSDME依赖性焦亡增强鼻咽癌细胞的放疗敏感性
为了进一步研究OTUD4对鼻咽癌细胞焦亡和放疗敏感性的影响,我们用GSDME-shRNA转染过表达或未过表达OTUD4的HONE1和5-8F细胞,然后检测它们对电离辐射的反应(图6A)。HONE1和5-8F细胞中OTUD4过表达导致更明显的焦亡特征(图6B),LDH释放增加(图6C),焦亡比例更高(图6D),放疗后死亡细胞比例更高(图6E)。此外,集落形成试验表明,OTUD4过表达可使HONE1和5-8F细胞对放疗敏感(图6F和G)。然而,通过GSDME敲除,OTUD4过表达的表型发生逆转。OTUD4过表达使异种移植瘤对放疗敏感,沉默GSDME成功地削弱了OTUD4在体内对放疗敏感性的影响(图6H-L)。此外,放疗后OTUD4过表达组的血清LDH浓度高于对照组,但沉默GSDME恢复了上述趋势(图6M)。在过表达OTUD4的肿瘤移植瘤中GSDME蛋白水平更高(图6N)。更重要的是,上调OTUD4增加了放疗后鼻咽癌细胞中GSDME-N的寡聚水平。然而,通过GSDME敲低,OTUD4过表达的影响被逆转(补充图)。这些结果表明,OTUD4通过上调GSDME蛋白水平和GSDME-N的寡聚水平,促进鼻咽癌细胞GSDME依赖性焦亡并增强放疗敏感性。

7)鼻咽癌中OTUD4/GSDME轴与放疗反应的临床相关性
接下来我们研究了OTUD4下调是否具有临床意义,以及OTUD4与GSDME是否具有临床相关性。我们测量了150例鼻咽癌患者相同组织中OTUD4的蛋白水平。典型的GSDME低表达和高表达如图7A所示。放疗抵抗组的OTUD4 IHC评分低于放疗敏感组(图7B)。随后的分析显示,OTUD4低表达组的鼻咽癌放疗敏感性病例比例低于OTUD4高表达组(图7C)。在所有鼻咽癌病例中,低OTUD4表达与较差的PFS显著相关(图7D)。与OTUD4高表达的患者(图7E)相比,OTUD4低表达的患者GSDME水平较低,血清LDH浓度无明显上升趋势,肿瘤消退较慢(图7E)。进一步分析显示,OTUD4与GSDME表达呈正相关(图7F)。更显著的是,同时低表达OTUD4和低表达GSDME的患者放疗反应(图7G)、PFS和LRRFS最差(图7H)。总之,这些数据进一步证实了OTUD4稳定并上调GSDME,而下调OTUD4抑制GSDME依赖性焦亡,导致鼻咽癌的放疗抵抗和不良预后。
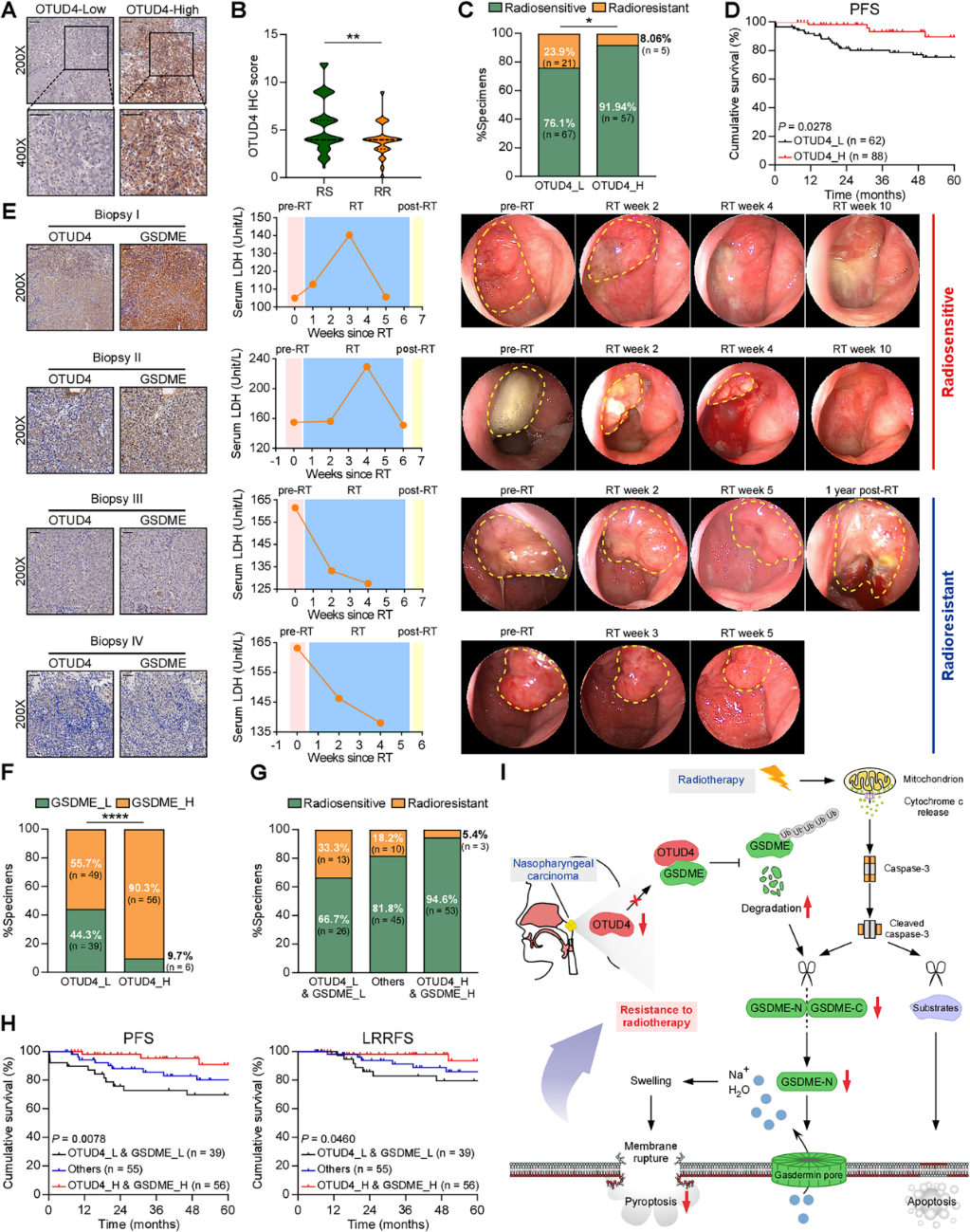
结论:
我们发现放疗通过线粒体凋亡通路诱导鼻咽癌细胞GSDME依赖性焦亡。此外,OTUD4能去泛素化和稳定GSDME,导致GSDME蛋白水平升高和放疗诱导的焦亡,最终增强鼻咽癌的放疗敏感性。以OTUD4/GSDME轴为靶点诱导焦亡是一种新的鼻咽癌放疗敏感策略。
参考文献:
Di M, Miao J, Pan Q, Wu Z, Chen B, Wang M, Zhao J, Huang H, Bai J, Wang Q, Tang Y, Li Y, He J, Xiang T, Weng D, Wang L, Xia J, Zhao C. OTUD4-mediated GSDME deubiquitination enhances radiosensitivity in nasopharyngeal carcinoma by inducing pyroptosis. J Exp Clin Cancer Res. 2022 Nov 21;41(1):328. doi: 10.1186/s13046-022-02533-9.






