PI3K/Akt/mTOR通路作为黑色素瘤脑转移的预防靶点
脑转移(BM)是恶性黑色素瘤(MM)的常见并发症,生存期较差。预防BM可能比治疗已确诊的BM更有效和具有更好的耐受性。为了研究BM形成过程中PI3K/Akt/mTOR (PAM)通路激活的时空动态及其抑制的预防潜力,我们使用Akt生物传感器进行体内分子成像,并通过小鼠慢性颅脑窗进行长期活体多光子显微镜观察。体内分子成像显示,在大脑定植的最初步骤中,PAM通路的激活是不变的。为了实现长期的血管内阻滞和外渗,循环MM细胞需要在这一过程中激活其PAM通路。然而,在已确诊的人类脑转移瘤中,PAM通路被相当不均一地激活,而其与脑渗透PAM抑制剂GNE-317的抑制作用仅在小鼠中产生中等的治疗效果。相比之下,在预防计划中给予包括极低剂量在内的GNE-317,有效地降低了两个MM小鼠模型中BM的生长速度和数量,并导致总体生存效益。纵向活体多光子显微镜发现BM形成的第一个限速步骤—血管内永久阻滞、外渗和血管周围初始生长—最容易受到PI3K/mTOR的双重抑制。这些发现确立了PAM通路激活在早期转移性脑定植的关键步骤中的关键作用,并揭示了其药理抑制是预防临床相关BM形成的有效途径。本文于2022年2月发表于Neuro-Oncology (IF=13.029)上。
技术路线:

主要研究结果:
(1) Akt生物传感器测量PAM通路调控的动态
为了全面了解PAM通路在脑转移形成过程中的作用,我们在体内实时监测肿瘤细胞中脑转移级联每个后续步骤的PAM通路激活情况。脑转移性A2058黑色素瘤细胞被用绿色荧光Akt生物传感器转导,在Akt刺激的情况下,该传感器迅速从细胞核转移到细胞质。首先,对Akt生物传感器进行体外验证。增殖细胞有传感器的细胞质信号,表明Akt活性高,而接受穿透脑的双重PI3K/mTOR抑制剂(GNE-317)或选择性泛I类PI3K抑制剂(pictilisib)攻击的细胞有表明Akt活性低的核信号(图1A)。为了量化Akt活性,计算了GFP信号的细胞质/核比,结果证实了两者之间的鲁棒性差异(图1B)。当GNE-317或pictilisib处理肿瘤细胞时,磷酸化(p)-S6RP、p-Akt和p-mTOR水平较低(图1C)。在GNE-317和pictilisib处理的细胞中,流式细胞术检测到较少的p-Akt (Ser473)(图1D)。
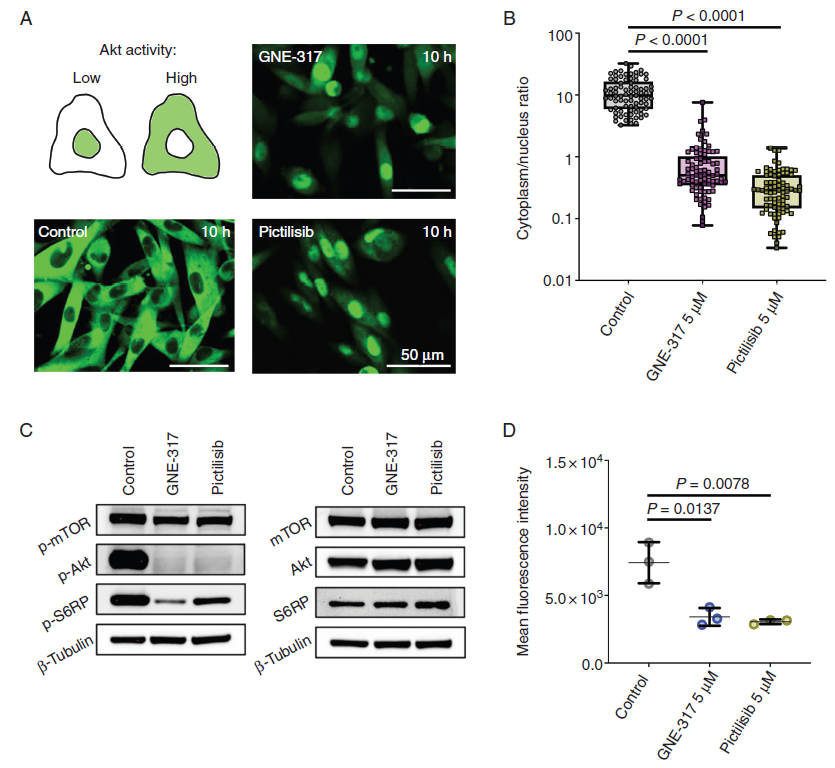
图1:Akt生物传感器的建立和验证,以测量PAM通路的激活。
(2) 循环肿瘤细胞在早期脑定植过程中迅速激活PAM通路
接下来,我们对脑定植癌细胞中PAM通路在脑转移级联的每个后续步骤中的动态调节进行研究。我们将表达RFP和Akt传感器的A2058黑色素瘤细胞向小鼠心内注射,通过慢性颅窗通过重复活体多光子显微镜进行分子成像(图2A)。在注射Akt活性较低的细胞群后的两小时内,在大脑微血管中捕获的肿瘤细胞中,约77%显示出细胞质GFP信号,表明PAM通路被激活(图2B)。成功外渗后,所有癌细胞均表现出较高的Akt活性(图2B)。随着时间的推移,对所有肿瘤细胞进行跟踪发现,只有那些在血管内阶段具有高Akt活性的细胞才能成功地外渗并定居血管周围小龛(图2C,D)。Akt活性低的血管内细胞(23%,n=16)不太可能获得永久阻滞,且从未观察到外渗事件(图2D)。综上所述,纵向监测体内PAM通路的激活表明,早在脑部肿瘤细胞停滞的血管内阶段就开始的稳健和持久的PAM通路激活,对外渗和随后的黑色素瘤脑转移形成至关重要。
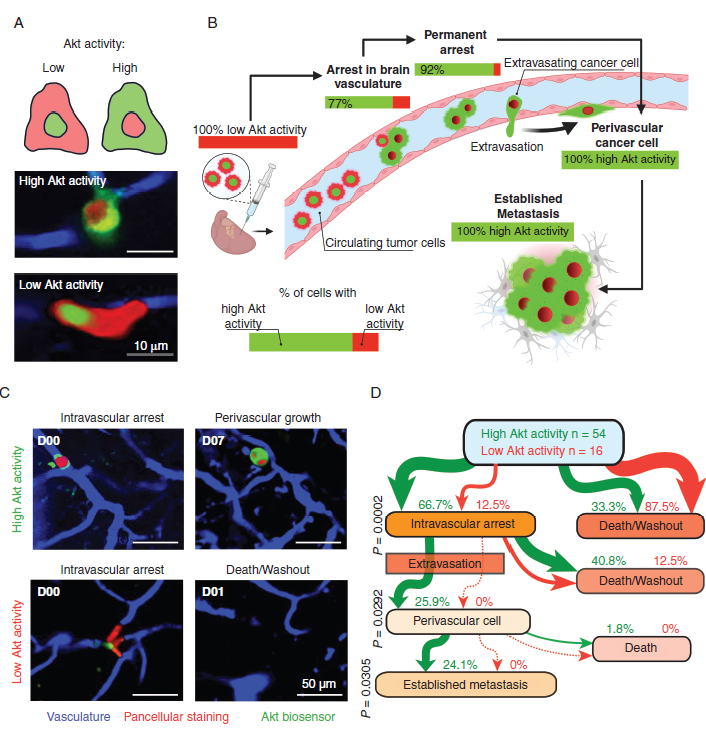
图2:PAM通路激活是黑素瘤BM中一个不变的早期事件。
通过分析转移性MM(图3A)和其他癌症患者的组织芯片数据,确认了PAM通路在人类BM中的激活。这些已确诊的人体BM在许多情况下显示了PAM通路的激活,但激活模式相当不均一(图3B)。结合生物传感器研究和一项临床试验显示,已确诊BM的MM患者对PI3K抑制剂反应不足,这为在不同时间表中实验测试GNE-317的BM抑制效果提供了明确的理论基础。我们假设PAM通路抑制剂对BM形成的早期、决定命运的步骤有最强的影响,在这些步骤中PAM通路可能发挥最相关和一致的作用。

图3:已确诊的人类BM中Akt和mTOR信号通路。
(4) PI3K/mTOR双重抑制对体外和体内黑色素瘤细胞的影响
接下来我们进行了体外和体内研究,以调查PAM通路抑制与BM形成的相关性。为了验证脑穿透双PI3K/mTOR抑制剂GNE-317在体内的靶向活性,进行了活体显微镜观察,发现在活体小鼠大脑中转移性癌细胞中存在特定的PAM通路抑制(图4A)。由于癌细胞的增殖能力决定了大规模转移的形成,进行了实时细胞分析增殖试验,结果显示,在GNE-317处理的H1和A2058黑色素瘤细胞中(图4B),以及在来自人类BM的原代黑色素瘤细胞系中(补充图未展示),增殖呈剂量依赖性减少。通过使用GNE-317进行体外处理,凋亡细胞的比例增加(补充图未展示)。接下来,我们研究使用脑渗透双PI3K/mTOR抑制剂GNE-317抑制PAM是否对临床前环境中BM形成的早期步骤有效(图4C)。通过反复活体多光子显微镜观察A2058黑色素瘤细胞(表达细胞质RFP和核GFP),在转移级联的每一步都可以检测到细胞的增殖和存活(图4D)。当小鼠在早期(从第4天开始)接受GNE-317治疗时,与模拟治疗的对照组相比,生长速率显著降低,个别微转移病灶的存活率也显著降低(图4E,F)。这些数据证实,高、最大耐受剂量的GNE-317 (25 mg/kg/d)能够对整个脑转移级联产生有意义的影响,并从大脑定植的最初步骤起就靶向黑素瘤细胞。

图4:PI3K/mTOR双抑制剂对体外和体内黑色素瘤细胞的影响。
(5) PAM通路抑制剂对脑转移的显著预防作用
我们研究了早期应用一种培养基甚至极低剂量的GNE-317是否能在两种黑色素瘤BM模型中实现体内预防BM。使用长期重复的室内多光子显微镜,监测了四组小鼠的BM发展情况:在中(12.5 mg/kg/d)或低(2.5 mg/kg/d)剂量预防性方案中接受GNE-317的小鼠与在BM已经形成时开始接受中剂量(12.5 mg/kg/d)治疗方案的小鼠(图5A)。然后用小鼠模型来检验这个假设。高血糖是PAM抑制剂常见的临床副作用。与对照组相比,中剂量的GNE-317导致我们小鼠模型的血糖显著升高(图5B)。相比之下,低剂量的GNE-317对血糖水平没有显示出任何显著的影响,这表明降低剂量确实可以减少PAM通路抑制剂的关键副作用。
在心内注射后第28天,活体多光子显微镜显示,H1和A2058模型的脑膜尺寸在预防计划中减小(图5C)。两组预防方案似乎都有效地阻止了小微转移期的转移(图5D)。对肿瘤形成4周内肿瘤生长速率的量化显示,与对照组相比,两种预防计划确实有效地阻止了肿瘤细胞增殖,在第一周效果最强,甚至可观察到肿瘤体积的暂时减少(图5E)。低剂量和中剂量预防方案组的BM生长抑制效果相当(图5E)。第二个H1黑色素瘤模型证实了预防低剂量的强烈影响(补充图未展示)。与预防方案的结果相反,12.5 mg/kg/d的GNE-317治疗已建立的转移瘤仅对已建立的脑转移瘤的生长产生中等影响(图5C-E),这与使用PI3K抑制剂buparlisib治疗MM患者时对已建立的脑转移瘤无反应一致。这些数据表明,在大脑定植的早期阶段开始使用GNE-317低剂量给药具有显著的好处。
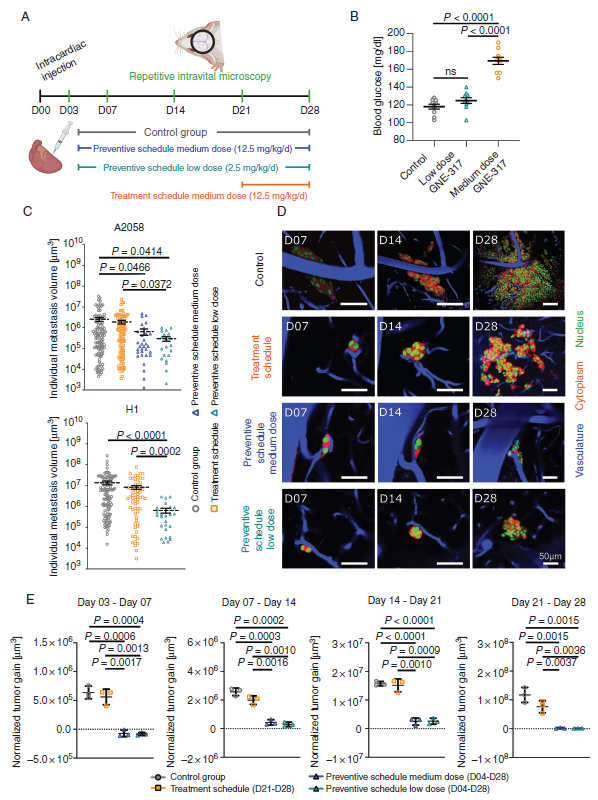
图5:预防vs治疗计划。
接下来,揭示双PI3K/mTOR抑制影响的脑转移级联的确切步骤。当比较注射后3天血管停止到实验结束期间转移病灶的总体生存期时,低剂量预防计划导致转移病灶数量随着时间的推移而减少(图6A)。对照组和治疗组(治疗从第21天开始)之间没有观察到显著差异(图6A)。在第3天和第7天之间观察到预防性计划对转移病灶数量的最强减少(图6A)。与对照组相比,在低剂量预防组中,黑色素瘤细胞外溢到第7天的数量较少(图6B,C)。追踪每个转移病灶的去向发现,与对照组相比,预防治疗组小鼠血管周围小龛中A2058黑色素瘤细胞的数量显著减少(32.1% vs 77.1%),同时形成较少的BM (20.2% vs 63.7%)(图6D)。这在第二个黑色素瘤模型中得到了证实(图6D)。在低剂量预防组与治疗组之间也发现了类似的差异(补充图未展示)。由于治疗组的双PI3K/mTOR抑制只在外渗后才开始,因此该组可视为本实验的第二个独立对照组。因此,预防性治疗的效果是双重的:血管外渗和血管周围生态位的早期定位点都受到PAM通路抑制的影响(图6B-D)。在中剂量预防计划组和低剂量预防计划组之间,已确定转移的形成再次没有显著差异(补充图未展示)。
最后,通过纵向全身生物发光成像和一项生存研究来证实PAM通路抑制的抗转移作用。预防方案中低剂量的GNE-317显著减少了脑内外的转移负担,然而,观察到对颅内转移的作用最强(图6E)。低剂量预防计划显示了特别强的生存效益(图6F)。停止给药GNE-317后,转移瘤生长加速(补充图未展示),这说明持续低剂量给药可最大程度抑制脑转移瘤。
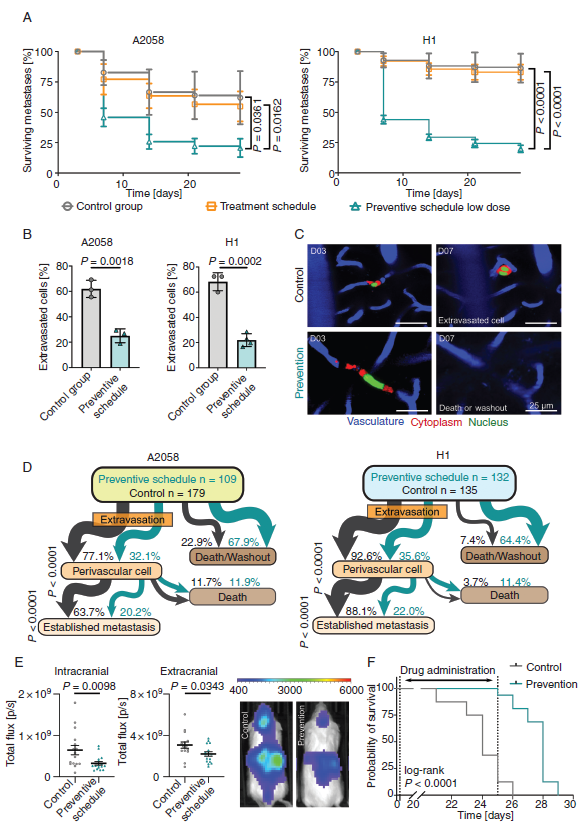
图6:脑转移级联的早期步骤最容易受到PAM通路的抑制。
结论:
总之,低剂量脑穿透性PI3K/mTOR双重抑制剂对预防脑转移尤其有效,使这种方法成为未来高危MM患者脑转移预防试验的可行之路。通过一种耐受性良好的药物,可长期服用,有效地预防脑转移,可能会在未来对癌症患者产生真正的影响。
参考文献:
Tehranian, C., Fankhauser, L., Harter, P. N., Ratcliffe, C., Zeiner, P. S., Messmer, J. M., Hoffmann, D. C., Frey, K., Westphal, D., Ronellenfitsch, M. W., Sahai, E., Wick, W., Karreman, M. A., & Winkler, F. (2022). The PI3K/Akt/mTOR pathway as a preventive target in melanoma brain metastasis. Neuro-oncology, 24(2), 213–225. https://doi.org/10.1093/neuonc/noab159.






