m6A修饰的lncRNA ARHGAP5-AS1参与肝细胞癌的进展
肝细胞癌(HCC)在全球导致癌症相关死亡的恶性肿瘤中排名第四。lncRNA是肝癌发生的关键模式。作为最常见的mRNA修饰形式,m6A通过影响mRNA代谢的多个方面来调节基因表达。然而,目前还没有关于肝癌中m6A甲基化lncRNA的全基因组筛选和功能注释的报道。在系统分析了HCC细胞的m6A-seq数据后,我们确定了22个具有明显失调的m6A水平的候选lncRNAs。在这些lncRNAs中,我们发现ARHGAP5-AS1是m6A修饰水平最高的lncRNA,并且在HCC标本中表达显著增加。METTL14作为ARHGAP5-AS1的m6A writer,IGF2BP2作为m6A reader稳定lncRNA。ARHGAP5-AS1在体内外显著促进HCC细胞的恶性行为。我们在HCC中发现CSDE1作为lncRNA的相互作用蛋白,TRIM28作为CSDE1的E3连接酶。有趣的是,ARHGAP5-AS1可以减弱CSDE1和TRIM28之间的相互作用,这通过泛素蛋白酶体途径阻止CSDE1的降解。CSDE1水平的升高协调致癌RNA调节,促进VIM和RAC1的翻译,激活ERK通路,这有助于HCC的预后。我们的研究揭示了m6A修饰的lncRNA控制CSDE1介导的致癌RNA调控的新模式,并强调lncRNA是未来治疗HCC的潜在靶点。本文于2022年10月发表于“Clinical and Translational Medicine”(IF=8.554)上。
技术路线

结果
1)m6A修饰的ARHGAP5-AS1由METTL14和IGF2BP2控制
为了鉴定在HCC进展中被m6A修饰的lncRNA,我们系统分析了METTL14沉默或不沉默的HepG2细胞的m6A-seq数据(图1A)。HepG2细胞中有22个lncRNA具有显著差异的m6A修饰。在这些lncRNA中,8个lncRNAs(ARHGAP5-AS1、LINC00152、C1QTNF1-AS1、LINC00969、USP27X-AS1、NDUFB2-AS1、TEN1-CDK3和ABALON)的水平与TCGA肝癌(LIHC)患者的预后显著相关。我们验证了这些候选lncRNA在HCC细胞中的m6A修饰水平(图1B)。m6A RIP分析表明ARHGAP5-AS1是肝癌细胞中m6A修饰水平最高的lncRNA。通过在HepG2中使用m6A-seq和SRAMP算法,我们鉴定了ARHGAP5-AS1 RNA的三个潜在m6A位点(876A、890A和928A)(图1C)。随后的m6A特异性RIP偶联RT-qPCR分析表明,与异位表达WT ARHGAP5-AS1的细胞相比,异位表达ARHGAP5-AS1突变体3的细胞中ARHGAP5-AS1 RNA的m6A水平显著降低(图1D,E)。我们接下来研究了我们HCC患者队列中的m6A-ARHGAP5-AS1 RNA水平,发现肿瘤的m6A-ARHGAP5-AS2 RNA水平明显高于正常组织(图1F)。细胞中沉默METTL14后(图1G),我们观察到m6A修饰水平和ARHGAP5-AS1的表达水平明显降低(图1H,I)。与此一致,METTL14和ARHGAP5-AS1在HCC组织和正常肝组织中的表达存在显著相关性(图1J)。RIP-qPCR测定表明,IGF2BP2是与HCC细胞中ARHGAP5AS1具有最高结合亲和力的阅读蛋白(图1K)。IGF2BP2的沉默显著降低了HCC细胞中ARHGAP5-AS1的内源性水平(图1L,M)。总之,这些数据阐明METTL14作为ARHGAP5-AS1的m6A写入器,IGF2BP2作为其m6A读取器,稳定HCC细胞中ARHGAP5-AS1。

2)ARHGAP5-AS1在体外和体内促进HCC细胞增殖
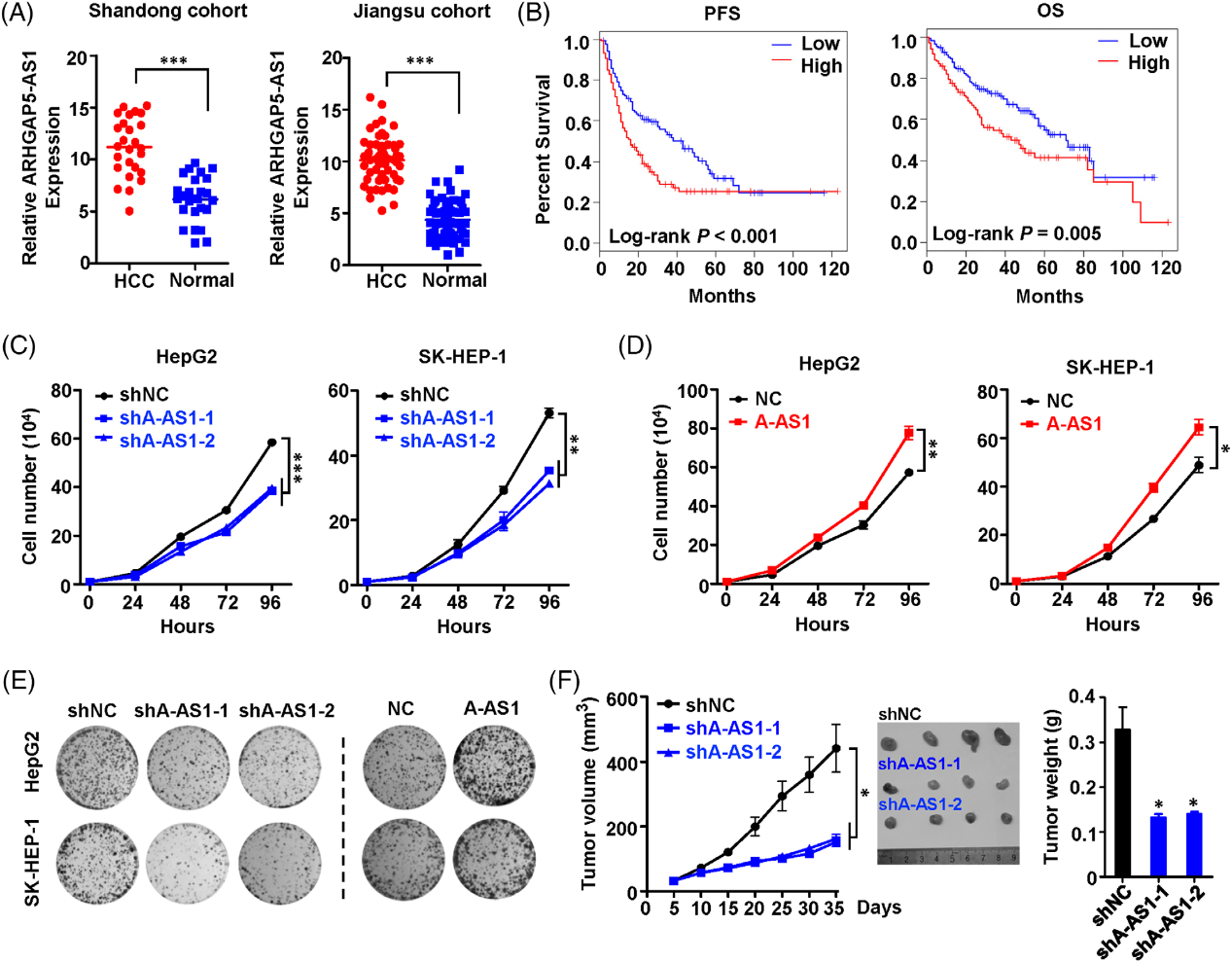
为了探讨ARHGAP5-AS1在肝癌发生中的作用,我们首先在山东队列和江苏队列的HCC标本和配对正常组织中检测了其水平(图2A)。与山东队列或江苏队列中的正常肝脏样本相比,HCC组织中ARHGAP5-AS1明显上调(图2A)。HCC标本中高ARHGAP5-AS1水平与无进展生存期(PFS)或总生存期(OS)的缩短相关(图2B)。为了揭示ARHGAP5-AS1在HCC中的生物学意义,我们开发了稳定的ARHGAP5AS1-KD HepG2和SK-HEP-1细胞和稳定的ARHGAP5-AS1-OE HCC细胞。如图2C所示,与对照组相比,稳定的ARHGAP5-AS1-KD明显抑制了HCC细胞株的增殖。稳定的ARHGAP5-AS1OE可显著增强HCC细胞增殖(图2D)。集落形成结果也支持ARHGAP5-AS1在HCC中的致癌作用(图2E)。然后我们在体内检测了ARHGAP5-AS1的致癌功能。我们发现,与对照异种移植相比,ARHGAP5-AS1-KD HCC异种移植生长明显缓慢(图2F)。与对照组相比,ARHGAP5-AS1-KD组的肿瘤重量也明显降低(图2F),这支持ARHGAP5-AS1在HCC中的致癌作用。
3)ARHGAP5-AS1降低HCC细胞的迁移、侵袭和转移能力
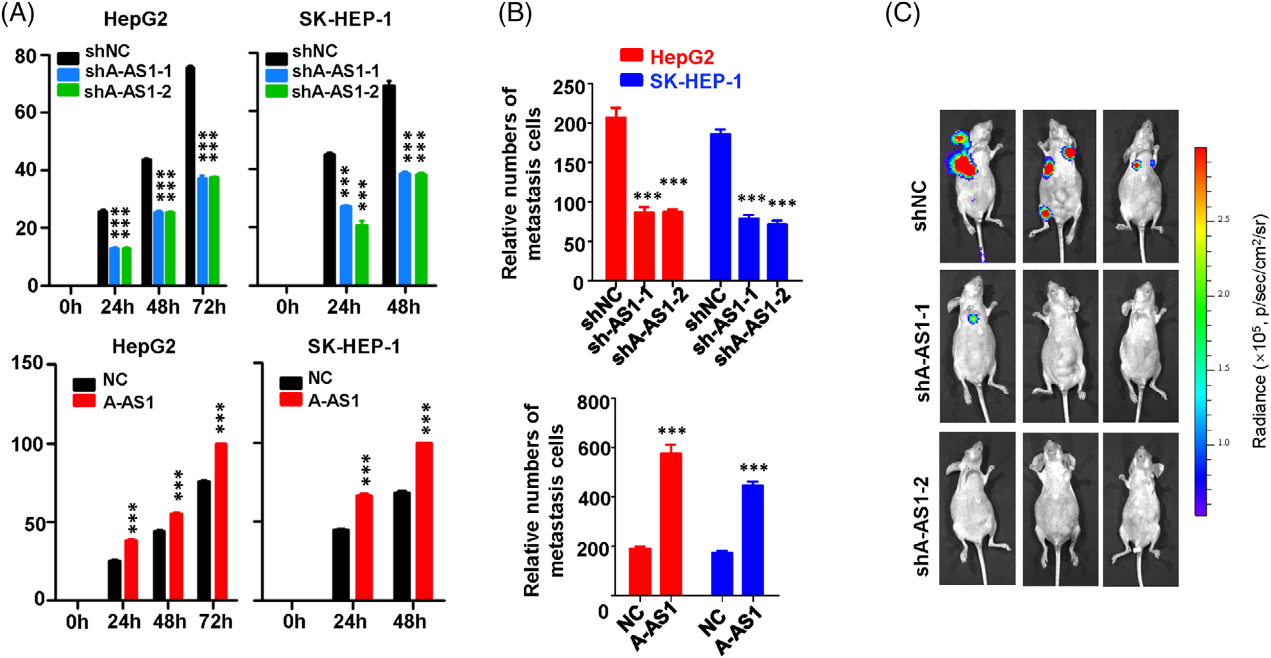
我们评估了ARHGAP5-AS1在体外和体内HCC细胞转移行为中的作用。ARHGAP5-AS1的稳定沉默显著削弱了HepG2或SK-HEP-1细胞的细胞运动性(图3A)。相反,ARHGAP5-AS1的强制表达促进了HepG2或SK-HEP-1细胞的迁移(图3B)。Matrigel侵袭试验表明ARHGAP5-AS1-KD损害了HCC细胞的侵袭(图3B)。相反,ARHGAP5-AS1的过表达加速了HCC细胞的侵袭(图3B)。体内HCC转移结果显示,注射恶性细胞后,ARHGAP5AS1的沉默可显著损害HCC细胞的肺和其他器官的远处转移(图3C)。总之,这些数据表明ARHGAP5-AS1可以增强体内外HCC细胞的运动性和侵袭性。
4)ARHGAP5-AS1通过蛋白酶体抑制CSDE1降解
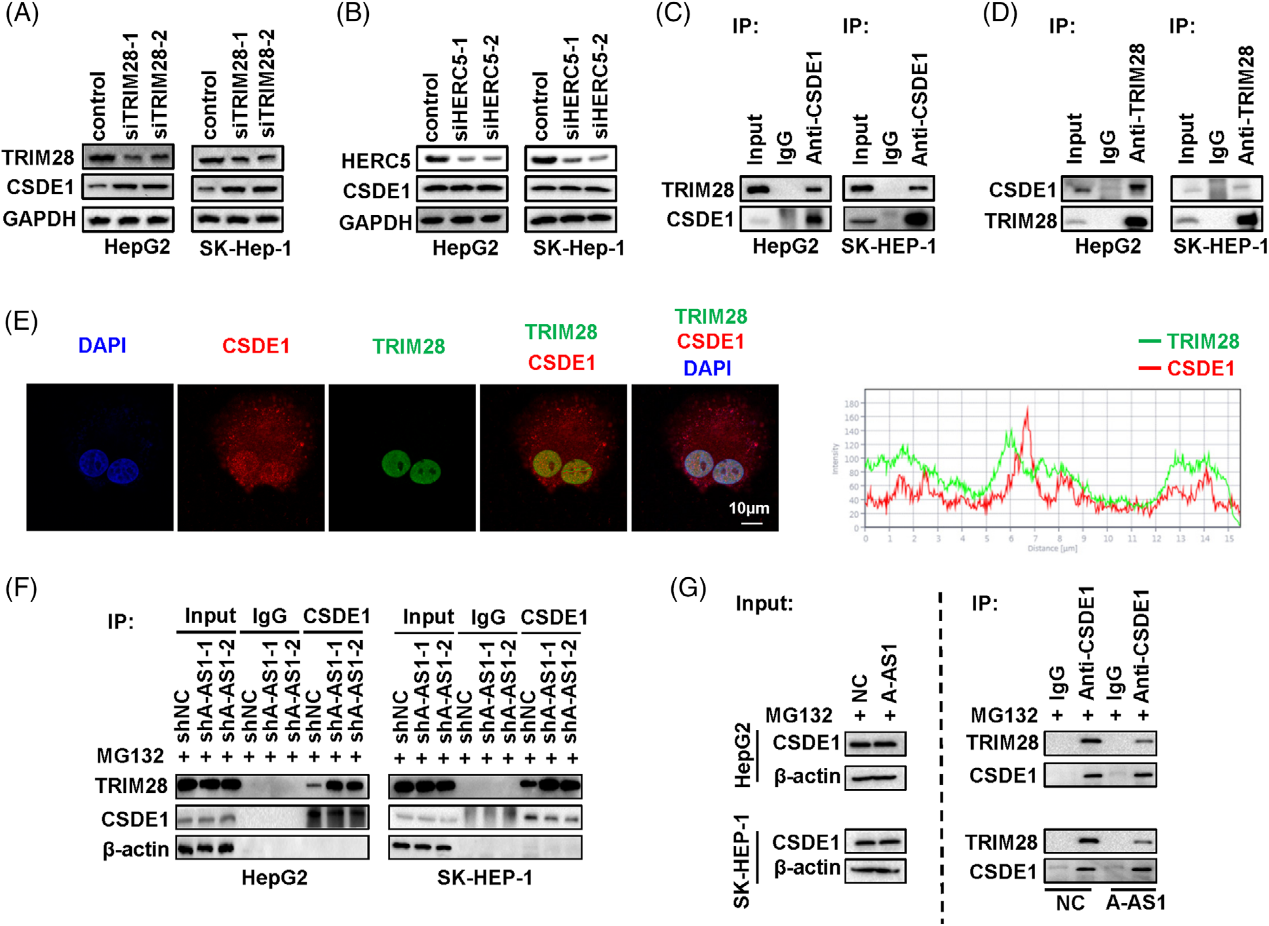
越来越多的证据表明,lncRNA在肿瘤发生过程中可能通过与各种蛋白质相互作用发挥作用。因此,我们假设ARHGAP5-AS1可能作为结合某些蛋白质的支架来促进HCC的发展。为了验证这一点,我们检查了ARHGAP5-AS1的细胞定位,发现ARHGAP5-AS1几乎同样存在于HCC细胞的细胞核或细胞质中(图4A)。使用质谱蛋白质组学,我们鉴定了多种癌症相关蛋白,包括CSDE1、ZC3HAV1、CCT8、CKAP4、PARP1、PEG10和APEX1在HepG2中的表达。在HCC细胞中进行了独立检测,并成功验证了这些候选蛋白中的CSDE1(图4B)。与此一致,HCC细胞系中RNA-CSDE1复合物中存在显著的ARHGAP5-AS1富集(图4C)。为了探索lncRNA与CSDE1相互作用所需的特定结构域,我们随后构建了各种截短的CSDE1(图4D),并发现CSDE1 RNA结合基序2(aa450-525)是ARHGAP5-AS1与蛋白质相互作用所必需的(图4E)。有趣的是,ARHGAP5-AS1的沉默显著抑制了HCC细胞中的CSDE1蛋白水平(图4F)。相反,过表达的ARHGAP5-AS1显著上调了HepG2和SK-HEP-1细胞中的CSDE1蛋白(图4F)。与对照HCC细胞相比,MG132处理ARHGAP5-AS1-KD HCC细胞增加了内源性CSDE1蛋白的表达(图4G)。相反,MG132消除了ARHGAP5-AS1诱导的HCC细胞中CSDE1蛋白的上调(图4G),说明lncRNA可能调节CSDE1的蛋白酶体降解。为了证实这一点,我们接下来检测了用蛋白质合成抑制剂CHX处理过的HepG2和SK-HEP-1细胞中CSDE1的表达。Western Blot的结果表明,稳定的ARHGAP5-AS1-KD HCC细胞中CSDE1的蛋白质水平下降速度比对照细胞中的快得多(图4H)。相反,用CHX处理过表达ARHGAP5-AS1的HCC细胞导致CSDE1蛋白的半衰期明显长于对照细胞(图4I)。然后,我们研究了ARHGAP5-AS1控制的CSDE1降解是否由CSDE1的泛素化介导。与对照组相比,稳定的ARHGAP5-AS1-KD HCC中观察到CSDE1蛋白的泛素水平明显增加(图4J)。与此一致,与对照组相比,过表达ARHGAP5-AS1的细胞中CSDE1的泛素化降低(图4J)。总之,这些结果阐明了ARHGAP5-AS1通过抑制CSDE1蛋白的蛋白酶体降解来稳定CSDE1蛋白。

5)ARHGAP5-AS1阻断CSDE1与其E3连接酶TRIM28的相互作用
为了揭示ARHGAP5-AS1如何延缓CSDE1的蛋白酶体降解,我们通过质谱系统地评估了由CSDE1在HepG2细胞中沉淀的蛋白质。在所有鉴定的蛋白质中,只有两种E3连接酶(TRIM28和HERC5)。为了确认TRIM28或HERC5是否是CSDE1的E3连接酶,我们首先检测了TRIM28和HERC5沉默的HCC细胞中的CSDE1水平(图5A,B)。在敲除TRIM28表达后,与对照细胞相比,在HCC细胞中检测到升高的CSDE1蛋白水平(图5A)。然而,HERC5沉默后,没有观察到这种表达变化(图5B)。内源性TRIM28可以在HepG2或SK-HEP-1细胞中与CSDE1免疫沉淀(图5C)。内源性CSDE1也可以用TRIM28在HepG2或SK-HEP-1细胞中沉淀(图5D)。免疫荧光分析显示,TRIM28和CSDE1在HCC细胞中表现出明显的共定位(图5E)。我们接下来研究ARHGAP5-AS1是否影响HCC细胞中CSDE1与TRIM28的结合。与对照组相比,稳定的ARHGAP5-AS1-KD HepG2或SK-HEP-1细胞中的CSDE1可以沉淀更多的TRIM28蛋白(图5F)。相反,与对照细胞相比,稳定的ARHGAP5AS1-OE HCC细胞中用CSDE1沉淀的TRIM28蛋白较少(图5G)。总之,这些发现表明ARHGAP5-AS1通过减弱CSDE1与TRIM28的相互作用来促进CSDE1的稳定。
6)ARHGAP5-AS1-CSDE1轴促进HCC细胞中VIM和RAC1的蛋白表达以及ERK的磷酸化
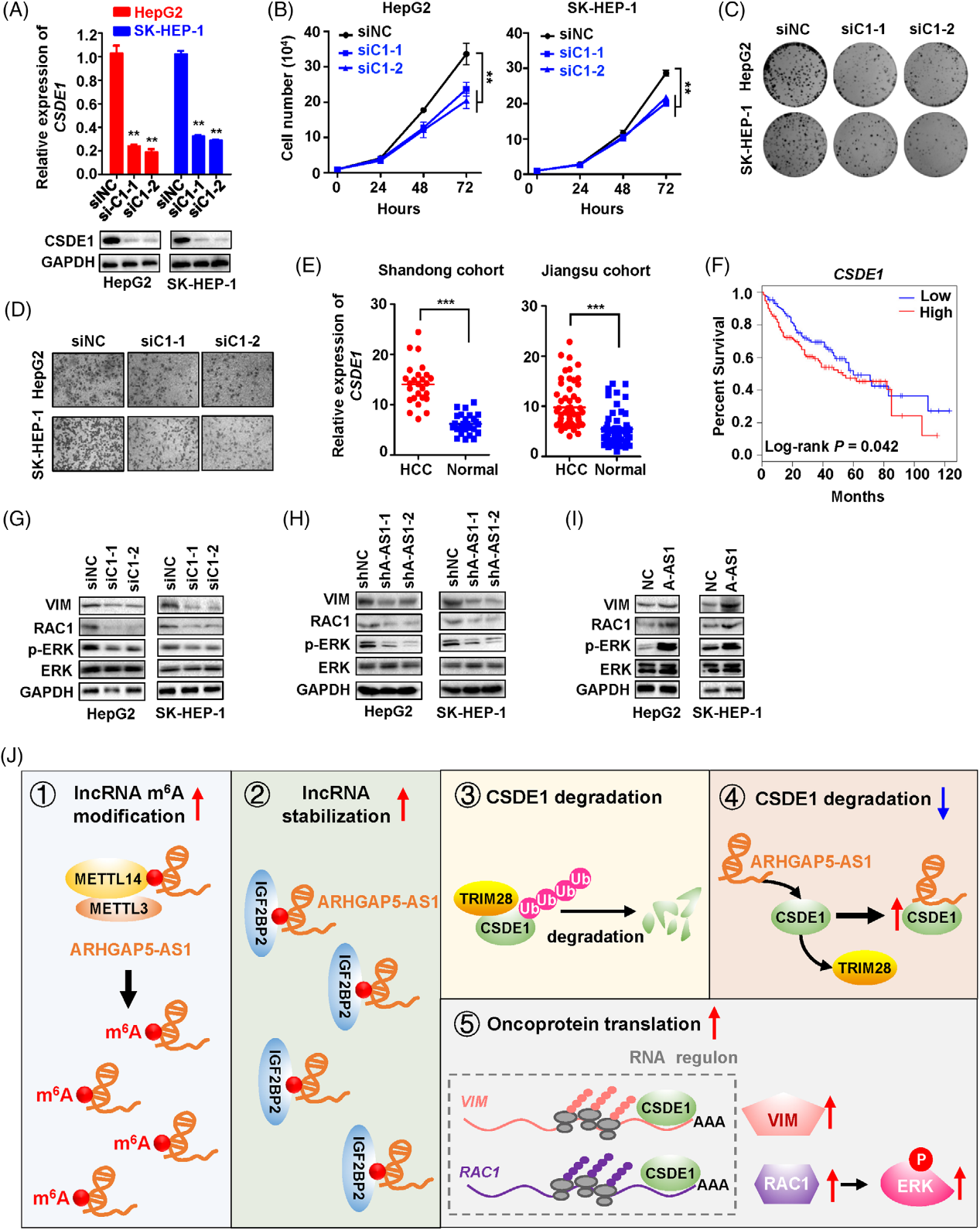
多条证据表明,RNA结合蛋白CSDE1在癌症中充当癌基因,并在转录后水平调节mRNA的翻译和稳定性。事实上,CSDE1的沉默显著抑制了HCC细胞的增殖和克隆形成(图6A–C)。transwell分析表明CSDE1的siRNA可以显著抑制HCC细胞的侵袭能力(图6D)。与这些数据一致,在两个队列中,与正常样本相比,HCC组织中的CSDE1表达显著升高。TCGA LIHC队列中CSDE1异常高表达与患者OS明显缩短相关(图6F),表明CSDE1在HCC中的致癌性质。在CSDE1沉默后,我们观察到HCC细胞中VIM(Vimentin)和RAC1的蛋白水平明显降低(图6G)。同样,与对照组相比,稳定的ARHGAP5-AS1-KD HepG2或SK-HEP-1细胞中的VIM和RAC1表达下调(图6H);而异位ARHGAP5-AS1表达显著提高了VIM和RAC1的表达(图6I)。有趣的是,ARHGAP5-AS1或CSDE1的敲除降低了细胞中ERK1/2(Thr202/Tyr204)的磷酸化(图6G,H)。异位ARHGAP5-AS1明显增强了细胞中ERK1/2磷酸化(图6I)。总之,这些数据证明了ARHGAP5-AS1在稳定CSDE1蛋白、促进VIM和RAC1翻译以及激ERK信号传导方面的作用(图6J)。
结论:
我们发现由于ARHGAP5-AS1的高m6A甲基化水平,lncRNA表达显著升高,加速VIM和RAC1的翻译,并刺激ERK信号通路,从而促进细胞增殖和转移。我们研究揭示了m6A修饰的lncRNA控制CSDE1介导的致癌RNA调控的新模式,并强调lncRNA是未来治疗HCC的潜在靶点。
参考文献:
Liu J, Zhang N, Zeng J, Wang T, Shen Y, Ma C, Yang M. N6 -methyladenosine-modified lncRNA ARHGAP5-AS1 stabilises CSDE1 and coordinates oncogenic RNA regulons in hepatocellular carcinoma. Clin Transl Med. 2022 Nov;12(11):e1107. doi: 10.1002/ctm2.1107.






