lnc-CHAF1B-3促进肾间质纤维化
肾间质纤维化(RIF)是慢性肾脏疾病的常见病理表现。管状上皮细胞的上皮-间充质转化(EMT)被认为是RIF的主要原因。尽管lncRNAs被报道参与了各种病理生理过程,但lncRNA在RIF进展中的作用和潜在的分子机制尚不清楚。在本研究中,我们研究了lncRNA在RIF中的功能。微阵列分析显示,TGF-b1和缺氧刺激使人肾近端小管细胞中lnc-CHAF1B-3的表达显著上调,伴随EMT相关基因的表达增加。敲低lnc-CHAF1B-3可显著抑制TGF-b1诱导的I型胶原α 1、钙粘蛋白-2、纤溶酶原激活物抑制物-1、SNAI1和SNAI2的上调表达。对IgA肾病患者石蜡包埋肾活检样本的qPCR分析显示,lnc-CHAF1B-3表达与尿蛋白水平呈正相关,与估计的肾小球滤过率呈负相关。原位杂交结果显示lnc-CHAF1B-3仅在近端小管表达。这些发现表明lnc-CHAF1B-3通过调节EMT相关信号来影响RIF的进展。因此,lnc-CHAF1B-3是治疗RIF的潜在靶点。本文于2022年12月发表于“Molecular Therapy-Nucleic Acids”(IF=10.183)上。
技术路线

结果
1)TGF-b1刺激和缺氧上调lnc-CHAF1B-3的表达
为了鉴定与肾纤维化相关的lncRNA,lncRNA和mRNA微阵列分析使用了永生化人近端小管细胞(HK-2)和原代培养的人肾近端TECs (RPTECs),这些细胞经TGF-b1 (10 ng/mL)处理或暴露于缺氧(1% O2)(图1A)。基因集富集分析(GSEA)证实与TGF-b信号通路和缺氧相关的基因集,以及与EMT相关的基因在TGF-b1或缺氧处理的细胞中显著富集(图1B)。差异表达的lncRNA在图1C的热图中显示。共鉴定出21470个lncRNA。维恩图显示,5种lncRNA (lncCHAF1B-3, lnc-CHAF1B-2, MIR181A2HG, LOC100507487和LINC01638)普遍上调(图1A,1D)。由于lnc-CHAF1B-3表达上调幅度较大,且目前尚无关于其功能的报道,我们决定进一步研究。
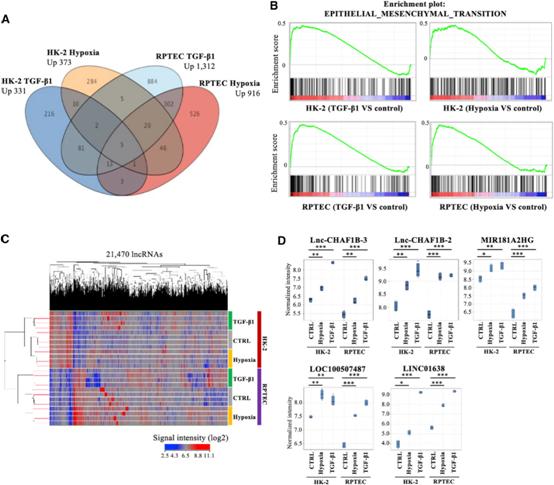
2)lnc-CHAF1B-3的敲除抑制了TGF-b1诱导的HK-2细胞反应
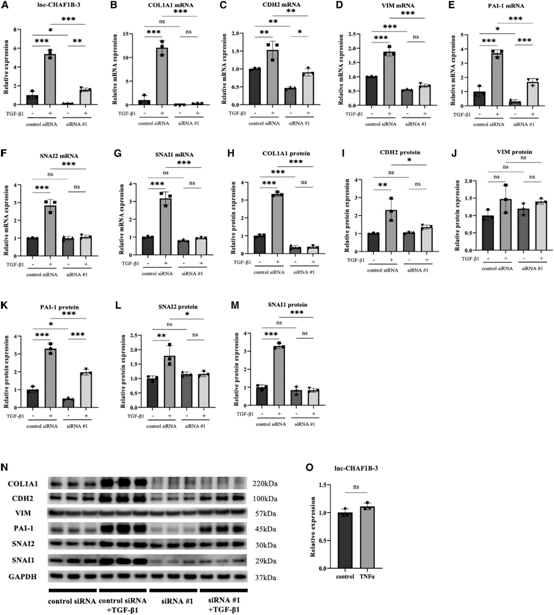
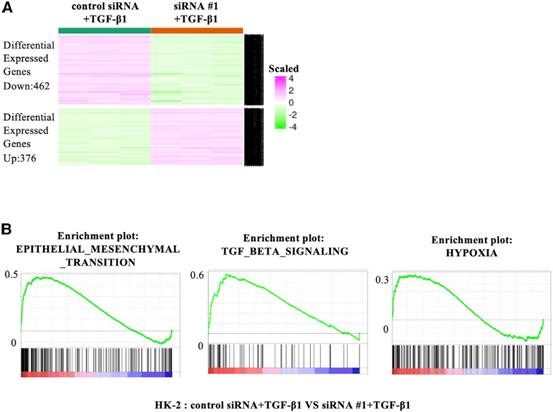
通过qRT-PCR分析,lnc-CHAF1B-3在TGF-b1处理的HK-2细胞中表达上调(图2A)。与mRNA芯片结果一致,在TGF-b1处理的HK-2细胞中,COL1A1、CDH2、PAI-1、SNAI1和SNAI2的mRNA和蛋白水平也被证实显著升高(图2B、2C、2E-2I和2K-2N)。为了研究lncCHAF1B-3在肾近端小管细胞中的作用,我们使用了两种不同的siRNAs和一种靶向lncCHAF1B-3的反义寡核苷酸(ASO)。siRNA #1在对照组和TGF-b1处理的HK-2细胞中均显著下调lnc-CHAF1B-3的表达(图2A)。同时,与siRNA转染的对照细胞相比,转染siRNA #1的细胞经TGF-b1处理后COL1A1、CDH2、PAI-1、SNAI1和SNAI2 mRNA和蛋白水平的上调被显著抑制(图2B、2C、2E-2I和2K-2N)。在波形蛋白(VIM)方面,虽然通过敲除lnc-CHAF1B-3,TGF-b1诱导的VIM mRNA表达显著降低,但蛋白水平未见明显变化(图2D、2J、2N)。此外,我们还进行了RNA测序(RNA-seq)实验。GSEA表明,在TGF-b1刺激的HK-2细胞中,siRNA #1和siRNA #2敲除lnc-CHAF1B-3显著降低了与EMT、TGF-b信号和缺氧相关的基因集。此外,每种siRNA显著改变的前20个基因集中,有14个基因集是常见的(图3)。为了确定lnc-CHAF1B-3是否也参与炎症信号,我们用TNF-a刺激HK-2细胞。在TNF-a处理的HK-2细胞中,CDH1的mRNA水平被显著抑制。然而,TNF-a刺激并没有增加lnc-CHAF1B-3和EMT相关基因的表达(图2O)。这些结果表明lnc-CHAF1B-3参与了TGF-b1诱导的EMT程序。
3)Lnc-CHAF1B-3敲除抑制TGF-b1诱导的RPTECs反应
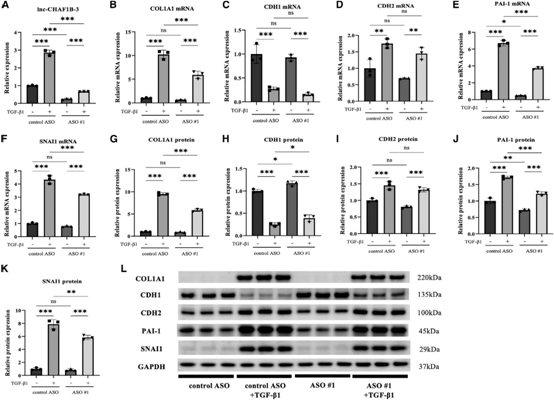
为了进一步探索lnc-CHAF1B-3在肾近端小管细胞中的作用,我们对RPTECs进行了类似的实验。与对照细胞相比,TGF-b1处理的RPTECs中 lnc-CHAF1B-3表达显著增加(图4A)。在TGF-b1处理的RPTECs中,COL1A1、CDH2、PAI-1和SNAI1的mRNA和蛋白水平也显著升高(图4B、4D-4G和4I - 4L)。而敲除lnc-CHAF1B-3后,COL1A1、PAI-1和SNAI1 mRNA和蛋白的表达显著降低(图4B、4E-G和4J-4L)。TGF-b1处理后CDH1蛋白水平明显下降,但lnc-CHAF1B-3敲除后恢复(图4H和4L)。这些结果表明lnc-CHAF1B-3参与了肾TECs中的EMT相关信号通路,并可能在肾纤维化的发展中发挥重要作用。
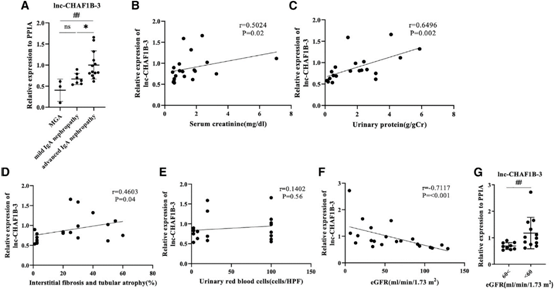
4)IgA肾病患者肾活检组织中lnc-CHAF1B-3的表达
为了进一步探讨lnc-CHAF1B-3在人类肾脏疾病中的作用,我们对IgA肾病患者的肾脏标本进行了回顾性分析。如图5A所示,通过qRT-PCR检测发现lnc-CHAF1B-3在晚期病例中的表达明显高于轻症病例。作为健康对照组的替代,我们还评估了3例病理诊断为轻度肾小球异常(MGAs)患者的肾脏标本,这些患者的肾功能相对保留,尿蛋白轻度与轻度IgA肾病相似(图5A)。结果发现MGA患者中lnc-CHAF1B-3的表达明显低于晚期IgA肾病患者。IgA肾病患者肾脏lnc-CHAF1B-3表达与血清肌酐(Cre)、尿蛋白水平、间质纤维化和肾小管萎缩(IF/TA)显著正相关。然而,lnc-CHAF1B-3的表达与尿红细胞之间未观察到显著相关(图5B-5E),但在估计的肾小球滤过率(eGFR)与lnc-CHAF1B-3的表达之间观察到显著负相关(图5F)。此外,根据eGFR临界值60 mL/min/1.73 m2(定义为CKD),将所有病例分为eGFR保存组和受损组,受损组lnc-CHAF1B-3的表达水平明显高于eGFR保留组(图5G)。
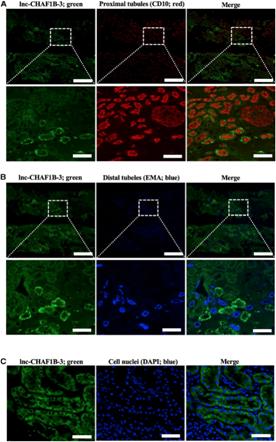
为了研究lnc-CHAF1B-3在病变人类肾脏中的定位和作用,对肾活检标本进行lnc-CHAF1B-3多重免疫荧光标记。lnc-CHAF1B-3(绿色)和CD10(红色,图6A)、EMA(蓝色,图6B)或DAPI(蓝色,图6C)的双标记显示,在近端小管的细胞质中观察到lncCHAF1B-3。
结论:
本研究报道lnc-CHAF1B-3在肾纤维化的发展中起重要作用。lnc-CHAF1B-3可能是治疗肾纤维化的潜在靶点。
参考文献:
Imai K, Ishimoto T, Doke T, Tsuboi T, Watanabe Y, Katsushima K, Suzuki M, Oishi H, Furuhashi K, Ito Y, Kondo Y, Maruyama S. Long non-coding RNA lnc-CHAF1B-3 promotes renal interstitial fibrosis by regulating EMT-related genes in renal proximal tubular cells. MolTher Nucleic Acids. 2022 Dec 23;31:139-150. doi: 10.1016/j.omtn.2022.12.011.






