多组学生信揭示结直肠癌肝转移的细胞间互作空间网络
肝脏是癌症最常见的转移部位。肝脏微环境被改造,以提供有利于结肠癌细胞生长的生态位,但这种改造的细胞转变仍不清楚。本文主要研究转移性结直肠癌(mCRC)肝肿瘤微环境(TME)的细胞变化特征。作者证明了肝脏中mCRC的特征是TME中巨噬细胞的转录改变;巨噬细胞和成纤维细胞之间的细胞间网络支持CRC在肝脏免疫抑制转移生态位中的生长。这些特征可用于靶向免疫检查点抵抗的MSS肿瘤。本文于2022年10月发表在《Clinical Cancer Research》。
技术路线:

主要实验结果:
1、CRC肝转移细胞TME的组分特征
如图1A所示,本研究依赖于三种不同的方法来表征结直肠癌转移性TME,包括单细胞测序分析,多维免疫荧光(IF)和反卷积细胞状态验证。单细胞测序结果的降维UMAP揭示大多数细胞簇都有来自不同样本的贡献(图1B),表明在聚类过程中没有明显的批次效应。根据所建立的特定细胞类型的标记基因的表达,将细胞类型进行注释聚类(图1C-D)。根据组织样本的大小,单细胞测序检测的细胞的绝对数量、类型和比例各不相同(图1E)。
此外,作者分析了转移性肿瘤上皮细胞的基因表达特征,以及肿瘤上皮细胞中非整倍体与染色体失衡特征,结果在附图中。
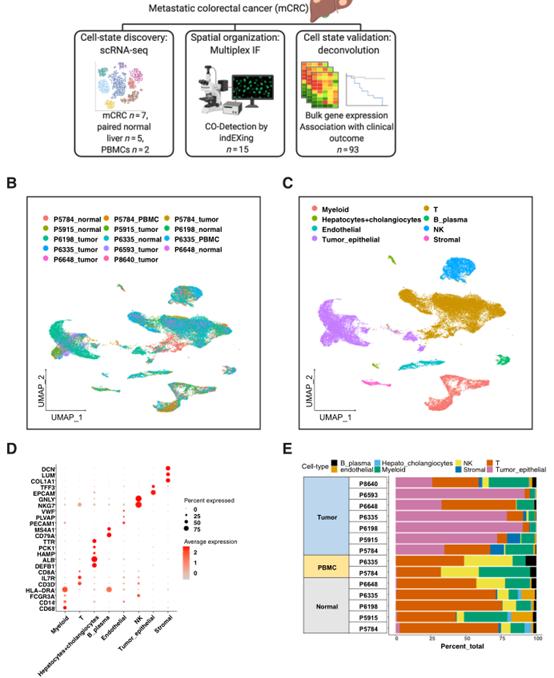
图1CRC肝转移细胞TME的组分特征
作者在二次聚类分析后检查了不同样本中的髓细胞群(图2A和2B)。髓细胞群具有与组织来源相关的簇。匹配的肝组织具有正常的髓细胞,存在于多个不同的簇中。匹配的外周血具有正常的单核细胞,这些单核细胞与其他巨噬细胞类型分开聚集,没有重叠。来自mCRC样品的巨噬细胞与匹配的正常肝组织巨噬细胞和外周单核细胞分开聚集。具体而言,mCRC巨噬细胞存在于簇1和簇3中(图2A和2B)。
随后,作者确定了哪些基因定义了特定的髓细胞簇。发现CD14或FCGR3A(CD16)阳性的PBMC单核细胞高度表达S100A家族基因(图2C)。树突状细胞表达HLA基因、CD1C、CLEC9A和IDO1等。肝内巨噬细胞包括正常库普弗细胞表达CD5L、MARCO、LIPA、MAF、VCAM1等。还发现SPP1高表达的肿瘤相关巨噬(TAM)细胞群,这些巨噬细胞存在于簇1和簇3中(图2C)。
作者比较了转移性TME巨噬细胞与正常肝组织中存在的其他巨噬细胞的基因表达特征(图2D)。SPP1+TAM的APOC1、APOE、TREM2、FN1、LGALS3、FTL、CD9、CTSB等表达水平升高。
作者应用不同的表达分析方法来确认这些重编程TME巨噬细胞的功能状态。使用enrichR程序,对TME巨噬细胞中差异表达的基因进行了通路分析,以确定它们调节的生物学相关过程。结果检测到与ECM组织和代谢相关的term显著富集。不同的代谢途径也被富集,包括糖脂代谢、葡萄糖代谢和高密度脂蛋白介导的脂质转运(图2E)。接下来,量化了泡沫巨噬细胞和肝硬化疤痕相关巨噬细胞的表达特征。与正常肝巨噬细胞相比,mCRC巨噬细胞对这两种基因特征都有显著富集(图2F)。这些结果与差异基因表达分析的结果重叠。

图2mCRC、正常肝脏和PBMC中的髓细胞谱系
使用重聚类和批量校正来表征肝脏mCRC微环境中存在的不同基质细胞。聚类分析显示,来自mCRC的基质细胞与正常肝脏中的基质细胞分离(图3A)。在不同的簇中,有三种主要的细胞类型,包括成纤维细胞、内皮细胞和肝星状细胞(HSC;图3B)。与mCRC相关的成纤维细胞存在于簇1和簇4中(图3B和和3C)。簇1仅包含来自mCRC的成纤维细胞,并且与正常肝组织的成纤维纤维细胞明显分离。这些细胞的特征是ECM相关基因,如参与胶原合成相关基因的表达升高,POSTN、FN1、MGP等(图3D)。因此,聚类1具有CAF的属性。
将一组CAF差异表达基因与“matrisome(基质组)”的成分进行了比较,“基质组”是指ECM的核心成分。基质组包括纤维连接蛋白、胶原、层粘连蛋白、蛋白多糖等,它们与ECM结构及其分泌有关(图3E)。CAFs具有基于几种胶原基因(COL1A1、COL3A1、COL5A1等)、各种ECM糖蛋白(FN1、POSTN、SPARC、THBS1等)和蛋白聚糖(BGN、VCAN等)的差异表达的基质组程序。这些CAFs细胞还高度表达ECM调节基因,包括MMP11、MMP14、TIMP1、LOXL1和LOXL2,这些基因参与ECM重塑。这些结果表明转移性TME中的成纤维细胞具有促进肿瘤的ECM表达特征。
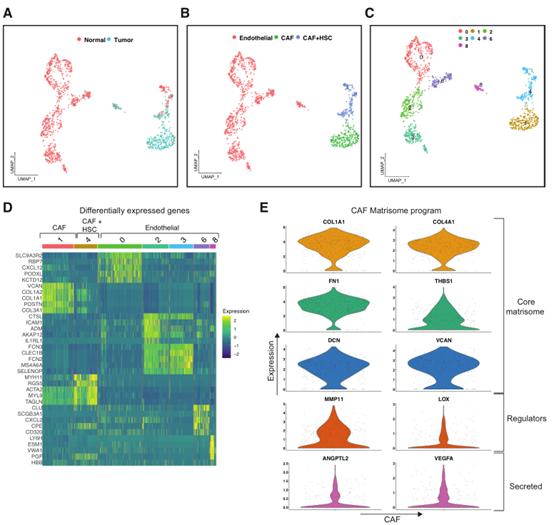
图3肝脏转移微环境中的基质细胞成分
作者提供的部分附图的结果显示,对于所有mCRC,来自CD8 T细胞的结果和Tregs的存在表明免疫抑制的TME缺乏抗肿瘤活性。并且,CAFs是TME中最多产的信息沟通者,在所有细胞间相互作用中占前10%,此外,TME成纤维细胞和巨噬细胞影响mCRC中的T细胞。
作者发现巨噬细胞和CAFs通过特定的受体-配体相互作用影响彼此的基因表达程序。首先,从TME中的细胞中鉴定了配体,这些配体可以导致mCRC CAFs中基质组基因的表达(图4A)。排名最高的基因之一是已建立的ECM调节基因TGFB1,它来源于NK细胞,验证了这种方法。一些配体来源于巨噬细胞,包括SPP1、IL1B、TNF、MMP9和CCL2。这些配体具有调节包括胶原家族在内的几个核心基质组基因的靶基因表达的潜力。巨噬细胞配体的其他CAF基质组靶基因包括MMP2和VEGFA。这一结果进一步支持了上述发现,即重编程的SPP1+巨噬细胞状态促进mCRC TME中的纤维化。此外,CAFs自身表达了几种配体,表明存在自分泌信号。这些配体包括AGT、TGFB3、CTGF、CCL2、FGF1、HGF、CXCL12和CSF1。
接下来,检测哪些配体可以导致重编程巨噬细胞状态,其特征为炎症纤维化和脂质代谢。排名靠前的配体包括FGF1、CSF1、PGF、TGFB3和TIMP1;均来源于CAFs(图4B)。这些配体可以靶向巨噬细胞并调节SPP1、FN1和APOE的表达。因此,来自CAFs的配体具有通过配体-受体相互作用重新编程mCRC巨噬细胞的潜力。总的来说,这些结果表明TME巨噬细胞和CAFs之间存在信号网络。这种细胞间通讯影响两种细胞类型的转录表型。

图4巨噬细胞和CAFs的互作网络影响其细胞状态
5、肝脏中mCRC TME的空间特征
为确定mCRC的空间细胞特征,使用CODEX多路成像。这种方法在组织切片上使用25 plex抗体panel,从而能够以单细胞分辨率进行细胞类型鉴定(图5A)。这种空间成像使我们能够提出关于肝脏mCRC TME中细胞类型和细胞邻近性的具体问题。
图像经过处理后,发现共有来自15个mCRC的330893个单细胞。首先使用Harmony算法的低分辨率批量校正聚类对这些细胞进行聚类。细胞簇有来自不同肿瘤的贡献,这一结果表明充分消除了批次效应(图5B)。基于抗体染色模式,鉴定了肿瘤上皮细胞、CAFs、巨噬细胞、内皮细胞、CD4 T细胞、CD8 T细胞和Tregs。通过比较相应的HE图像来验证细胞类型分配(图5C和5D)。不同的细胞类型在mCRC中具有不同的比例(图5E)。五个样本同时具有来自肿瘤不同部位的scRNA-seq和CODEX结果。
在确定了细胞类型后,作者检测了表征不同细胞状态的特定标志物的表达。这些标记物是从scRNA-seq结果中鉴定出来的。与其他细胞类型相比,TME巨噬细胞具有高表达的LGALS3;与其他细胞类型相比,CAFs具有高表达COL4A1(图5F-5G)。这些结果独立地证实了前面在scRNA-seq数据中发现的LGALS3–high SPP1+巨噬细胞。总的来说,这一结果为scRNA-seq分析提供了额外的支持,该分析确定了巨噬细胞和CAFs之间的细胞间通信。
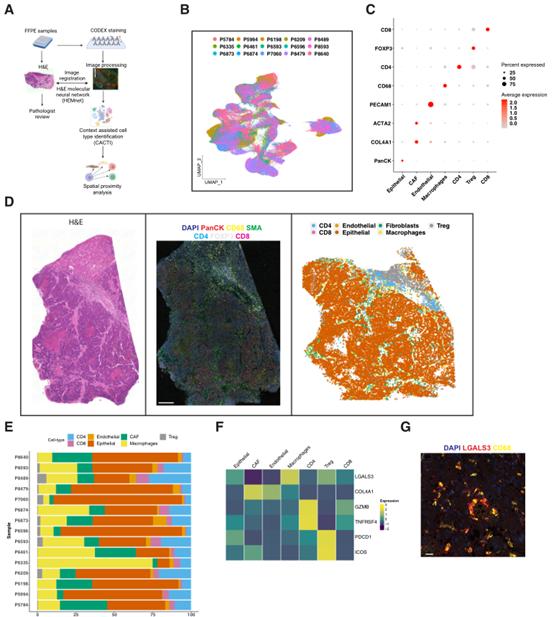
图5肝脏中mCRC TME的空间特征
6、独立mCRC数据集中CAFs对临床结果的影响
为验证单细胞测序的发现,分析了从肝脏切除的93个mCRC的RNA-seq数据。值得注意的是,这些肿瘤中96.6%是MSS。因此,肿瘤具有与用于scRNA-seq的队列相同的基于肝脏的TME特征。使用去卷积方法CIBERSORTx来推断该数据集中的细胞谱系部分。生成了每个细胞谱系的基因特征矩阵,该矩阵来源于肿瘤样本特异性细胞,同时排除了正常肝组织和PBMC(图6A)。该分析包括肿瘤上皮细胞和TME特异性CAF、SPP1+巨噬细胞、DC、内皮细胞、CD8 T、CD4 T、Treg、NK、B和浆细胞。将该特征矩阵应用于大量基因表达数据集导致每个样本的每个谱系的细胞级分的量化。成功获得了所有谱系的细胞分数。因此,肿瘤特异性单细胞特征可以在独立的mCRC基因表达数据集中成功地去卷积。作者还评估了CAF丰度对预后的影响。总生存率不良的CAFs比例显著较高(图6B)。因此,以大量CAF为特征的TME表型与较差的临床结果有关。
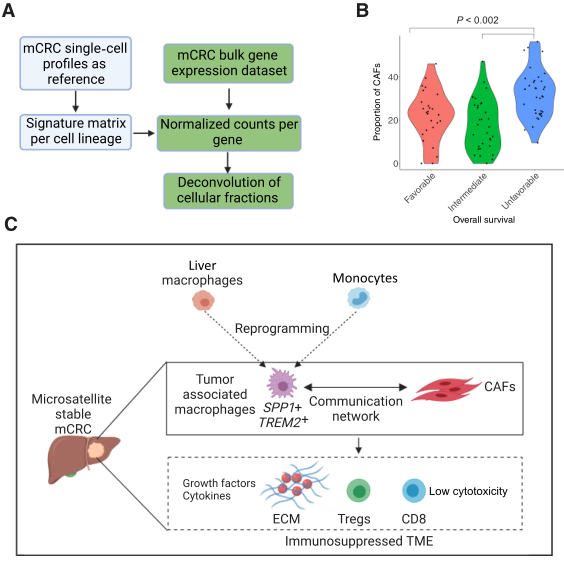
图6、独立mCRC数据集中CAFs对临床结果的影响
综上,本研究揭示了mCRC TME的一个新特征,即在肝转移中巨噬细胞和成纤维细胞之间存在细胞间网络;使用scRNA-seq,确定了这些细胞之间不同的通信程序,这些程序有可能相互影响它们的细胞状态;这一发现得到了空间分析的进一步支持,空间分析显示这些细胞之间的距离非常近;巨噬细胞成纤维细胞网络在含有Tregs的同时促进了缺乏抗肿瘤CD8 T细胞的免疫抑制TME;TME中成纤维细胞的增加与更差的患者结局有关(图6C)。巨噬细胞和成纤维细胞因此调节肝脏转移生态位,这代表了转移级联的“土壤”成分,可以进行肿瘤传播。
参考文献:
Sathe A, Mason K, Grimes SM, Zhou Z, Lau BT, Bai X, Su A, Tan X, Lee H, Suarez CJ, Nguyen Q, Poultsides G, Zhang NR, Ji HP. Colorectal Cancer Metastases in the Liver Establish Immunosuppressive Spatial Networking between Tumor-Associated SPP1+ Macrophages and Fibroblasts. Clin Cancer Res. 2023 Jan 4;29(1):244-260. doi: 10.1158/1078-0432.CCR-22-2041.






