基于聚集诱导发光的光动力治疗诱导癌细胞铁死亡和焦亡
光动力治疗(Photodynamic therapy, PDT)是对抗耐药性癌症的一种有前景的治疗手段。癌细胞中的脂滴在细胞代谢和信号传导中起着关键作用,且与多种抗癌药物的敏感性有关。铁死亡是一种由脂质过氧化物积累引起的细胞死亡方式,而焦亡则是一种通过炎症小体激活的细胞死亡方式。该研究开发一种新型的聚集诱导发光(Aggregation-induced emission, AIE)光诊疗剂(theranostic),它能够特异性地定位于肝癌细胞中的脂滴,并在光照射下同时产生活性氧,以诱导癌细胞通过铁死亡和焦亡两种方式死亡。该文章于2024年10月发表于《Chemical Engineering Journal 》,IF=13.3。
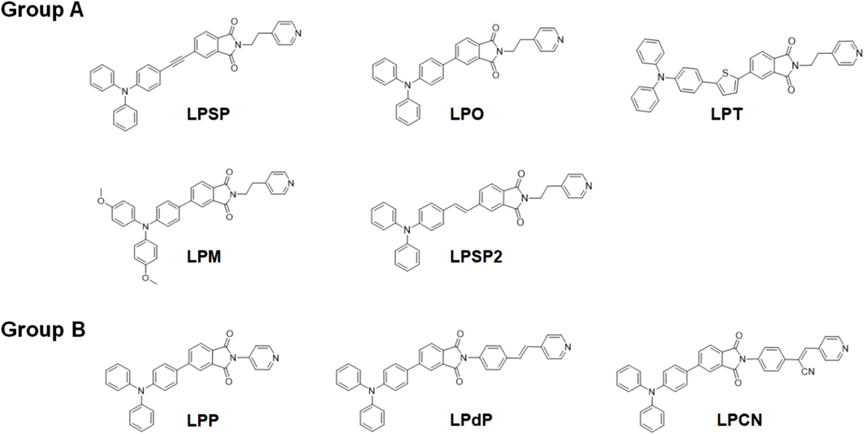
酞酰亚胺衍生物因其独特的光物理特性和生物相容性被广泛用作潜在的荧光团。然而,平面的酞酰亚胺环增加了π-π堆叠相互作用,从而导致在聚集状态下猝灭。研究者设想通过简单的结构改变,最小化有害的π-π堆叠相互作用,同时保持其光学和电化学行为。图1显示了这种设计的示意图。三苯胺(TPA)基团被用作电子给体,而酞酰亚胺单元被用作电子受体。研究者采用了两种光学改进策略:在D-A模块之间插入各种π间隔基团(A组)和在酞酰亚胺单元的氮原子上附加另一个π共轭系统(B组)(图2)。具有较大空间位阻的TPA预计将适应非平面的螺旋桨形状构象,这可以防止在聚集状态下的π-π堆叠相互作用,从而增强发射。研究者期望在TPA和酞酰亚胺之间添加π间隔基团,使AIE的π共轭更长(LPSP、LPT和LPSP2)(图2)。还在TPA上附加了一个对二甲氧基团以增强推拉效应(LPM)。引入π间隔基团或更强的给体可以增强分子内电荷转移(ICT)效应,并通过改善HOMO-LUMO分离来提高ISC效率,从而降低能带间隙并增加产生ROS的能力。
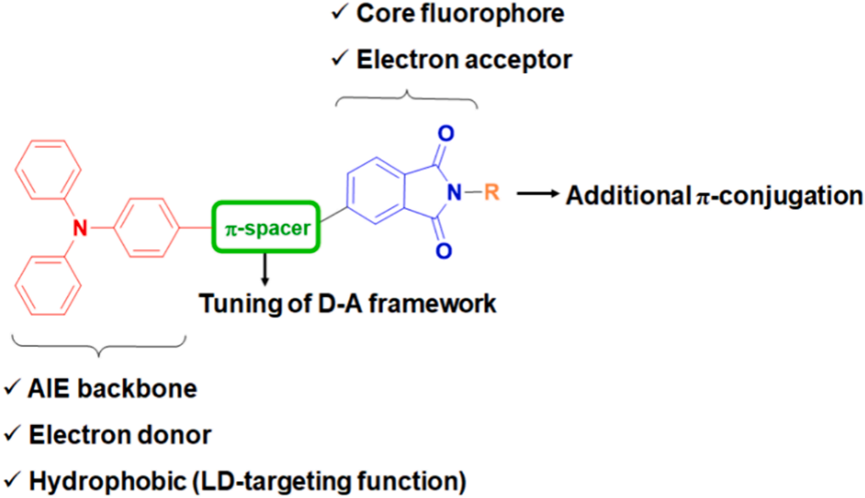
图1. LP化合物的设计思路
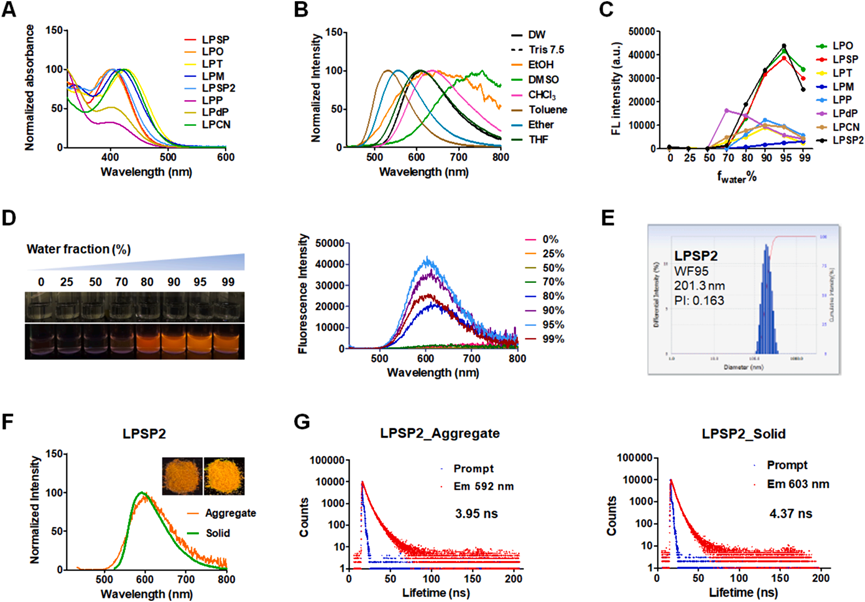
研究者评估了合成化合物的光学性质,特别是它们在不同溶剂中的发射光谱变化,揭示了分子内电荷转移(ICT)跃迁的存在。通过调整水/乙腈溶剂系统中的水含量,观察到LPSP、LPO和LPSP2化合物在高水含量下发射显著增加,显示出聚集诱导发射(AIE)特性(图3C-D)。此外,这些化合物在水溶液中形成了适合生物成像的均匀纳米颗粒。通过测量不同状态下的荧光寿命,进一步证实了LP化合物的AIE特性,表明这些化合物在聚集和固态下具有更长的荧光寿命(图3G)。
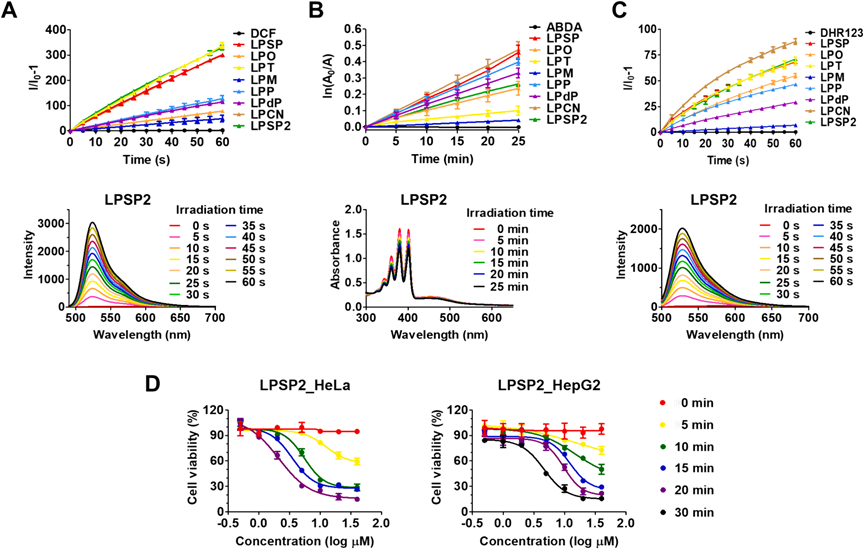
为了探究LP化合物作为光诊疗剂的潜力,通过H2DCF-DA、ABDA和DHR123作为指示剂共培养,测量了光诱导的ROS生成,监测了光谱的变化(图4)。H2DCF-DA指示的ROS总量在LPSP2、LPT和LPSP中的水平明显高于其他化合物(图4A),表明与LPO相比,添加π间隔基团(双键、噻吩或三键)成功增强了ROS的产生。据光学数据,与LPO相比,A组和B组都有效地展现了红移发射。LPSP2、LPT和LPSP中额外的π间隔基团(双键、噻吩环和三键)通过H2DCF-DA检测到的ROS总量明显高于其他化合物。利用LP AIEgens观察到的ROS生成能力,使用MTT评估了体外光动力治疗效率。HeLa细胞被处理与不同浓度的合成光诊疗剂,然后用蓝色LED(900 lm/m^2)不同时间照射。在暗条件下,所有LP AIEgens的光毒性可以忽略不计;然而,在光存在的情况下,每个LP化合物的光诱导细胞毒性显示出不同程度的PDT活性(图4D)。
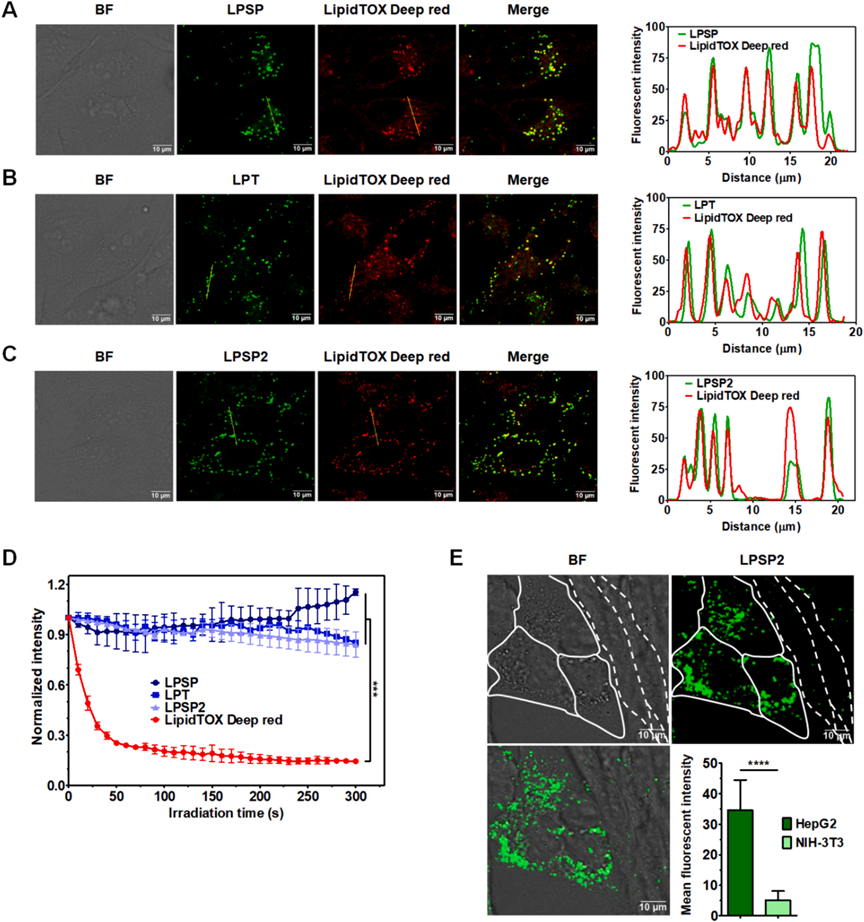
随后,研究者使用共聚焦激光扫描显微镜研究了选定的AIE-PSs(LPSP、LPT和LPSP2)在活HeLa细胞中的亚细胞器靶向特性。与LipidTOX Deep Red、LysoTracker Deep Red和MitoTracker Deep Red的共定位分析表明LPSP、LPT和LPSP2选择性地在脂滴中积累(图5A-5C),但在溶酶体或线粒体中没有。这些AIEgens在激光照射下的光稳定性明显高于LipidTOX Deep Red(图5D)。接下来,研究者评估了LPSP2对癌细胞和正常细胞的选择性。HepG2和NIH-3T3细胞共培养并用10 μM的LPSP2染色。在HepG2细胞中观察到明显的荧光,而在NIH-3T3细胞中荧光可以忽略不计(图5E)。
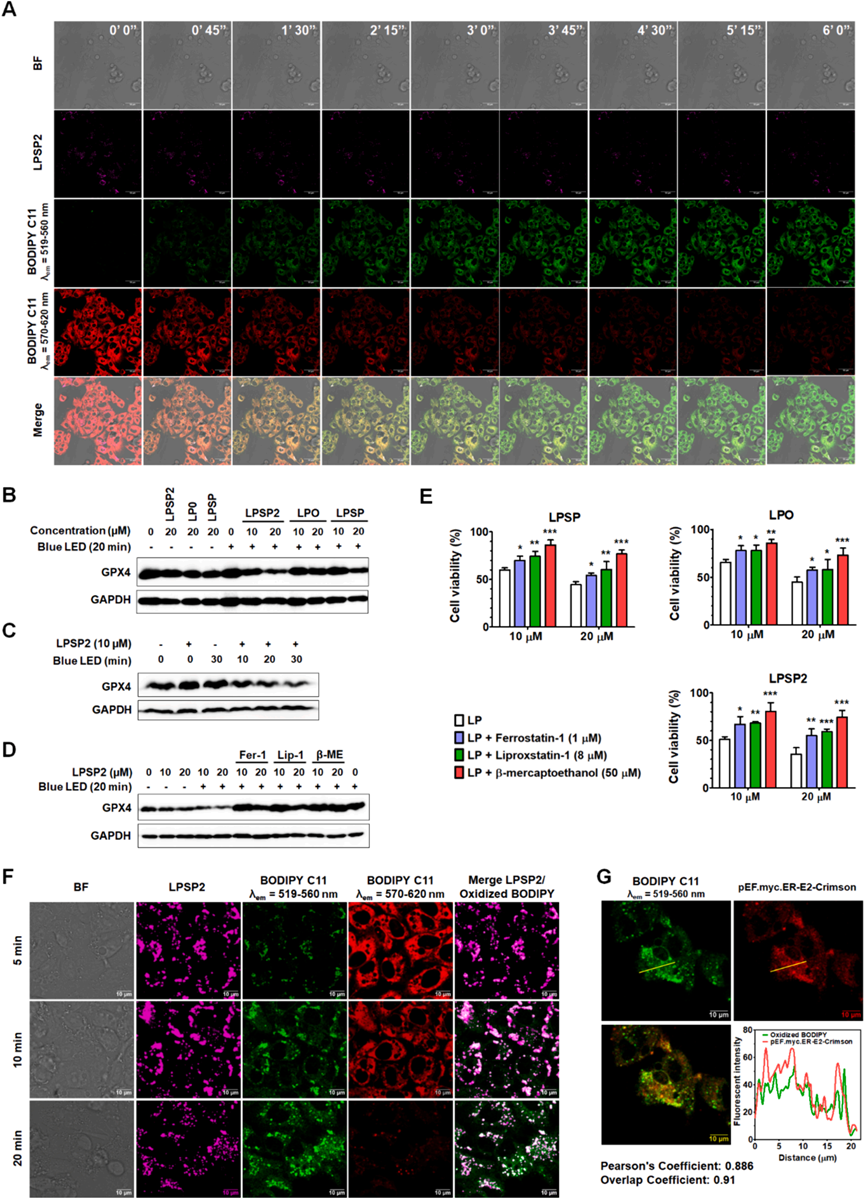
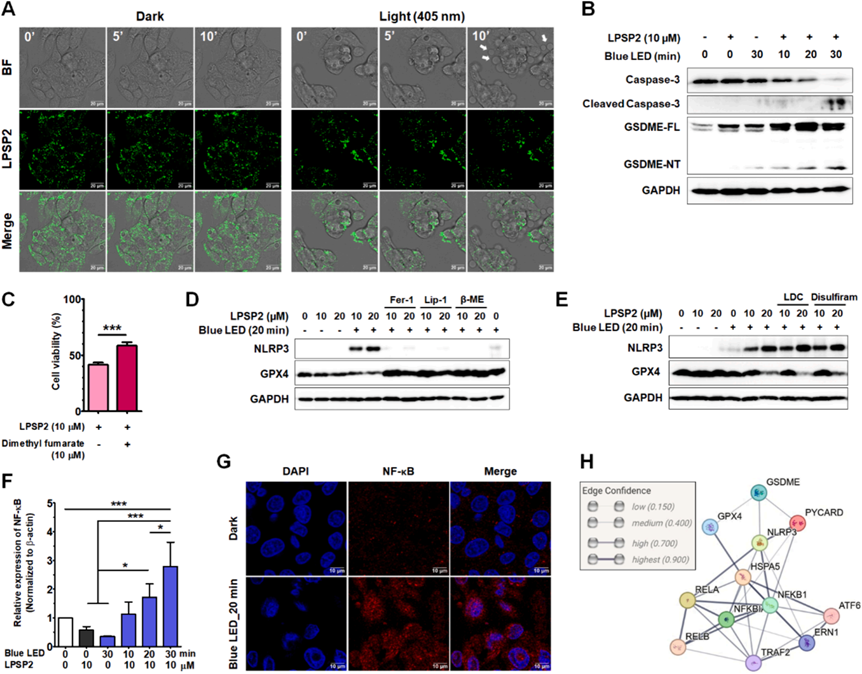
研究者还使用SOSG、DHE、HPF和BODIPY C11(图6)测量了LPSP2在HepG2细胞中产生的ROS,结果表明在LED光照射下LPSP2在HepG2细胞中产生了I型ROS(超氧阴离子和过氧化物)。当用405nm激光照射处理LPSP2的HepG2细胞时,时间序列成像分析显示BODIPY C11从红色到绿色荧光的逐渐比率转换(图6A),表明在活细胞中产生了大量过氧化物。值得注意的是,脂质过氧化在光照射下急剧增加,与GSH-GPX4轴功能障碍后几小时内脂质过氧化物水平的缓慢升高形成对比。随后,研究者通过测量了GPX4水平,发现LPSP2显著降低了GPX4水平,并依赖于光照和浓度(图6B-C)。此外,使用铁死亡抑制剂Fer-1、Lip-1和β-巯基乙醇(图6D-E)的情况下,GPX4水平以及细胞活性恢复。因此,脂质ROS的积累与细胞中GPX4的降低有关,表明LPSP2诱导的铁死亡细胞死亡。
如图6F所示,BODIPY C11与LPSP2共定位明显,表明在LPSP2处理和光照射下在脂滴中形成了脂质过氧化物。此外,长时间照射的细胞显示出更多的氧化BODIPY C11的绿色信号,这些信号围绕着脂滴(图6F)。为了弄清LPSP2在HepG2细胞中产生的脂质过氧化物的位置,研究者使用MitoTracker Deep Red和ER Tracker Blue-White与BODIPY C11共染,LPSP2在20分钟照射后产生的脂质过氧化物并没有在线粒体中积累,而是主要定位在ER室。通过转染HepG2细胞与表达ER蛋白的pEF.myc.ER-E2-Crimson(图6G)也证实了与ER的共定位。这些结果表明,脂质过氧化物主要是在短时间照射时在脂滴中产生和检测到的,而随着照射时间的延长,它们转移到ER中,引发HepG2细胞的ER应激。
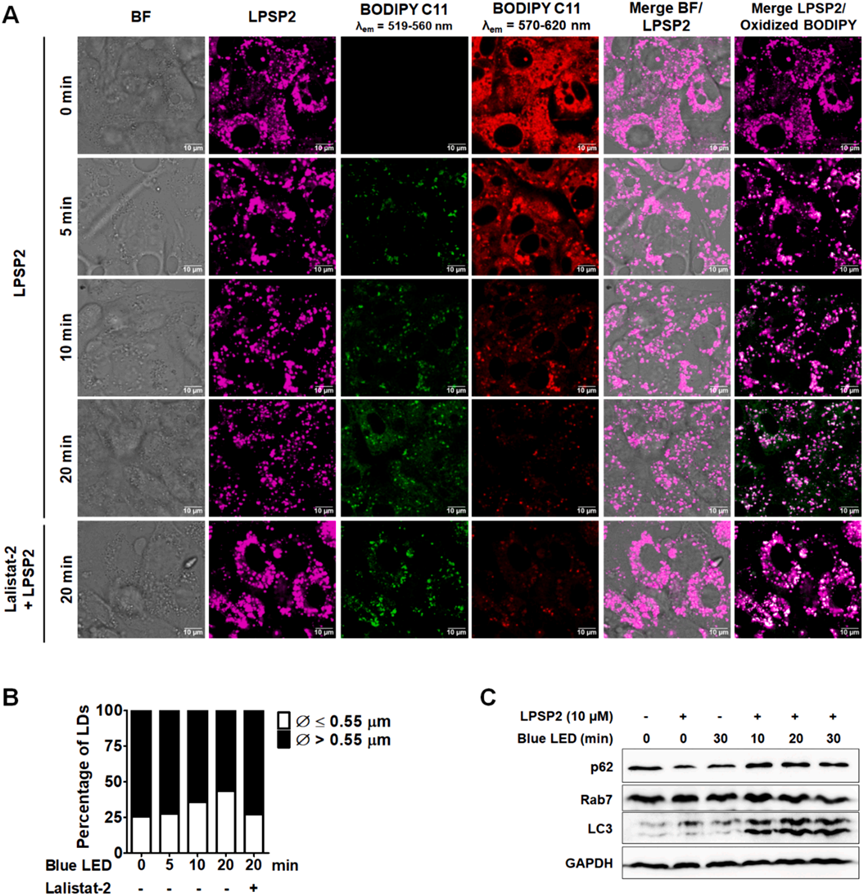
活细胞共聚焦成像显示,与短时间照射的细胞相比,LPSP2处理的细胞在20分钟照射的细胞中脂滴数量显著增加(图7A)。大脂滴的百分比以照射时间依赖的方式减少(图7B)。阻断自噬和细胞质脂解的情况下,20分钟照射样本中的大脂滴数量显著增加(图7B)。统计分析显示,在这些条件下脂滴的大小有显著差异(p < 0.001)。此外,与未处理样本相比,用lalista-2处理的样本中围绕脂滴的氧化BODIPY C11的信号显著降低,表明lalista-2阻断了脂质过氧化物向ER的运输(图7A)。在用LPSP2和蓝色LED光照射处理后,LC3-II/LC3-I的比例逐渐增加(图7C),反映了在光条件下脂滴周围自噬体的形成。此外,在长时间照射的细胞中也表明了Rab7介导的脂滴自噬。研究者用LPSP2的共聚焦活细胞成像的发现与wb一致,表明在光动力治疗下,脂滴通过脂解和脂滴自噬分解,增加了HepG2细胞中多不饱和脂肪酸(PUFAs)的脂质过氧化水平,有助于铁死亡。以上实验结果揭示了在脂滴中产生的脂质过氧化物在ER中积累,表明脂滴分解途径有助于调节铁死亡的敏感性。
研究者发现用405nm单色光或蓝色LED光长时间照射后LP处理的细胞后,细胞中出现小泡(图8A)。为了监测细胞膜的变化,研究者对HepG2细胞膜进行染色后进行活细胞观察。在光照前细胞膜是完整的,而脂滴与细胞膜之间的接触部位在PDT治疗后显示出细胞膜逐渐破裂,提示脂滴中的氧化脂质可能通过接触释放到完整的细胞膜上,导致细胞膜损伤。同时,如图8B所示,HepG2细胞在照射后激活Caspase-3和焦亡标志物GSDM-E。在焦亡抑制剂存在下,细胞活性显著恢复(图8C)。铁死亡以及其他类型的调节性坏死,包括坏死和焦亡通过激活NLRP3炎症体促进炎症。如图8D-E所示,在照射样本中NLRP3的表达水平显著增加,而在铁死亡抑制剂(图8D)处理后几乎检测不到。相反,在补充有焦亡抑制剂的细胞中(图8E),NLRP3炎症体的水平保持较高,表明在使用LPSP2的PDT早期发生了铁死亡,在NLRP3激活之前,并且在长时间炎症后转移到了另一种细胞死亡途径。在PDT期间顺序激活铁死亡和焦亡尚未有报道。
由于线粒体损伤是NLRP3途径激活研究最广泛的刺激因素,研究者使用TMRE染料来检查线粒体膜电位,排除了去极化线粒体是LPSP2处理的HepG2细胞中NLRP3激活的原因。相反,脂滴和ER中脂质过氧化物的积累不可避免地导致ER中的氧化应激,从而激活NLRP3。
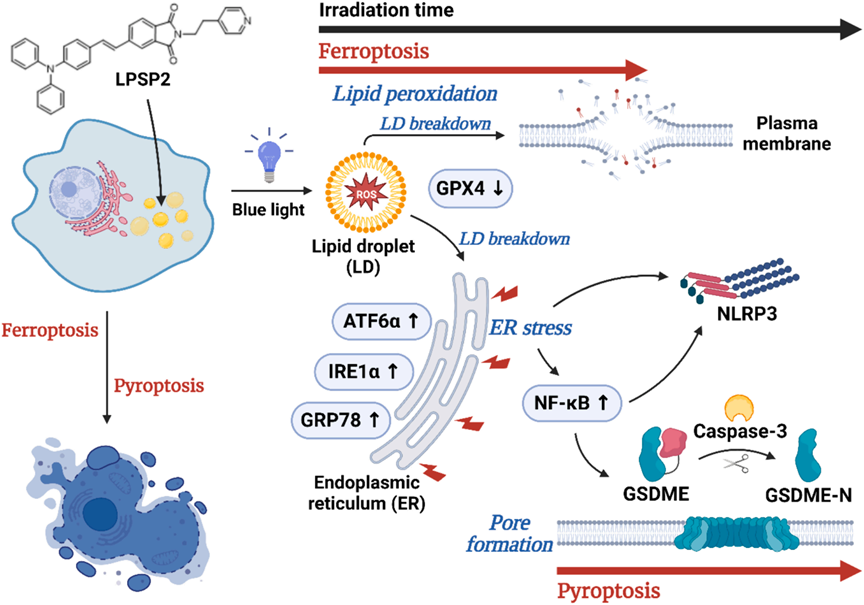
为了验证ER应激在NLRP3激活中的作用,研究者评估LPSP2在PDT条件下未折叠蛋白反应的激活,ATF6α、IRE1α和GRP78显著增加。先前的研究表明ER应激、NLRP3炎症体激活和肝细胞死亡之间的关联。并且ER应激可以通过氧化应激、钙稳态和NF-κB激活来激活NLRP3炎症体。用LPSP2处理的HepG2细胞中NF-κB的表达也随着照射时间的增加而显著增加(图8F),以及NF-κB的核转位(图8G)。PPI分析展示了ATF6α、NF-κB和NLRP3之间的相互关系(图8H),表明在LPSP2光照射处理的细胞中ER应激、NF-κB和NLRP3炎症体激活之间复杂的相互作用。研究揭示了LPSP2诱导HepG2细胞发生铁死亡,然后通过ER应激和NF-κB信号传导转移到焦亡(图9)。
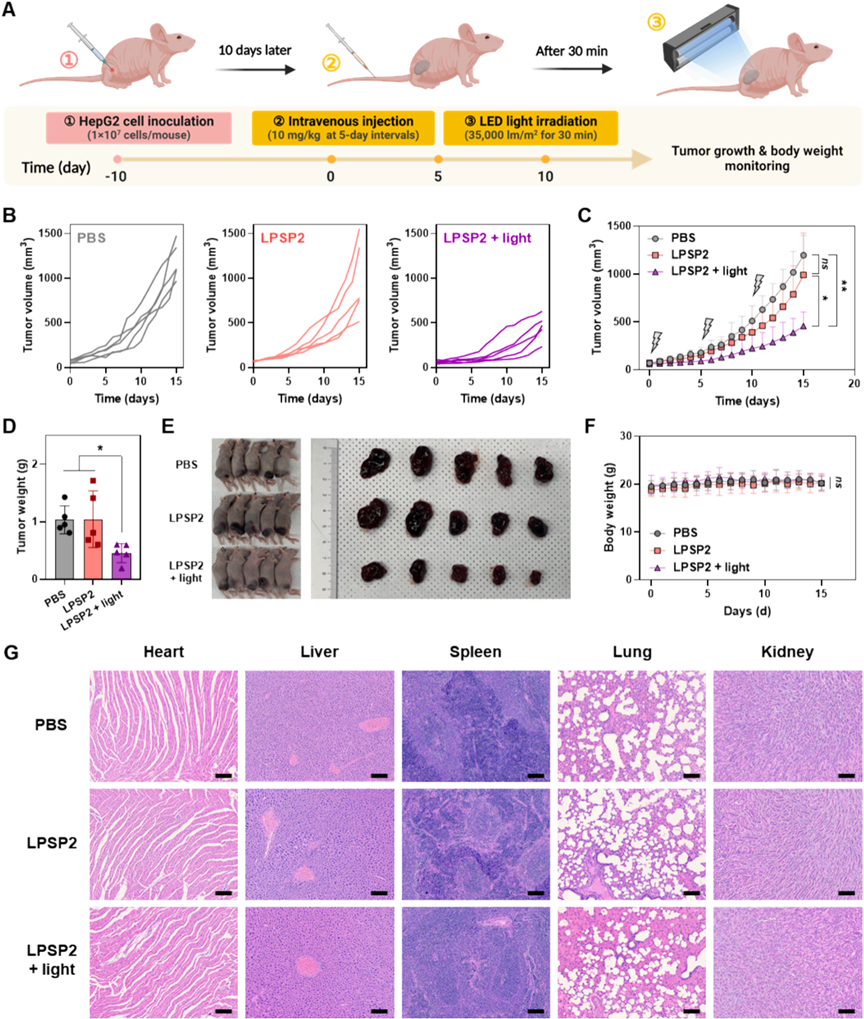
为评估LPSP2介导的光动力治疗的抗肿瘤疗效,研究者构建了HepG2细胞异体移植BALB/c裸鼠模型(图10A)。相比于对照组和LPSP2单独处理组,LPSP2结合光照治疗显著抑制了肿瘤生长(图10B-E)。而各组之间小鼠的体重没有明显差别(图10F),HE染色结果表明治疗没有引起小鼠器官病变(图10G),表明LPSP2介导的光动力治疗没有明显不良影响。为进一步评估LPSP2介导的光动力治疗的生物安全性,研究者对模型小鼠进行血液计数和血清生化分析,三个组别之间并未发现明显差异.以上结果证明,LPSP2与光照射相结合,有效抑制HepG2肿瘤模型中肿瘤生长,而不会诱导全身毒性,提示其癌症治疗的潜力。
研究者通过AIE光诊疗剂实现了对脂质过氧化的时空控制,AIE光诊疗剂介导的光动力治疗能够顺序诱导肝癌细胞发生铁死亡和焦亡显示出显著的抗肿瘤效果,且没有引起明显的系统毒性。靶向脂滴的AIE光诊疗剂为癌症治疗策略提供了新的见解。
实验方法
设计和合成AIE光诊疗剂、qRT-PCR、MTT实验、共聚焦激光扫描显微镜、荧光探针检测细胞内活性氧、时间序列成像技术、线粒体膜电位检测、细胞培养和转染、肿瘤细胞异种移植的裸鼠模型、HE染色、血液计数和血清生化分析
Le Bich Hang Pham, Khanh Linh Chung, So-Yeol Yoo, Seoyoung Kim, Bumhee Lim, Jae-Young Lee, Jeeyeon Lee, Sequential induction of ferroptosis and pyroptosis in cancer cells by lipid droplet-targeting AIE theranostics, Chemical Engineering Journal, Volume 498, 2024, 155439, https://doi.org/10.1016/j.cej.2024.155439.






