商品化工程外泌体重大发现——高效支架蛋白PlexinA1
支架蛋白在EVs的工程化中起着关键作用。它们的主要功能是将目的蛋白有效地分选到EVs中,并将其固定在EVs的特定位置。通过与目的蛋白的融合表达,支架蛋白能够增强EVs对目的蛋白的装载能力,从而提高EVs作为药物递送系统的效率。文章提出了新的筛选标准,简化了对支架蛋白的要求,主要包括两点:(1)候选蛋白必须是具有EV分选能力的I型跨膜蛋白;(2)在N端和C端的截短和/或融合修饰不会影响其EV分选能力。这些标准旨在扩大潜在支架蛋白的范围。总的来说,文章通过实验验证了PLXNA1(PlexinA1)作为一种新型支架蛋白的潜力。PLXNA1的截短形式不仅保留了其全长蛋白的高EV分选能力,还允许目的蛋白在EVs的外表面和腔内区域进行融合表达,单独或同时实现。研究于2024年11月发表在《Journal of Extracellular Vesicles》,IF=15.5。
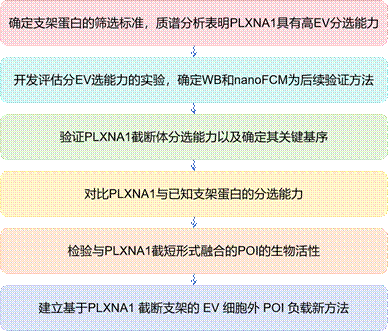
技术路线:
研究结果
1. PlexinA1被鉴定为具有高EV分选能力的潜在支架蛋白
研究者提出了两个新的标准来鉴定支架蛋白:(1)候选蛋白必须是具有EV分选能力的I型跨膜蛋白;(2)在N端和C端的截短和/或融合修饰不会影响其EV分选能力。为了验证这些标准的可行性,研究者设计了一个筛选实验。研究者收获了野生型293F细胞的培养基,并通过超速离心(UC)后进行密度梯度离心(DGC)的方法进行EV纯化。根据国际细胞外囊泡学会(ISEV)2018年提出的细胞外囊泡研究的最小信息(MISEV)指南,通过透射电子显微镜(TEM)、纳米颗粒跟踪分析(NTA)和生物标志物检测对通过DGC分层的EV进行鉴定(图1a、b、c、e)。为了评估不同蛋白在EV中的分选能力,研究者通过质谱分析了293F细胞裂解物(CLs)、通过UC分层的低纯度EV和通过DGC分层的高纯度EV。研究者通过比较三种样本中目标肽段的比例生成了热图(图1c)。如图所示,已知的EV相关蛋白(如MFGE8、CD81、PTGFRN、SDCBP、CD63和TSG101)在DGC组中显示出显著优势,其次是UC组,最后是CL组。非EV相关蛋白钙网蛋白(CANX)显示出完全不同的谱图。为了更好地量化这种差异,研究者通过EV/CL的比例计算了蛋白富集度。除了已知的支架蛋白外,研究者注意到PLXNA1在更纯的DGC EV中也显示出高富集度(图1d),与西方印迹(WB)检测结果一致(图1e)。这些数据表明PLXNA1是一种具有高EV分选能力的蛋白,符合筛选标准的第一个要求。
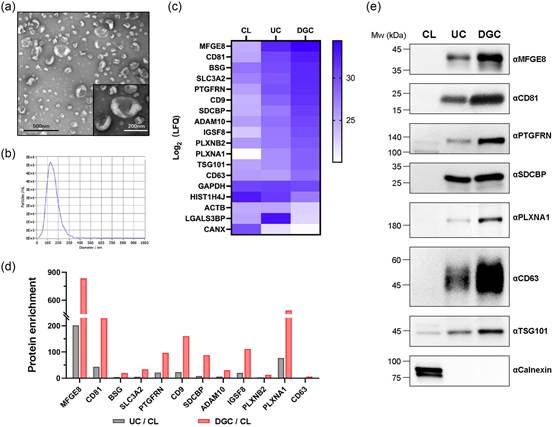
图1 PlexinA1被鉴定为具有高EV分选能力的潜在支架蛋白
2. WB和nanoFCM是评估支架EV分选能力的可行方法
为了评估PLXNA1是否符合研究者筛选标准的第二个要求,研究者开发了一种实验方法来确定支架蛋白的EV分选能力。简言之,将绿色荧光蛋白(GFP)作为模型指示物(目的蛋白)与模型支架蛋白CD63和MFGE8融合。然后,通过瞬时转染将融合蛋白和游离GFP在293F中过表达。之后,通过低速离心收集细胞培养基(CCM)。细胞沉淀裂解并冷冻以供后续使用。通过尺寸排阻色谱(SEC)方法从CCM中纯化EVs(图2a),然后进行三项测试以评估相应支架蛋白的EV分选能力。在第一次测试中,通过酶联免疫吸附测定(ELISA)检测EVs和CLs中的GFP浓度。通过将EVs中的GFP总量除以CLs中的GFP总量(等量蛋白)来确定蛋白富集度(图2b)。研究者在第二次测试中进行了西方印迹(WB),并通过灰度分析对蛋白进行定量(图2c、d)。在第三次测试(图2e)中,研究者使用纳米流式细胞术(nanoFCM)测量GFP负载EVs的荧光信号,代表EVs中GFP的表达水平(Peacock et al., 2022)。尽管ELISA和WB测量的蛋白富集度绝对值略有差异,但这两个方法的谱图保持一致(图2b、c)。归一化后,GFP-CD63(4-7倍于游离GFP)略优于GFP-MFGE8(3-4倍于游离GFP)。鉴于WB可以反映融合蛋白的分子量,研究者决定在后续实验中使用WB和nanoFCM来评估候选支架的EV分选能力。nanoFCM测量的平均荧光强度(MFI)结果表明,融合蛋白GFP-MFGE8优于GFP-CD63,与蛋白富集度不同。这是因为GFP MFI仅反映了EVs中融合蛋白的相对表达水平,而不管细胞中剩余的融合蛋白量是多少。然而,蛋白富集度代表了这两种不同融合蛋白形式的比率。因此,如果两种融合蛋白在生产细胞中的表达水平差异足够大,就会出现这种现象,这也与WB的条带强度一致(图2c)。根据这些结果,研究者决定在后续实验中使用WB和nanoFCM来评估候选支架的EV分选能力。
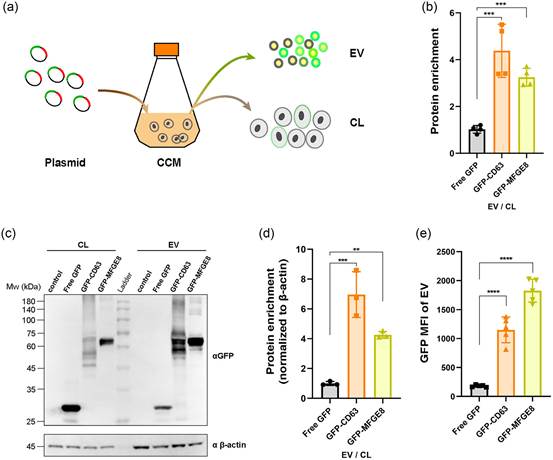
图2 WB和纳米流式细胞术(nanoFCM)是评估支架EV分选能力的可行方法
3. 截短的PLXNA1保持高EV分选能力
尽管PLXNA1具有高EV分选能力,但由于其功能域和较大的分子量(约211 kDa),它不适合用于装载目的蛋白。删除或替换其功能域的PLXNA1截短形式可能适合与目的蛋白融合。由于实验方法已经确定,研究者进入下一步,验证PLXNA1是否符合研究者筛选标准的第二个要求,换句话说,截短和/或融合修饰是否会影响其EV分选能力。为了实现这一目标,研究者选择了五种不同的截短形式,并将它们与不同的货物分子(例如白介素12和GFP)在N端和C端同时融合。随后,从293F细胞培养上清液中分离EVs,并使用之前建立的方法进行检测。WB实验表明,除了PLXNA1(1046-1300)外,所有这些截短形式均显著富集于EVs中,符合研究者筛选标准的第二个要求(图3a、b)。然而,由于在其他四组中蛋白富集度几乎没有差异,因此仅凭这一单一指标的结果无法确定最佳截短形式。因此,研究者还考虑了通过纳米流式细胞术(nanoFCM)测量的平均荧光强度(MFI)结果(图3c),并缩小了候选范围至PLXNA1(863-1316)、PLXNA1(863-1300)和PLXNA1(1143-1300)。在排除了显示出更明显降解的PLXNA1(1143-1300)之后,研究者最终选择了PLXNA1(863-1316)用于所有后续实验,因为它在蛋白富集度方面略占优势。为了直观展示EV分选能力,研究者对携带hIL12-PLXNA1(863-1316)或小鼠IL12(mIL12)-PLXNA1(863-1316)的单个EV进行了成像。与四跨膜蛋白相比,货物(hIL12和mIL12)的荧光斑点更为显著。这也证明了PLXNA1(863-1316)具有高EV分选能力。为了排除EV分选能力可能依赖于货物的可能性,研究者将PLXNA1(863-1316)与不同的目的蛋白(例如IL12、RVG肽和ALFA标签的纳米抗体[ NbALFA]以及带有Flag标签的蛋白)融合。从293F细胞培养上清液中分离EVs,并使用WB进行检测。IL12、RVG肽和NbALFA也在EVs中显著富集(图3d、e)。这表明这种截短形式的PLXNA1能够有效地促进各种蛋白货物的主动分选。这些结果表明,PLXNA1截短形式是EV工程的潜在支架蛋白,并证明了研究者筛选标准的可行性。
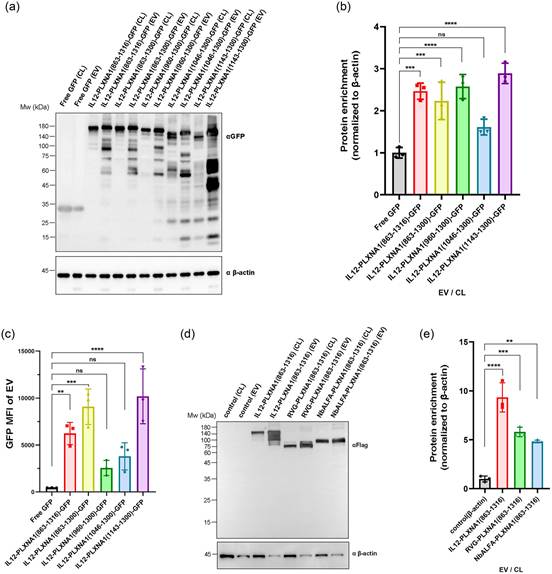
图3 截短的PLXNA1保持高EV分选能力
4. PLXNA1上的一个七氨基酸残基的基序是EV分选所必需的
Plexins是包含九个成员的蛋白质家族中的跨膜受体(Hota & Buck, 2012)。研究者想知道这个家族中其他蛋白的截短形式是否具有类似的EV分选能力。因此,研究者基于PLXNA1(863-1316)的参考构建了这个家族中其他蛋白的截短形式,分别是PLXNA2(857-1306)、PLXNB1(1068-1558)、PLXNB2(802-1267)、PLXNC1(661-1003)和PLXND1(886-1341)。同样地,IL12和GFP被置于这些截短体的两端。有趣的是,只有PLXNA2(857-1306)在EVs中显示出显著的富集(图4a-c),尽管其EV分选能力弱于PLXNA1(863-1316)(蛋白富集度>2.5,MFI>5000)。为了研究这种差异的原因,研究者对PLXNA1、PLXNA2、PLXNB1和PLXNB2进行了序列比对。一个保守的基序SDSLLTL仅在PLXNA1和PLXNA2的跨膜结构域旁边的细胞外区域被发现,而不在PLXNB1或PLXNB2中(图4d)。为了确认SDSLLTL是否是EV分选所必需的,研究者比较了原始截短体PLXNA1(863-1316)和没有SDSLLTL基序的截短体PLXNA1(863-1236, 1244-1316)。如图所示,在删除这个SDSLLTL基序后,蛋白富集度和GFP MFI显著降低,这意味着这个基序与PLXNA1融合蛋白向EVs的主动分选有关(图4e-g)。除了缺失实验外,研究者还进行了点突变和插入实验,以进一步研究这个基序如何影响PLXNA1截短形式的EV分选能力。结果表明,这个基序中每个氨基酸的重要性不同。此外,第一个和最后四个氨基酸(除了D和第二个S外)在维持这一功能方面发挥了更突出的作用(图4h)。
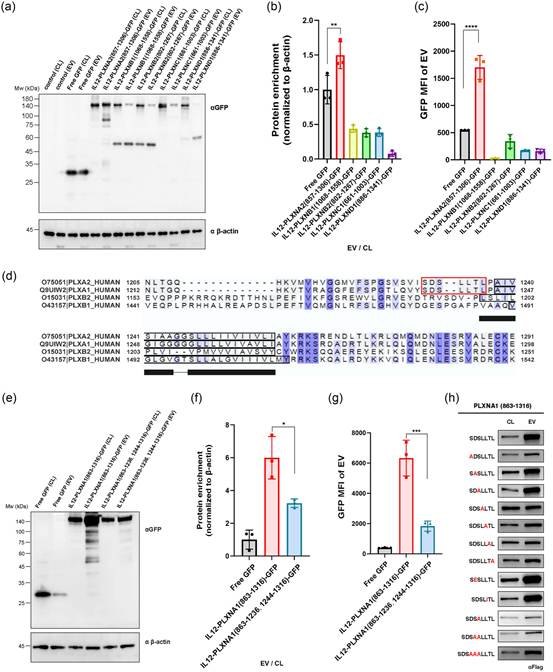
图4 PLXNA1上的一个七氨基酸残基的基序是EV分选所必需的
5. PLXNA1截短形式比已知支架更具优势
为了进一步阐明PLXNA1截短形式在EV分选中的潜在优势,研究者将PLXNA1(863-1316)与两种公认的支架蛋白进行了比较,即在HEK293来源的EVs中广泛应用于工程化EVs的LAMP2B和在EV临床应用中已知的具有高EV分选能力的PTGFRN。按照相同的目的蛋白装载,PLXNA1(863-1316)显著显示出比LAMP2B和PTGFRN更强的EV分选能力,它们都是I型跨膜蛋白(图5)。为了研究PLXNA1(863-1316)作为一种支架蛋白是否适用于其他细胞,研究者在MCF-7细胞系中重复了上述实验。同样地,PLXNA1(863-1316)在MCF-7来源的EVs中显示出比LAMP2B和PTGFRN更高的EV分选能力。这表明PLXNA1截短形式可以作为一种通用支架蛋白,不仅限于HEK293细胞。按照研究者的筛选标准,PLXNA1截短形式被鉴定出来,并显示出在EV蛋白工程中具有显著的应用价值。
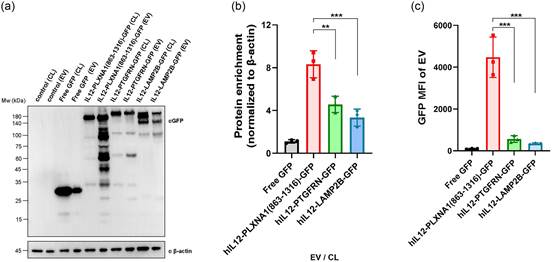
图5 PLXNA1截短形式比已知支架更具优势
6. 与PLXNA1截短形式融合的目的蛋白保持其活性
由于PLXNA1截短形式能够使目的蛋白在EVs中富集,另一个关注点是装载到EVs中的目的蛋白是否仍然具有生物活性。为了回答这个问题,研究者设计了额外的实验,分别验证EVs腔内和外表面的目的蛋白的活性。首先,使用核糖体蛋白L7AE的RNA结合单元进行腔内修饰,以测试融合表达是否剥夺了其RNA结合能力,这反过来可能影响目标mRNA的装载。简言之,将表达PLXNA1(863-1316)和L7AE融合蛋白的质粒以及表达目标mRNA(即NanoLuc mRNA,其尾部融合了C/D盒序列)的另一个质粒共转染到293F细胞中。将得到的EVs加入培养基中,并与HepG2细胞共孵育。如果L7AE单元成功表达并保持其RNA结合能力,目标mRNA(带有C/D盒的NanoLuc)水平及其相应的蛋白应在受体细胞中显著上调(图6a)。研究者进行了液滴数字PCR(ddPCR)实验,以分析囊泡中目标mRNA的丰度。与仅转染目标mRNA质粒的对照组(以下简称为NanoLuc-EV)相比,共转染两种质粒的组(以下简称为NanoLuc-L7AE-EV)中每个囊泡的NanoLuc mRNA拷贝数超过10倍。为了验证受体细胞中的NanoLuc活性是否来源于EVs递送的mRNA,研究者进行了孵育实验,并发现用NanoLuc-L7AE-EV处理的HepG2细胞中NanoLuc mRNA水平是用NanoLuc-EV处理的HepG2细胞的4倍以上(图6b)。此外,研究者还使用ddPCR分析了HepG2细胞中NanoLuc mRNA的丰度。用NanoLuc-L7AE-EV处理的HepG2细胞中NanoLuc mRNA的丰度是用NanoLuc-EV处理的HepG2细胞的10倍以上。如预期所示,当在EV孵育前向HepG2细胞中转染针对NanoLuc mRNA的siRNA时,可以观察到用NanoLuc-L7AE-EV处理的HepG2细胞中NanoLuc mRNA的量减少了40%。关于受体细胞中的蛋白功能实验,野生型EVs和仅表达L7AE融合蛋白的EVs几乎不显示任何NanoLuc活性(图6c)。与此同时,用NanoLuc-L7AE-EV处理的HepG2细胞的NanoLuc催化活性是用NanoLuc-EV处理的HepG2细胞的4倍(图6c),这表明L7AE工程化EVs在递送目标mRNA方面的优势。此外,在存在siRNA的情况下,用NanoLuc-L7AE-EV处理的细胞的活性减少了30%(图6c),这进一步证实了受体细胞中的NanoLuc催化活性来源于mRNA递送。相反,siRNA并未影响用NanoLuc-EV处理的细胞的活性(图6c)。由于目标mRNA也可以在供体细胞(HEK293F)中翻译成蛋白,因此由NanoLuc-C/D BOX转染的细胞分泌的EVs也可能携带NanoLuc蛋白。因此,一个可能的解释是,对于NanoLuc-EV处理的HepG2细胞,其NanoLuc活性主要来源于EVs携带的蛋白。为了进一步排除两组(NanoLuc-EV和NanoLuc-L7AE-EV)处理的受体细胞之间的催化活性差异是由于它们携带的NanoLuc蛋白量不等,而不是由于受体细胞中目标mRNA表达的蛋白所导致的,研究者还测试了两组EVs中的NanoLuc活性。结果表明,NanoLuc-L7AE-EV的NanoLuc催化活性并不优于NanoLuc-EV。这支持了结论,即受体细胞中观察到的NanoLuc活性主要归因于目标mRNA表达的蛋白,两组(NanoLuc-L7AE-EV和NanoLuc-EV)之间的差异确实与mRNA的丰度有关。接下来,将NanoLuc蛋白直接融合并表达在PLXNA1(863-1316)的C端。与之前的实验不同,这种情况下表达的NanoLuc蛋白被锚定在EVs的内膜上。在随后的体外实验中,NanoLuc负载的EVs和重组NanoLuc显示出剂量依赖性的底物催化活性(图6d)。在另一个实验中,选择白介素12(IL12)作为分子货物,以测试N端融合对蛋白活性的影响。通过与PLXNA1(863-1316)的N端融合,将小鼠IL12(mIL12)展示在EVs的外膜上。在体外实验中,将不同量的重组mIL12(rmIL12)和与mIL12相关的EVs(EVmIL12)加入小鼠外周血单个核细胞(mPBMCs)的培养基中。孵育后,rmIL12和EVs mIL12均以相同的量级诱导IFN-γ激活(EV-mIL12的EC50 = 0.8824,rmIL12的EC50 = 0.252)(图6e)。这些结果表明,与PLXNA1截短形式的N端或C端融合对蛋白货物的功能影响有限。为了验证PLXNA1截短形式是否能够在体内模型中维持目的蛋白的活性,研究者研究了携带MC38肿瘤的小鼠。研究者比较了rmIL12和EVmIL12在剂量范围内的肿瘤生长抑制活性,每隔一天在肿瘤内注射三次(第0天、第2天和第4天)(图6f)。与等剂量的rmIL12(100 ng)相比,EVmIL12在MC38模型中显示出更有效的肿瘤生长抑制活性(图6f、g)。在第16天注射后,rmIL12处理的小鼠的平均肿瘤重量被抑制了11%。然而,在第16天注射后,EVmIL12处理的小鼠的平均肿瘤重量分别在100 ng剂量时被抑制了72%,在500 ng剂量时被抑制了80%,表明EVmIL12在相同剂量下优于rmIL12,并且EVmIL12的治疗效果呈剂量依赖性(图6g)。与研究者之前的研究一起,这些数据表明,与重组目的蛋白相比,融合到EVs中的PLXNA1截短形式的目的蛋白不仅保持了其活性,甚至在效力上更胜一筹。
图6 与PLXNA1截短形式融合的目的蛋白保持其活性
7. 基于PLXNA1截短形式支架建立了一种新的细胞外目的蛋白装载方法
PLXNA1作为EV支架蛋白的稳健性得到了证明,特别是其允许在两端单独或同时进行融合修饰的特性。因此,研究者尝试基于PLXNA1(863-1316)和一种名为NbALFA的纳米抗体的融合,开发一种通用的工程化EV。众所周知,ALFA标签及其纳米抗体NbALFA具有非常高的亲和力和选择性。在这个系统中,通过与PLXNA1(863-1316)的融合表达,将NbALFA呈现在EVs的外表面。通过简单孵育,这些EVs可以进一步用携带ALFA标签的目的蛋白进行标记(图7a)。为了评估这个系统的可行性,将带有ALFA标签的重组GFP与NbALFA EVs(GFP分子/EV颗粒 = 1000)共孵育,约51.5%的EVs呈GFP阳性(图7b),而其他对照组未观察到荧光信号。除了GFP外,研究者还构建了几种带有ALFA和HA标签的重组肽和蛋白,包括NanoLuc、RVG和EGFR纳米抗体(7D12)。这些肽和蛋白也与NbALFA EVs共孵育。之后,这些EVs进一步用抗HA荧光抗体标记,并使用纳米流式细胞术(nanoFCM)进行荧光分析(图7c)。所有这些重组肽或蛋白都成功标记在EVs上,无论它们的分子量差异如何。为了研究目的蛋白的活性是否受到NbALFA EVs与ALFA标签目的蛋白相互作用的影响,研究者将带有ALFA标签的NanoLuc用于EVs表面的装载,然后评估NanoLuc的催化活性。此外,研究者还在体外实验中评估了7D12修饰的EVs对EGFR阳性细胞系的选择性结合。首先,用DSPE-PEG3000-FITC标记的对照EVs和7D12修饰的EVs具有相似的荧光强度。随后,它们分别与EGFR阳性和EGFR阴性细胞共孵育。与EGFR阴性细胞组(22VR1)和野生型EV组(对照)相比,7D12修饰的EVs在不同剂量下对EGFR阳性细胞组(A431)显示出强烈显著且特异性的亲和力(图7d),表明目的蛋白在EV表面具有功能性。研究者还想知道基于NbALFA/ALFA相互作用的目的蛋白装载EVs是否在保存过程中足够稳定。因此,用重组GFP-ALFA标记NbALFA EVs。然后,使用纳米流式细胞术(nanoFCM)分析重复冻融循环和不同保存条件对EVs的GFP荧光的影响。结果表明,基于NbALFA/ALFA相互作用的EVs可以抵抗至少三次冻融循环,GFP信号仅在八次冻融循环后降低了20%(图7e)。此外,这些EVs中的GFP MFI在4°C或-80°C保存至少4周后得以保持(图7f)。因此,研究者的数据表明,这种基于NbALFA/ALFA系统的EV工程化方法是一种高度通用且稳定的方法。
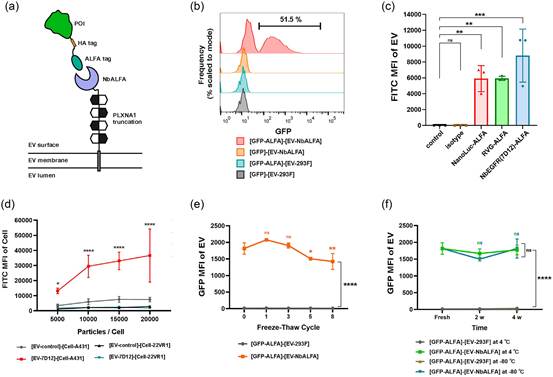
图7 基于PLXNA1截短形式支架建立了一种新的细胞外目的蛋白装载方法
结论
通过提出新的筛选标准,研究者们成功鉴定了PlexinA1(PLXNA1)截短形式作为一种新型的细胞外囊泡(EVs)支架蛋白,它不仅具有高效的EVs分选能力,还允许感兴趣的蛋白质(目的蛋白)在EVs的外表面和腔内区域单独或同时进行融合表达,显著提高了EVs的蛋白装载能力和工程化灵活性,且在药物递送效率上优于传统重组蛋白,为开发新型EVs治疗载体提供了有力的技术支持和广阔的应用前景。
实验方法:
质粒构建与转染、细胞外囊泡分离、透射电子显微镜检测、纳米颗粒跟踪分析(NTA)、质谱分析、蛋白质浓度检测(BCA法)、Western blot与蛋白富集计算、纳米流式细胞术检测(NanoFCM)、酶联免疫吸附测定(ELISA)、NanoLuc荧光素酶活性检测、定量PCR(qPCR)和数字PCR(ddPCR)、体外细胞实验、体内肿瘤抑制实验、稳定性检测、流式细胞术分析。
参考文献
Zhao H, Li Z, Liu D, Zhang J, You Z, Shao Y, Li H, Yang J, Liu X, Wang M, Wu C, Chen J, Wang J, Kong G, Zhao L. PlexinA1 (PLXNA1) as a novel scaffold protein for the engineering of extracellular vesicles. J Extracell Vesicles. 2024 Nov;13(11):e70012. doi: 10.1002/jev2.70012. PMID: 39508411; PMCID: PMC11541859.






