内源性tRF分子通过YBX1介导的机制抑制乳腺癌发展

在应激压力情况下tRNA可以分解成tRFs。在本篇报道中作者发现Glu/Asp/Gly/Tyr的tRNAs均可以生成一系列的tRFs,它们与致癌基因3‘UTR竞争性结合YBX1蛋白, 降低了多个乳腺癌致癌转录本的稳定性。这种转录后的沉默模式具序列特异性,这些片段有共同序列区域与YBX1识别序列相结合。作者开展一系列功能性实验验证tRFs抑制乳腺癌细胞的增殖。YBX1本身的功能是使致癌转录本的稳定性增加,癌症基因蛋白表达水平增强。这种tRFs产生的竞争性置换抑制其稳定性和表达,也就抑制了癌症转移。
高度转移性乳腺癌细胞通过抑制这些tRFs的感应拮抗其抗肿瘤功能。在癌症转移过程细胞遇到的主要刺激是低氧环境,这时刺激产生的tRF可以抑制癌症转移。 YBX1是功能强大的RNA结合蛋白,涉及到很多关键性细胞途径,它的基因失活导致胚胎死亡。通过CLIP分析其结合分子,作者发现tRFs结合YBX1并且取代了一系列致癌转录本,因此抑制了YBX1的蛋白活性。
结果:
癌症细胞在增殖过程中会遇到各种各样的应激环境,主要的压力就是低氧环境。肿瘤细胞利用许多调节系统来抵抗压力带来的的影响。作者开展乳腺癌细胞smRNA测序。结果发现相当大的一部分小RNA序列来自于tRNA。
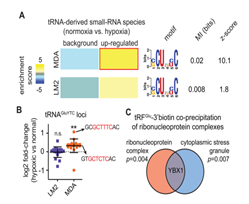
tRF分子来源于剪切的tRNA,这类小RNA片段可以在细菌,酵母和哺乳动物的正常和应激条件下中检测到。1977年左右首次在癌症病人尿液中发现并报道,当时被视作致癌分子。RNA测序结果显示低氧情况下乳腺癌细胞系MDA中tRFs含量增加,但是在另一种高度转移性乳腺癌细胞系MDA-LM2没有出现这种现象。这说明高度转移的癌细胞抑制这种低氧状态下的上调。低氧诱导型tRFs序列分析显示一段共有序列的显著富集现象(图1A)。这种富集现象没有在高度转移类LM2中呈现。推测这些共有序列是反式作用因子与小RNA的结合位点。例如tRNA Glu产生的tRF在低氧环境MDA细胞中显著上调,并且具有上述特征(图B smRNA测序)。作者开展RNA pull-down实验,21-nt 3′生物素化的寡核苷酸的一段确定的序列被固定在链霉亲和素磁珠上,用于结合与tRF相互作用的蛋白复合物。基因集富集分析说明,其结合蛋白属于核糖核蛋白复合体和压力颗粒复合物 (图1C),YBX1与上述两种蛋白家族均相关。因此深入研究YBX1蛋白,开展CO-IP实验,检测YBX1与转染的3‘生物素化tRF类似物的结合情况,同时开展内源性YBX1与tRF类似物检测实验(图1D和1E),结果均证实二者的结合关系。
tRFs与YBX1特异结合
YBX1是一种多功能RNA结合蛋白,是Y-BOX结合蛋白家族的一员,应用在RNA各个方面的功能。YBX1是RNA转译和稳定性的调节因子,参与tiRNA核糖体介导的核糖体活性抑制。对YBX1做CLIP分析,高通量测序结果显示4000多个内源性转录本与YBX1结合。大部分与YBX1的结合位点在3‘UTR和外显子,少部分是在5’UTR和内含子结合(图2A)。大部分YBX1结合的转录本都过度表达,激活相关通路,包括RNA加工、转换、细胞周期、葡萄糖代谢、纺锤结构,及其他的关键信号和压力应激反应。YBX1调节子的广度和多样性说明其对RNA体内的平衡和增殖,及对细胞应对内外压力很重要。
CLIP实验的高通量测序结果发现YBX1与细胞中tRF的一个特殊的子集结合。GLy和Asp在细胞中均低表达但是与YBX1大量结合,而Lys,和,Ser是体内高表达但是不与YBX1结合。SmRNA和 CLIP实验对比展示MDA细胞中tRF位置和丰度。结果说明tRF和YBX1的相互作用不是细胞中简单的tRF丰度问题,YBX1的结合是特异性的而并非取决于表达丰度。 转录组分析MDA细胞系在低氧情况下,含有YBX1的细胞系显著上调表达。这说明Trf参与低氧诱导,YBX1介导的转录后调节 (图2D)。高度转移的MDA-LM2细胞并没有表现出YBX1-依赖低氧情况下的下调基因富集。因为YBX1没在MDA-LM2细胞系中表现出明显的变化,因此推测增加的富集是TRF产生的,因为它在低转移癌症细胞中富集。
......






