RNA甲基化修饰(m6A)研究思路及方案设计
RNA甲基化修饰(m6A)研究思路及方案设计
RNA甲基化修饰约占所有RNA修饰的60%以上,而N6-甲基腺嘌呤(N6-methyladenosine, m6A)是高等生物mRNA和lncRNAs上最为普遍的修饰。目前发现microRNA,circRNA, rRNA, tRNA 和snoRNA上都有发生m6A修饰。 m6A修饰主要发生在RRACH序列中的腺嘌呤上,其功能由“编码器(Writer)”、“消码器(Eraser)”和“读码器(Reader)”决定[1]。“编码器(Writer)”即甲基转移酶,目前已知这个复合物的成分有METTL3,METTL14, WTAP和KIAA1429;而ALKBH5和FTO作为去甲基酶(消码器)可逆转甲基化;m6A由m6A结合蛋白识别,目前发现m6A结合蛋白(读码器)有YTH结构域蛋白(包括YTHDF1, YTHDF2, YTHDF3, YTHDC1和YTHDC2)和核不均一蛋白HNRNP家族(HNRNPA2B1和 HNRNPC)。
m6A酶系统
METTL3是早先被鉴定为结合SAM的组件,其缺失引起小鼠胚胎干细胞、Hela细胞和HepG2 细胞中m6A peaks的减少。METTL3及其同源蛋白METTL14定位在富含剪切因子的细胞核内亚细胞器-核小斑(Nuclear speckle)上,显示m6A修饰可能和RNA的剪切加工相关。WTAP与METTL3–METTL14 二聚体相互作用,并共定位于核小斑,影响甲基化效率,参与mRNA剪。而KIAA1429作为候选的甲基转移酶复合体的新亚基,是整体甲基化进程所必须的[2]。FTO是ALKB家族的成员,作为第一个被发现的去甲基酶,可影响剪切因子SRSF2的RNA结合能力,进而调控pre-mRNA的剪切加工过程[3]。目前已发现FTO调节异常与肥胖、大脑畸形和生长迟缓相关, 揭示m6A可能对这些疾病具有重要的调节功能[4-6]。ALKBH5是ALKB家族中被发现具有去甲基作用的另一个成员,以RNase A敏感的方式与核小斑共定位,它可直接催化m6A-甲基化腺苷去除甲基而不同于FTO的氧化去甲基化[7]. 此外,ALKBH5和它的去甲基化活性影响新生mRNA合的成和剪切效率[7], 且ALKBH5敲除雄性小鼠表现出精子发生异常,这可能是精子发生相关基因表达改变的结果[7]。m6A mRNA修饰执行其功能主要通过两个途径: 精细调控甲基化转录本的结构,以阻止或诱使蛋白-RNA 相互作用;或被直接由 m6A 结合蛋白识别,诱发后续反应。目前一类含有YTH功能结构域的蛋白被鉴定为m6A修饰的结合蛋白。其中YTHDF1, YTHDF2, YTHDF3, YTHDC1和YTHDC2己被证实是m6A的结合蛋白. YTHDF1主要影响m6A修饰基因的翻译,YTHDF2主要影响m6A修饰基因的降解,而YTHDC1结合m6A修饰的基因后影响其剪接。HNRNPC是一种丰富的核RNA结合蛋白,参与pre-mRNA的加工[8],且研究表明HNRNPC通过m6A与 RNA结合调控目标转录本的丰度和选择性剪切[9].
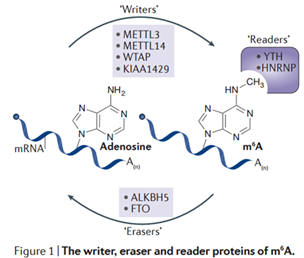
图 1 m6A修饰的酶系统[10]
m6A生物学功能
越来越多的证据表明m6A修饰在哺乳动物中发挥重要的生物功能。例如,在转录后水平上调控RNA的稳定性[11]、定位[12]、运输、剪切[13]和翻译[14]。Claudio R. 等发现依赖METTL3的pri-miRNA甲基化,会促进DGCR8识别和加工,从而促进microRNA的成熟[15]。此外,m6A识别蛋白 HNRNPA2B1促进 pri-miRNA 加工成 pre-miRNA [16]。另外,环状RNA上m6A的修饰能促进环状RNA的翻译[17]。m6A修饰在基因表达调控中起着重要的作用,其调控机制的异常可能与人类疾病或癌症相关。目前发现m6A可能会影响精子发育(ALKBH5,METTL3,Ythdc2)、发育(METTL3、FTO、ALKBH5)、免疫(METTL3)、UV诱导的DNA损伤反应(METTL3,FTO)、肿瘤生成(YTHDF2)或转移(METTL14)、干细胞更新(METTL14)、脂肪分化(FTO)、生物节律、细胞发育分化、细胞分裂及其它的一些生命过程。例如,ALKBH5敲除的雄性小鼠增加了mRNA中的m(6)A修饰,其特点是凋亡影响减数分裂中期的精子细胞,引起生育能力受损[7]。METTL3和METTL14增加弱精症精子的m6A水平[18], 在生殖细胞中,METTL3的敲除严重抑制精子分化和减数分裂的发生,转录组和m6A分析显示 精子发生相关基因的表达和选择性剪接发生了改变[19]。YTHDC2可促进靶基因的翻译效率,并降低其mRNA的丰度,在精子发生过程中起关键作用。当减数分裂开始时YTHDC2表达上调,YTHDC2敲除小鼠的生殖细胞没有经过偶线期的发育导致小鼠不育[20]。在DNA损伤反应中,METTL3可促进DNA聚合酶κ(Pol κ)与核酸剪切修复途径快速定位到UV引起的DNA损伤位点,当缺失METTL3时,细胞无法迅速修复UV照射引起的突变,并且对UV照射更加敏感[25]。在淋巴细胞性小鼠过继转移模型中, Mettl3缺陷通过影响mRNA m6A修饰,降低SOCS家族mRNA衰减,增加mRNA和蛋白表达水平,从而抑制IL-7介导的 STAT5活性和T细胞内稳态增殖和分化,进而抑制肠炎的发生[21]。在肝癌中,METTL14 通过调控pri-miRNA的m6A修饰,影响MiR-126的生成加工,从而抑制肝癌的转移[22]。在乳腺癌细胞中,低氧刺激能促进依赖低氧诱导因子HIF的ALKBH5的表达,而ALKBH5过表达降低了NANOG mRNA的m6A修饰,从而稳定mRNA提高NANOG的表达水平,最终增加乳腺癌干细胞所占的比例[23]。 此外, 低氧诱导乳腺癌细胞中依赖ZNF217的NANOG 和 KLF4 的mRNA m6A甲基化抑制,且ALKBH5敲除显著降低免疫缺陷小鼠乳腺癌的肺转移[24]。在肺癌中,METTL3能够促进肺腺癌细胞的生长、生存和侵袭,但还不清楚它是否作为 m6A 调节器或效应器发挥作用[25]。在急性髓细胞白血病(AML)患者中,m (6) A 调控基因的突变或拷贝数变化与TP53 突变存在密切联系,且m (6) A 调控基因的改变与AML不良预后相关[26]。此外,FTO在AML中高表达,它通过降低mRNA转录本中的m(6)水平,调节ASB2和RARA等靶点的表达,增强了白血病癌基因介导的细胞转化和白血病形成,并抑制全反式维甲酸(ATRA)诱导的AML细胞分化[27]。在脂肪形成过程中,FTO表达与m6A水平成负相关,促进脂肪形成[3]。在胶质细胞瘤样细胞中,ALKBH5 通过lncRNA FOXM1介导FOXM1基因pre-mRNA上的m6A修饰维持胶质瘤细胞的成瘤性[28]。此外,甲基转移酶METTL3或METTL14的敲除,能够改变m6A的富集和ADAM19的表达,极大地促进了胶质瘤细胞的生长、自我更新和肿瘤形成[29]。
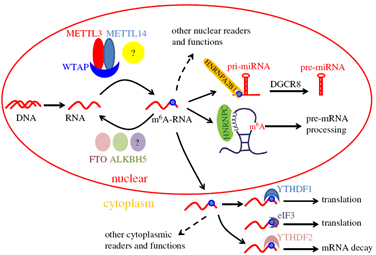
图2 m6A RNA修饰和介导的功能[30]
m6A 的研究方向
(1) 主要是通过研究 m6A修饰相关的甲基化、去甲基化酶和识别蛋白的功能,进而研究m6A修饰的生物学功能和作用机制:一般通过敲除m6A酶分子,研究下游功能基因分子的表达和m6A甲基化情况,通过介导相关基因异常(可变剪切、稳定性、翻译、miRNA 调控)影响细胞表型和功能特征。
(2) m6A修饰图谱构建及作用机制:通过m6A甲基化测序(MeRIP-Seq, miCLIP)构建疾病细胞模型或者发病组织的 m6A 修饰谱,分析m6A的motif, peaks数量及分布,Peak 关联基因的特征,联合RNA-seq研究m6A甲基化与表达的关系。
......






