青蒿素通过KIT/PI3K/AKT通路抑制黑色素瘤根治术后的复发和转移
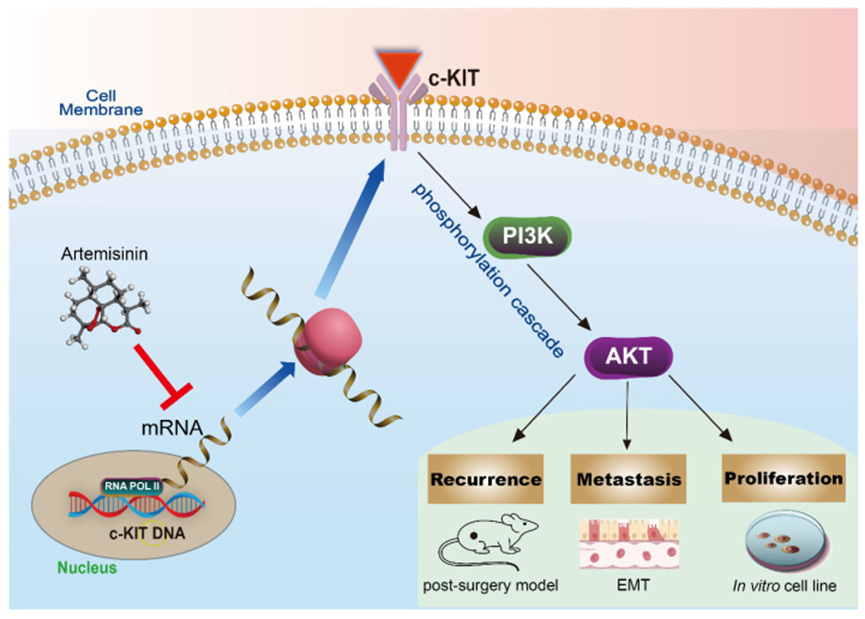
癌症根治性手术是黑色素瘤的主要治疗方式,但几乎所有恶性黑色素瘤患者术后都会出现复发和转移,最终死亡。这一临床困境迫切需要更好的术后治疗药物。青蒿素是一种安全有效的抗疟药物,已在临床上使用数十年。然而,目前尚无关于青蒿素对肿瘤切除后黑色素瘤复发和转移影响的研究。在本研究中,作者在 Balb/c 裸鼠上建立了术后肿瘤模型,发现亚临床剂量的青蒿素能显著抑制肿瘤切除后小鼠的黑色素瘤复发和转移,并延长其生存时间。在 B16 和 A375 细胞系的体外实验中也得到了类似结果。进一步实验证实,青蒿素通过 c-KIT/PI3K/AKT 信号通路在体外和体内抑制根治术后的黑色素瘤。作者的研究结果支持青蒿素在恶性黑色素瘤术后治疗中的潜在应用价值。该文章于 2025 年 1 月发表于《International Journal of Biological Sciences》期刊上,IF:8.2。
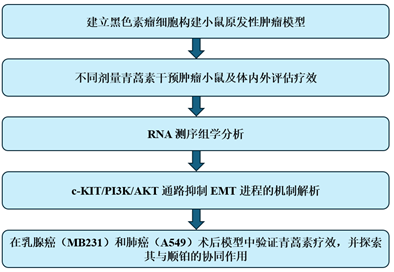
研究技术路线:
主要实验结果:
1、青蒿素联合根治性手术抑制黑色素瘤体内生长
作者首先阐述了青蒿素在体内抑制黑色素瘤的效果。通过切除 B16 黑色素瘤细胞诱导的原发性皮下黑色素瘤,建立了术后模型(图 1A)。癌症根治性手术后,将小鼠分为 5 组,包括阴性对照组(NC)、每天 13.3mg/kg 青蒿素组(Art-13.3mg/kg 组)、每天 40mg/kg 青蒿素组(Art-40mg/kg 组)、每天 40mg/kg 青蒿素 3 次组(Art-40mg/kg×3 组)和顺铂组作为阳性对照,并进行相应处理。随后测量上述处理后小鼠的黑色素瘤复发、转移情况和生存时间。结果显示,40mg/kg 青蒿素组、40mg/kg×3 青蒿素组和顺铂组显著减小了复发性肿瘤的大小。40mg/kg 青蒿素组的效果与阳性对照顺铂相似,而 40mg/kg×3 青蒿素组效果最佳(图 1B)。生存分析还表明,Art-40mg/kg 组和 Art-40mg/kg×3 组的小鼠比 NC 组的小鼠生存时间更长(图 1C)。当小鼠因肿瘤负担死亡或达到实验终点时,作者解剖小鼠检查是否发生肺转移。结果显示,青蒿素抑制了肺转移(图 1D-E)。
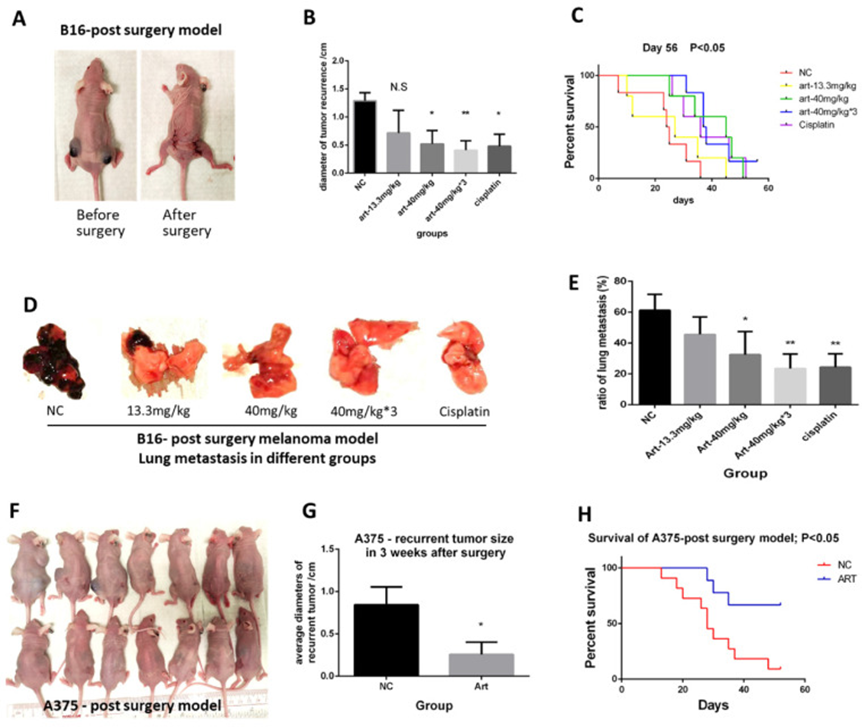
图 1 青蒿素抑制了黑色素瘤的生长、复发和转移,并延长了生存时间。
同时,作者使用另一种黑色素瘤细胞系 A375 来验证结果。在后续实验中,作者发现了相似的趋势,即青蒿素显著减小了复发性肿瘤的大小(图 1F-G),并延长了建模小鼠的预期寿命(图 1H)。
综上所述,青蒿素可以抑制黑色素瘤在癌症根治性切除后的生长、复发和转移,并延长生存时间,其亚临床剂量的抗黑色素瘤效果与顺铂相似,甚至更好。
2、青蒿素抑制黑色素瘤体外生长、迁移和侵袭
作者还使用 B16 和 A375 细胞系证实了青蒿素在体外抑制黑色素瘤的效果。对 B16 细胞进行 MTT 检测,计算不同浓度青蒿素作用下的细胞活力(图 2A),得出青蒿素的半数抑制浓度(IC50)为 214.89μM。因此,在后续的一些实验中,作者选择 200μM 的青蒿素处理 B16 细胞。进行集落形成实验以验证青蒿素可以显著降低 B16 细胞的增殖能力(图 2B-C)。此外,作者通过对 B16 细胞系进行划痕实验,检测不同组别的迁移能力(图 2D)。结果表明,与 NC 组相比,青蒿素(浓度超过 50μM)可以显著缩短 B16 细胞的迁移距离(图 2E)。随后进行 Transwell 迁移和侵袭实验,对穿过聚酯(PET)膜的细胞进行成像和计数(图 2F),这也表明青蒿素可以抑制黑色素瘤的迁移(图 2G)和侵袭(图 2H)。
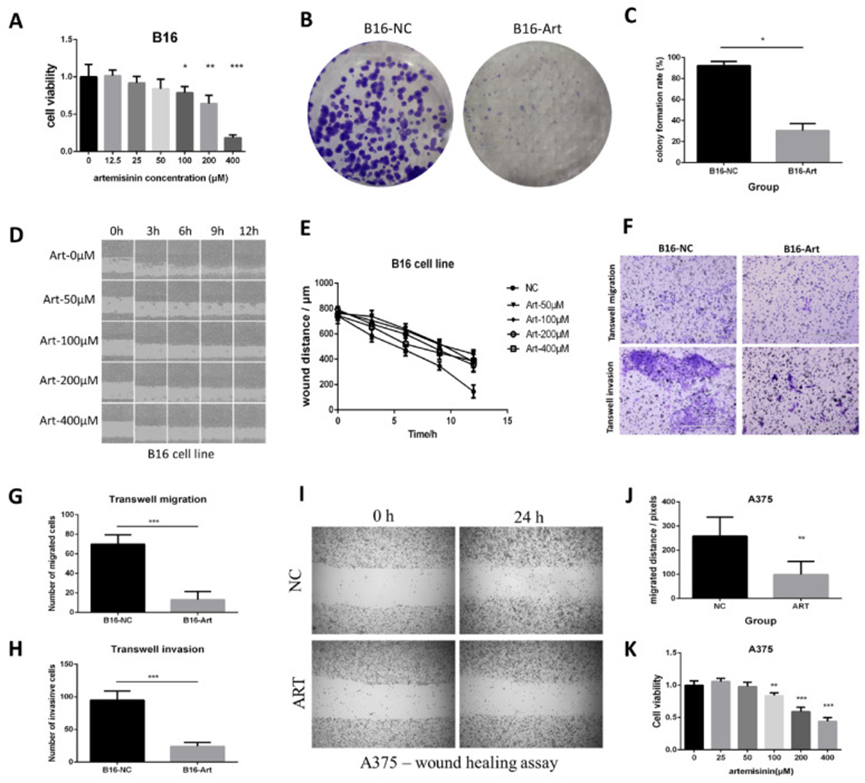
图 2 青蒿素抑制了 B16 和 A375 细胞的增殖、迁移和侵袭。
在 A375 细胞系上也获得了类似的效果。划痕实验表明青蒿素可以显著抑制细胞迁移(图 2I-J)。Transwell 迁移实验和 Transwell 侵袭实验进一步证实,青蒿素显著降低了细胞的迁移和侵袭能力。MTT 检测表明青蒿素也抑制了 A375 细胞的增殖(图 2K),集落形成实验也证明了类似的趋势。
3、基于 RNA 测序和高通量分析筛选青蒿素作用通路
在确定青蒿素在体内和体外均具有抗黑色素瘤作用后,作者通过 RNA 测序分析进一步探究其作用机制。利用术后模型,作者获取了一些组织,根据分组将其命名为原位组(手术前的原发性肿瘤)、复发 - NC 组(N_recur 组,NC 组术后复发性肿瘤)、复发 - Art 组(T_recur 组,青蒿素治疗组术后复发性肿瘤)和肺转移组(Metast 组)。通过火山图展示 N_recur 组和 T_recur 组之间(图 3A)、原发性肿瘤和肺转移之间(图 3B)的差异表达基因。同时,体外处理的差异基因也在火山图中展示,包括 B16-NC 组和 B16-Art 组(图 3C)。然后,基于上述差异基因进行 KEGG 通路分析,并展示每次分析中排名前 20 的通路(图 3D-F)。包括 PI3K-AKT 通路在内的几个通路参与了所有三项分析,这表明这些通路可能与黑色素瘤转移以及体内外青蒿素治疗均相关。
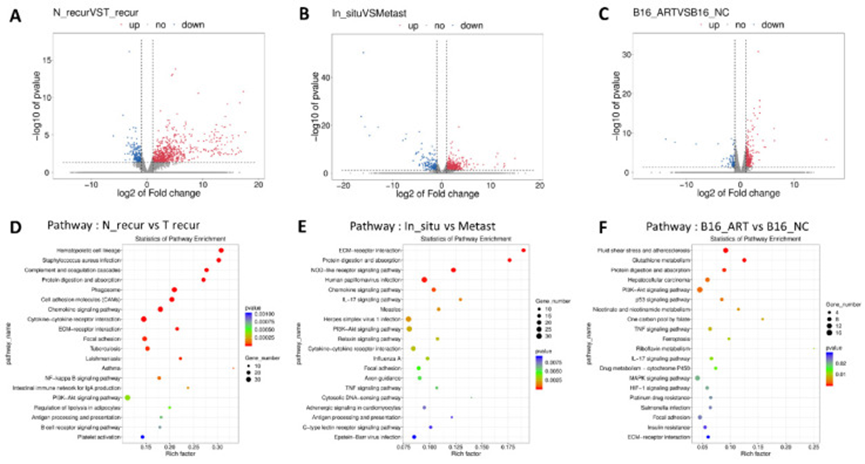
图 3 基于 RNA 测序和高通量分析筛选青蒿素作用通路
4、进一步筛选青蒿素抑制黑色素瘤的潜在靶点
为了确定与青蒿素相关的重要通路,作者绘制了维恩图,展示组织和细胞系中青蒿素相关通路的交集(图 4A)。用气泡图展示了 11 个交集通路(图 4B),其中 PI3K/AKT 信号通路包含的基因数量最多。因此,作者选择该通路作为青蒿素可能激活的潜在通路。作者进一步找出了青蒿素参与 PI3K-AKT 通路的确切差异基因(图 4C-D),这表明 KIT 在体内外均下调,提示 KIT 是青蒿素的一个重要靶点。RT-qPCR 检测证明青蒿素显著降低了 B16 黑色素瘤细胞系中 KIT 的表达(图 4E)。为了证实 KIT 在黑色素瘤中的关键作用,作者基于 TCGA 数据库中的 468 例黑色素瘤患者进行生存分析,确定 KIT 是与黑色素瘤患者预后呈负相关的重要生物标志物(图 4F)。
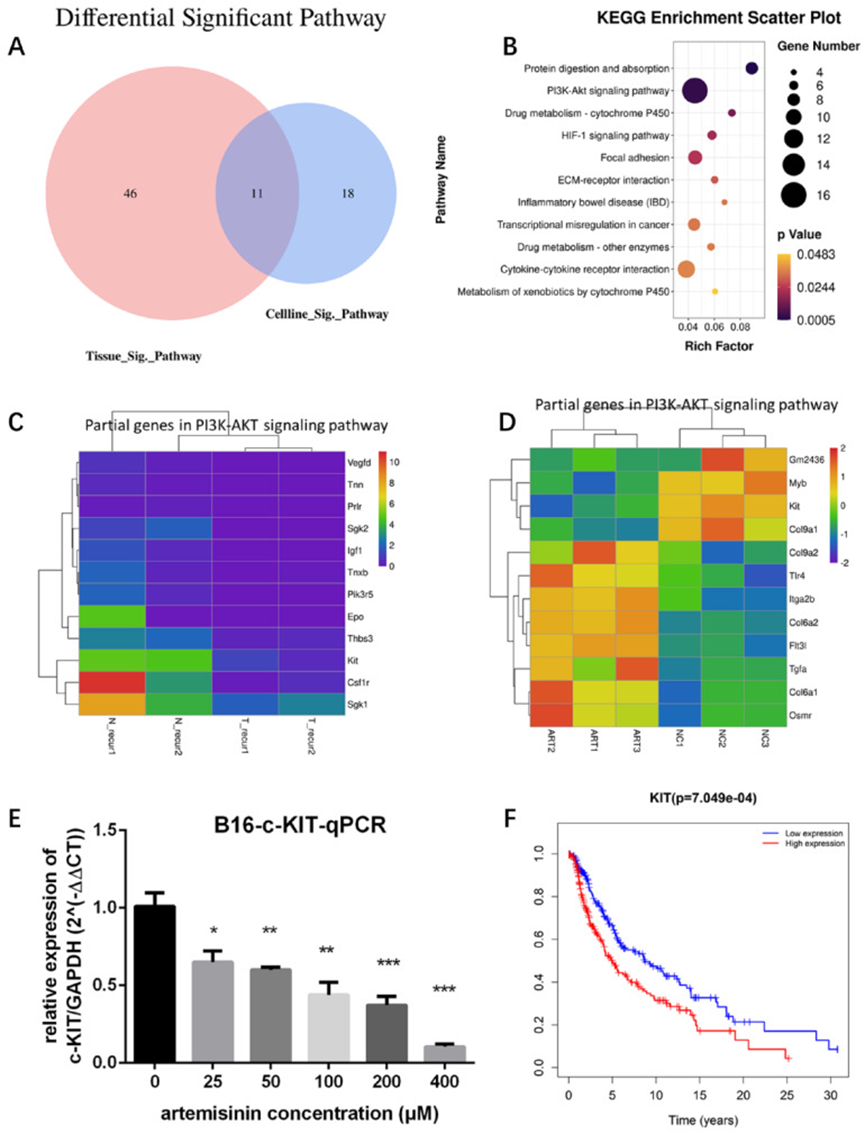
图 4 高通量分析筛选青蒿素的作用靶点
5、青蒿素靶向 c-KIT/PI3K/AKT 信号通路
作者在体内外将青蒿素应用于黑色素瘤,然后进行蛋白质免疫印迹实验,以确认 c-KIT 是青蒿素的靶点(图 5A)。结果显示,青蒿素显著剂量依赖性地降低 c-KIT 表达(图 5B)。它还减弱了 PI3K(ser244/249)、AKT(Thr 308)和 NFKB(ser536)的磷酸化(图 5C-E),这表明青蒿素可能调节由 c-KIT 诱导的 PI3K/AKT 信号通路。
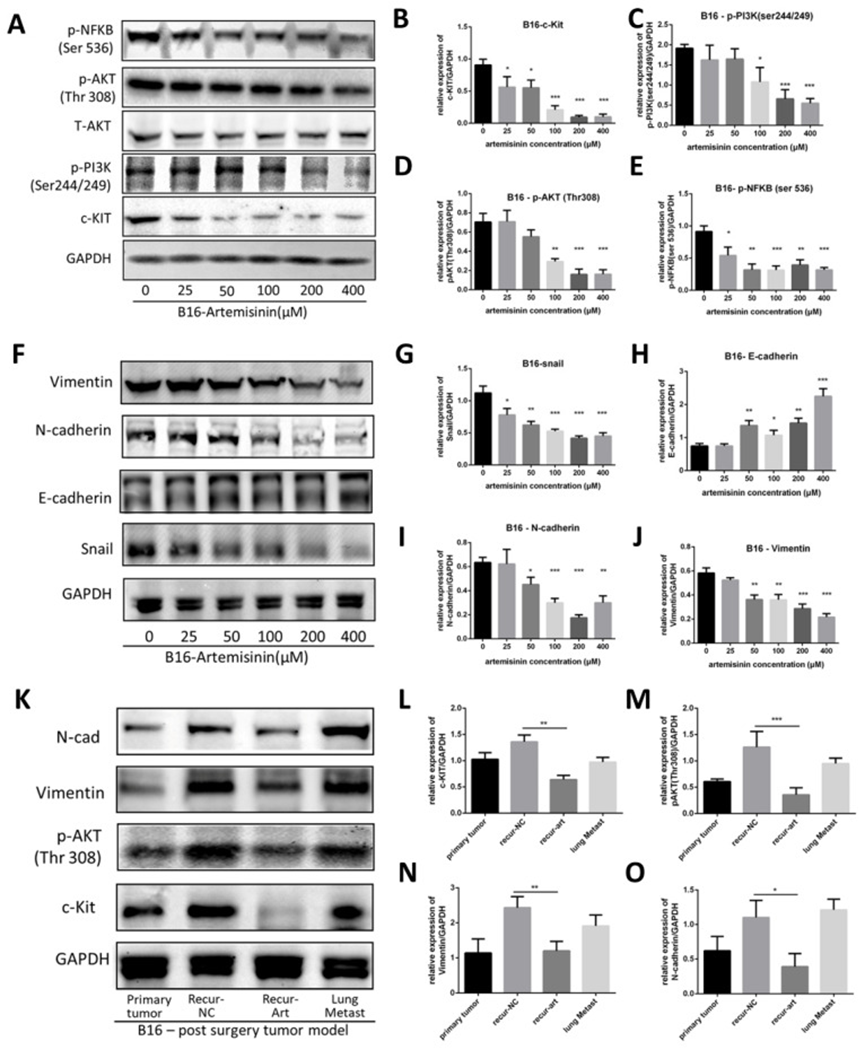
图 5 青蒿素激活 c-KIT 诱导的通路
作者还研究了青蒿素调节的上皮 - 间质转化(EMT)标志物的表达(图 5F)。结果表明,青蒿素显著降低了 Snail、N - 钙粘蛋白和波形蛋白的表达,同时增加了 E - 钙粘蛋白的表达(图 5G-J),支持青蒿素能够抑制 EMT,进而抑制黑色素瘤的迁移和侵袭。
在体内研究中也获得了类似结果,从术后模型收集组织样本进行蛋白质免疫印迹实验,包括手术前的原发性肿瘤、NC 组术后复发性肿瘤、Art 组术后复发性肿瘤和肺转移组织。与复发 - NC 组相比,复发 - Art 组中 c-KIT、磷酸化 AKT、N - 钙粘蛋白和波形蛋白的表达显著降低(图 5K-O)。
这些结果表明,青蒿素可以通过磷酸化级联反应激活 KIT 诱导的 PI3K-AKT 通路,从而抑制黑色素瘤。
6、c-KIT 基因敲除模拟青蒿素的作用效果
为了研究 c-KIT 的作用,作者使用 gRNA-Cas9 技术敲除 B16 细胞中的 c-KIT,随后探究 c-KIT 敲除组(B16-KIT-gRNA)与野生型对照组(B16-NC)之间的差异。集落形成实验表明,敲除 c-KIT 显著抑制了 B16 细胞系的细胞生长(图 6A-B)。MTT 检测也显示出类似的趋势(图 6C)。进行划痕实验研究 c-KIT 敲除对细胞迁移的影响,结果表明敲除 c-KIT 显著抑制了 B16 细胞的迁移(图 6D-E)。
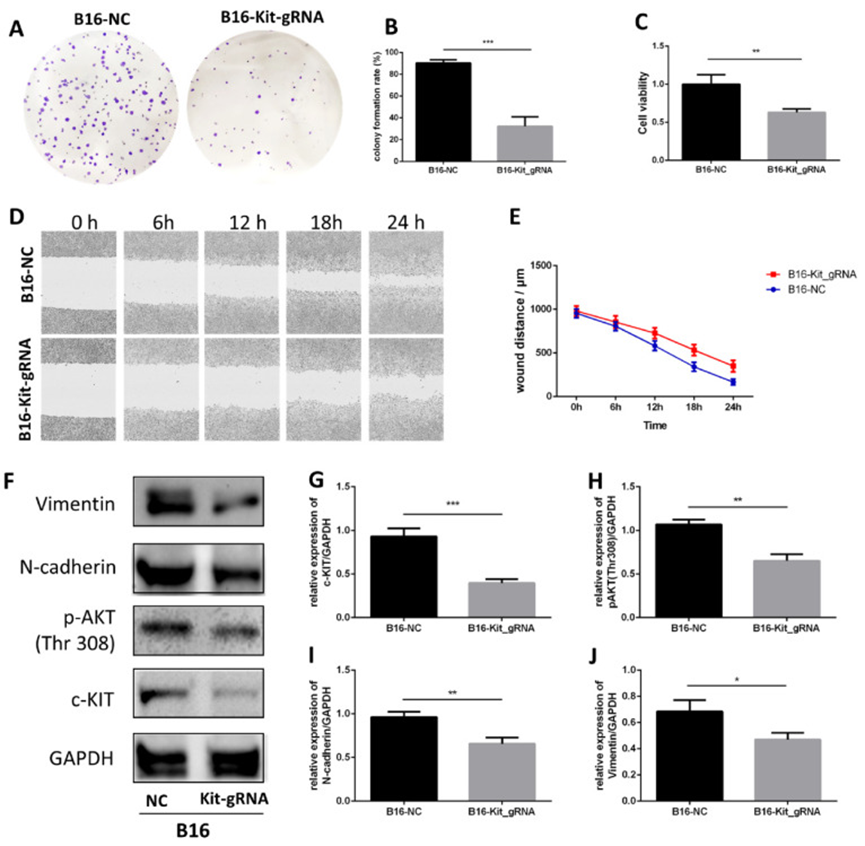
图 6 gRNA-Cas9 技术敲除 c-KIT 显著抑制黑色素瘤
对两组进行蛋白质免疫印迹实验(图 6F)。结果证实,与 B16-NC 组相比,B16-KIT-gRNA 组中 c-KIT 的表达显著降低(图 6G)。正如预期的那样,c-KIT 的下游靶点 AKT(Thr308)的磷酸化被 c-KIT 敲除显著下调(图 6H)。同时,B16-KIT-gRNA 组中的 EMT 生物标志物 N - 钙粘蛋白和波形蛋 白减少(图 6I-J)。
这些结果表明,敲除 c-KIT 可能通过抑制 c-KIT/AKT 信号通路来抑制黑色素瘤的生长和迁移。
7、c-KIT 过表达减弱青蒿素的抗黑色素瘤作用
为了进一步阐明 c-KIT 的作用,作者用过表达 KIT 的质粒转染 B16 细胞。进行了挽救实验,包括三组:阴性对照组(NC)、青蒿素治疗组(Art)和青蒿素治疗加 KIT 过表达组(Art + KIT_OE)。
首先,进行蛋白质免疫印迹实验验证 KIT/PI3K/AKT 通路(图 7A)。结果显示,青蒿素降低了 c-KIT 的表达、磷酸化水平,以及 c-KIT 下游靶点 PI3K 和 AKT 的磷酸化水平,而过表达 c-KIT 则逆转了青蒿素的作用(图 7B-E)。MTT 检测显示,c-KIT 过表达逆转了青蒿素对 B16 细胞的抗增殖作用(图 7F)。划痕实验表明,青蒿素抑制了 B16 细胞的迁移,而 c-KIT 过表达逆转了青蒿素的作用(图 7G-H)。B16 细胞的 Transwell 迁移和侵袭实验也得到了类似的结果,表明 c-KIT 过表达逆转了青蒿素的作用(图 7I-K)。
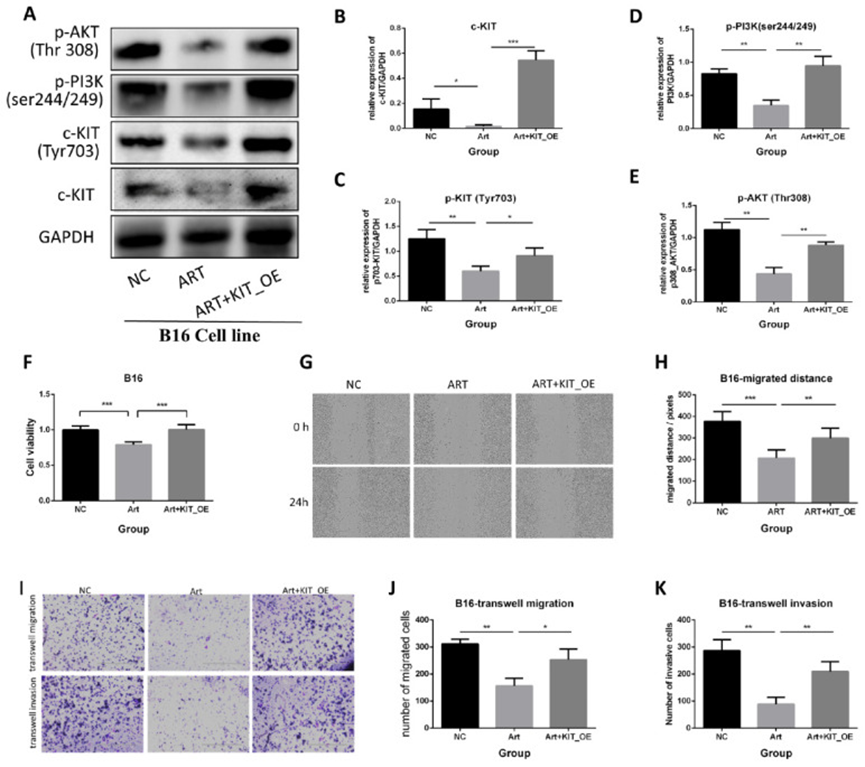
图 7 青蒿素通过 c-KIT 相关通路抑制黑色素瘤,而 KIT 过表达(OE)的挽救实验逆转了这些效果
8、PI3K/AKT 通路抑制剂 LY294002 抑制 B16 和 A375 黑色素瘤细胞系的增殖、迁移和侵袭,并模拟青蒿素的作用
为了检验抑制 PI3K/AKT 通路是否能模拟青蒿素的作用,作者使用了 PI3K/AKT 通路抑制剂 LY294002。MTT 检测、划痕实验和 Transwell 实验表明,PI3K/AKT 通路抑制剂 LY294002 与青蒿素一样抑制了细胞的增殖、迁移和侵袭(图 8A-F)。在另一种黑色素瘤细胞系 A375 中也获得了类似的结果(图 8G-L)。这些结果表明,PI3K/AKT 通路是体外抑制黑色素瘤细胞系 A375 和 B16 的关键靶点。
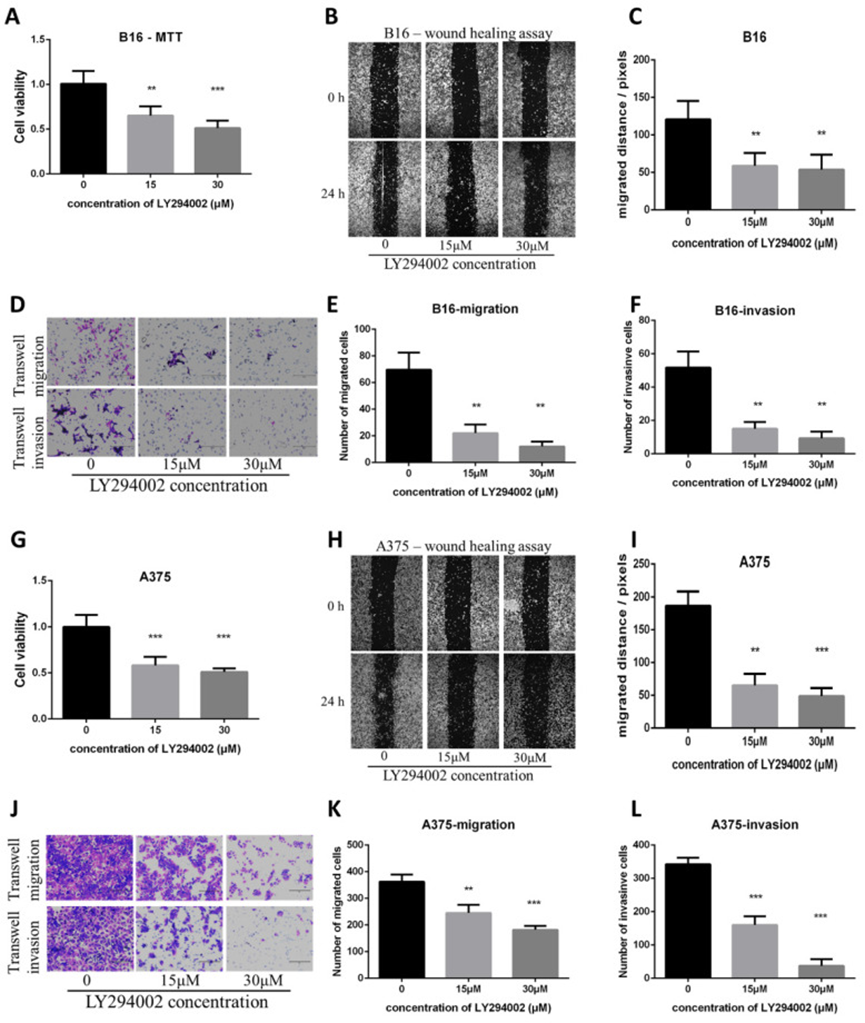
图 8 PI3K/AKT 抑制剂 LY294002 降低 B16 和 A375 黑色素瘤细胞系的增殖、迁移和侵袭能力
9、AKT 激活剂减弱青蒿素在 B16 和 A375 黑色素瘤细胞系中的抗增殖、抗迁移和抗侵袭作用
作者还使用 AKT 激活剂 SC79 进一步验证 AKT 在青蒿素体外抗癌作用中的作用,在 B16 和 A375 细胞系中均进行了实验。实验设置了三组细胞:阴性对照组(NC)、青蒿素组(Art)和青蒿素加 SC79 组(ART+SC79)。MTT 检测、划痕实验和 Transwell 实验表明,青蒿素抑制了细胞的增殖、迁移和侵袭,而 AKT 激活剂减弱了青蒿素在 B16 细胞和 A375 细胞中的这些作用(图 9)。这些结果进一步证实了 Akt 在青蒿素对 B16 和 A375 细胞系抗癌作用中的作用。
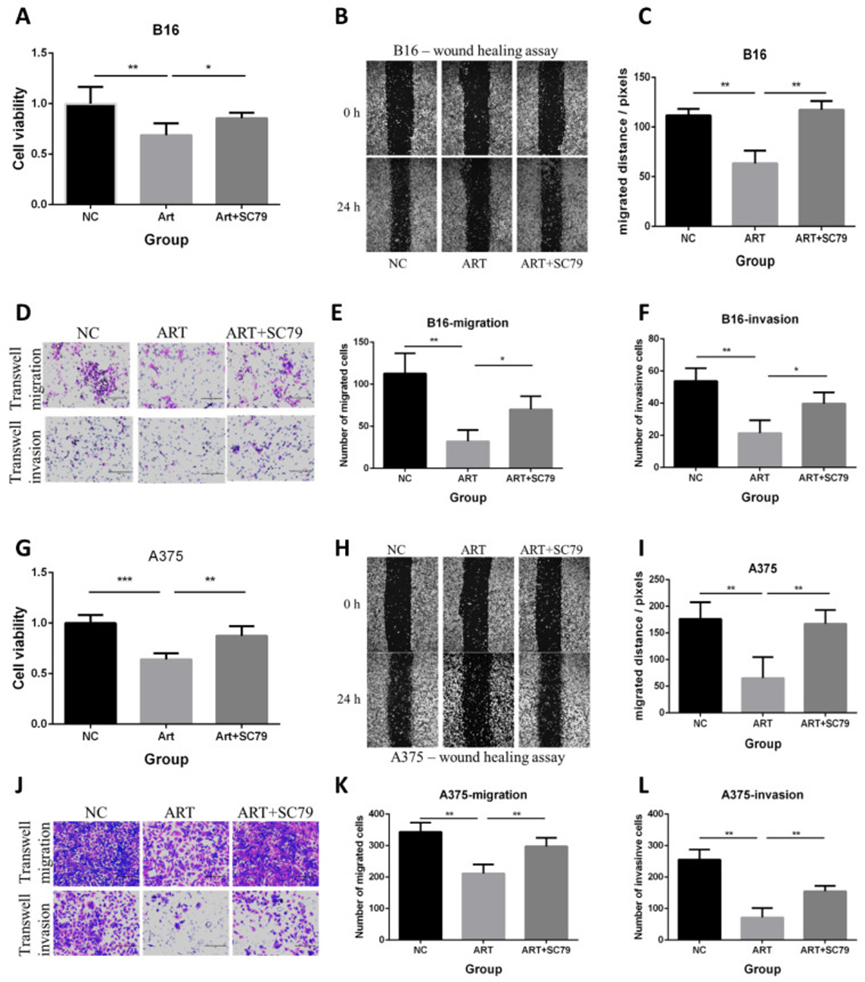 图 9 AKT 激活剂 SC79 减弱青蒿素在 B16 和 A375 黑色素瘤细胞中的抗增殖、抗迁移和抗侵袭作用
图 9 AKT 激活剂 SC79 减弱青蒿素在 B16 和 A375 黑色素瘤细胞中的抗增殖、抗迁移和抗侵袭作用
10、c-KIT 过表达促进黑色素瘤生长,而 PI3K/AKT 抑制剂 LY294002 逆转其作用
作者进一步进行了一系列挽救实验,以证明 B16 黑色素瘤细胞系中 c-KIT 与 PI3K/AKT 之间的调节关系。蛋白质免疫印迹显示,c-KIT 过表达显著提高了 AKT 的磷酸化水平,而 LY294002 即使在 c-KIT 过表达的情况下也降低了 AKT 的磷酸化水平。然后,一系列体外实验表明,c-KIT 过表达显著促进了黑色素瘤的增殖、迁移和侵袭,而 LY294002 逆转了这些趋势。这些结果证实,c-KIT 可以通过 AKT 磷酸化调节黑色素瘤。
11、双氢青蒿素和青蒿琥酯在癌症根治术后抑制黑色素瘤体内生长
作者还检测了两种青蒿素衍生物双氢青蒿素(DHA)和青蒿琥酯(AS)在癌症根治术后对黑色素瘤的体内抑制作用。与青蒿素的实验类似,对动物进行相应处理,并测量小鼠的黑色素瘤复发、转移和生存时间。图 10A 显示,DHA 和 AS 在 4 周内显著减小了复发性肿瘤的大小。AS 的治疗效果更好(图 10B)。图 10C-D 显示,DHA 和 AS 抑制了黑色素瘤的转移。生存分析表明,DHA 和 AS 显著延长了术后模型中小鼠的生存时间(图 10E)。MTT 检测也证实了 AS 的体外作用,证明 AS 显著抑制了 B16 细胞系的生长(图 10F)。
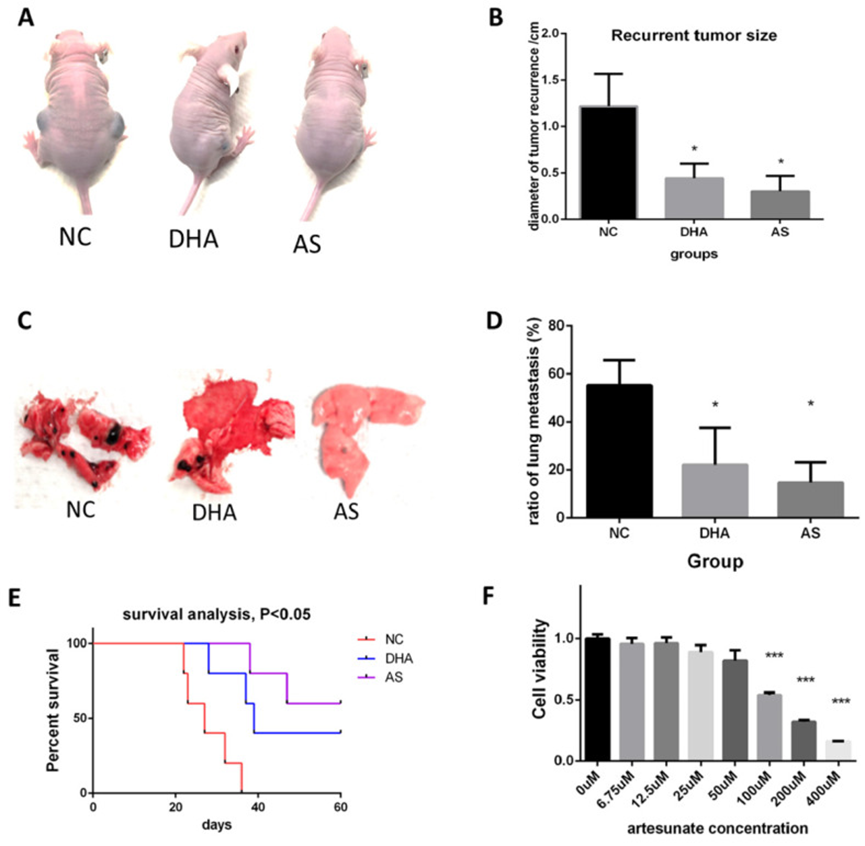 图 10 双氢青蒿素(DHA)和青蒿琥酯(AS)在癌症根治术后体外和体内抑制黑色素瘤生长
图 10 双氢青蒿素(DHA)和青蒿琥酯(AS)在癌症根治术后体外和体内抑制黑色素瘤生长
作者进一步比较了青蒿素及其衍生物在体内外的治疗效果和可能的副作用。此前,作者已经分别证明了 ART、DHA 和 AS 在术后模型中的作用。现在,作者在同一批小鼠模型中比较了它们对抑制复发性黑色素瘤的效果。同样,所有药物(包括 ART、DHA 和 AS)均以 40mg/kg 的剂量腹腔注射给术后小鼠,以 10% DMSO 作为阴性对照(NC)。与 NC 组相比,DHA 和 AS 呈现出相似的趋势,在抑制术后黑色素瘤复发方面比 ART 更显著,但 ART 与 DHA/AS 之间的差异无统计学意义。术后所有组小鼠体重变化均无显著差异,这表明 ART 或其衍生物引起的副作用是可耐受的。体外 MTT 检测显示,与顺铂阳性对照相比,DHA 和 AS 在 B16 细胞系中具有相似的抗增殖作用,且优于 ART。另一方面,ART(200μM)和顺铂(100μM)联合使用比单独使用 ART 能进一步抑制黑色素瘤生长,这表明 ART 和顺铂之间存在协同作用。
12、青蒿素在癌症根治术后抑制乳腺癌和肺癌体内生长
为了研究青蒿素在癌症根治术后对其他癌症的抗癌作用,作者在类似实验中使用了乳腺癌和肺癌模型。作者用 MB231 细胞系建立了乳腺癌术后肿瘤模型,用 A549 细胞系建立了肺癌术后肿瘤模型(图 11A)。作者检测了 MB231 诱导的肿瘤模型在术后 3 周不同组别的复发性肿瘤大小。结果显示,与阴性对照组相比,青蒿素在 4 周内显著减小了复发性肿瘤的大小(图 11B)。在肺癌细胞系 A549 诱导的术后模型中也证实了类似的结果(图 11C-D)。此外,体外 MTT 检测也表明,青蒿素在体外抑制了 MB231 细胞系和 A549 细胞系的生长(图 11E-F)。
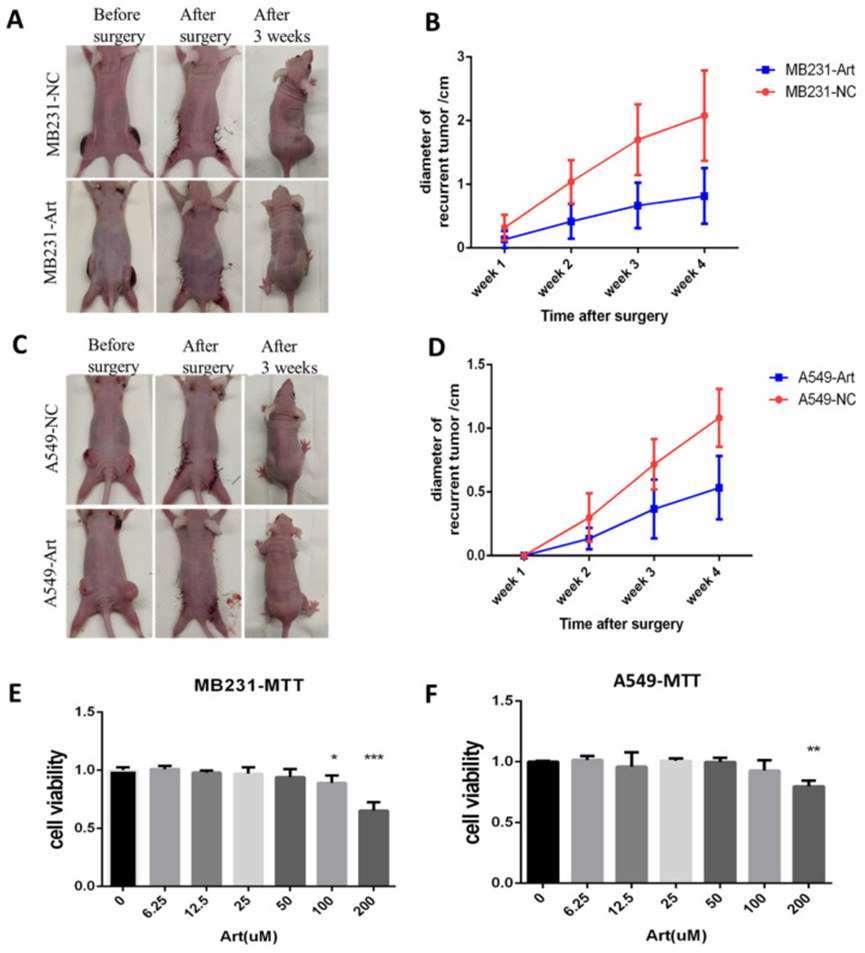 图 11 青蒿素在体外和术后小鼠模型中也抑制乳腺癌和肺癌生长
图 11 青蒿素在体外和术后小鼠模型中也抑制乳腺癌和肺癌生长
结论:
青蒿素可以抑制黑色素瘤复发和转移,并延长小鼠模型中癌症根治手术后生存寿命。青蒿素通过 c-KIT/PI3K/AKT 通路在体内和体外发挥抗黑色素瘤作用,这支持了其在癌症患者术后治疗中的潜在治疗效果。
实验方法:
RNA 测序、细胞培养、转染、MTT检测、集落形成实验、划痕实验、transwell实验、qRT - PCR、Western blot、HE 染色、小鼠皮下肿瘤模型及基于皮下肿瘤模型的术后肿瘤模型
参考文献:
Zhou Z, Farhan M, Xing X, Zhou W, Lin R, Zeng S, Li M, Zheng W. Artemisinin Suppressed Melanoma Recurrence and Metastasis after Radical Surgery through the KIT/PI3K/AKT Pathway. Int J Biol Sci. 2025 Jan 1;21(1):75-94. doi: 10.7150/ijbs.97341. PMID: 39744440; PMCID: PMC11667813.






