RIOK1相分离通过应激颗粒激活肝癌肿瘤生长限制PTEN翻译
对酪氨酸激酶抑制剂(TKIs)的耐药性削弱了其在肝细胞癌(HCC)中的临床疗效。通过相分离形成的应激颗粒对应激反应至关重要,并且可能参与治疗耐药性,但其在肝细胞癌中的机制尚不清楚。作者的筛选结果显示,非典型丝氨酸/苏氨酸激酶RIOK1在肝细胞癌中高表达,与预后不良相关,并且在多种应激条件下通过NRF2转录激活。RIOK1通过将IGF2BP1和G3BP1整合到应激颗粒中发生液 - 液相分离,这些应激颗粒可隔离PTEN信使RNA,从而减少其翻译。这一过程激活了磷酸戊糖途径,有助于应激解除和对TKI的细胞保护。作者进一步发现,小分子抑制剂西达本胺(chidamide)可下调RIOK1,并增强TKI的疗效。在对多纳非尼耐药的肝细胞癌患者肿瘤中发现了RIOK1阳性的应激颗粒。总之,作者的研究示了应激颗粒动态变化、代谢重编程与肝细胞癌进展之间的联系,为提高TKI的疗效提供了潜在手段。该研究于2025年6月发表在《Nature Cancer》,IF 28.5分。
技术路线:
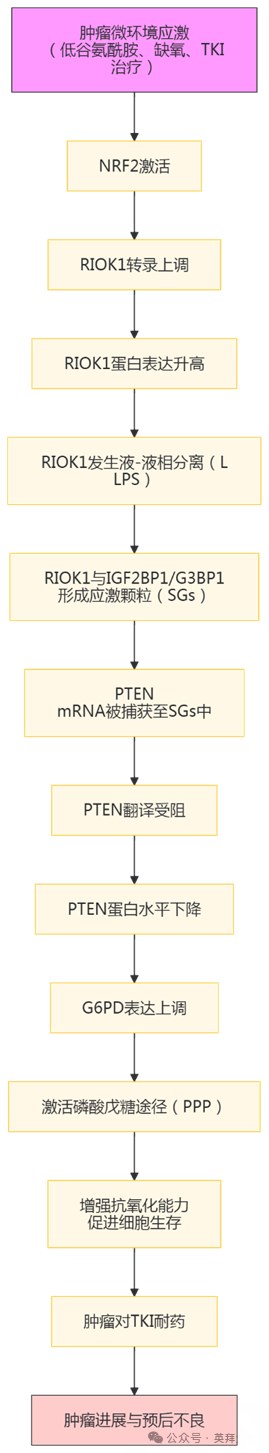
主要研究结果:
1、RIOK1高表达与肝细胞癌(HCC)进展相关
为了识别肝细胞癌(HCC)中与生死命运相关的应激标志物,特别是激酶相关基因,作者重新分析了Tarumoto及其同事进行的以激酶结构域为重点的CRISPR筛选,以提取HCC特异性候选基因(图1a)。了识别适应性反应蛋白作为特定的脆弱点,作者对在谷氨酰胺(GLN)剥夺条件下HCC细胞中上调的激酶进行了蛋白质组学筛选,模拟肝脏肿瘤的低谷氨酰胺微环境(图1b)。这些数据的交集确定了RIOK1为仅有的候选基因(图1c、d),这促使作者研究其在HCC中的作用以及与患者预后的相关性。
值得注意的是,作者证实了RIOK1在HCC中与邻近组织相比具有显著更高的mRNA和蛋白表达水平(图1e-g)。通过对涉及HCC肿瘤的空间转录组学数据分析,作者发现RIOK1与谷氨酰胺代谢相关基因表现出互斥的空间表达模。此外,作者进一步调查了来自国际癌症基因组联盟(ICGC)和NCBI基因表达综合(GEO)数据库的另外九个公开可用的HCC数据集,进一步验证了RIOK1 mRNA在HCC中的差异性上。在TCGA数据集中,根据RIOK1肿瘤表达水平对HCC患者进行分层显示,高表达与更差的总生存率和无病生存率密切相。接下来,作者继续探索RIOK1在HCC细胞系模型中的功能。
对HCC细胞系中的mRNA和蛋白水平进行调查发现,HCCLM3和MHCC-97H细胞中的RIOK1表达水平高于SNU449和PLC/RNF/5细。因此,作者使用shRNA靶向HCCLM3和MHCC-97H细胞中的RIOK1,同时在SNU449和PLC/RNF/5细胞中构建稳定的RIOK1过表达。然后,作者使用CCK-8和集落形成实验评估了RIOK1操作后的生长表型。通过两个独立序列进行的RIOK1敲低减少了HCC细胞的生长,而强制RIOK1上调则增强了增殖(图1h-l)。在体内实验中也观察到了类似的结果,RIOK1敲低的HCCLM3细胞的皮下异种移植物比对照组生长得更慢(图1m、n)。因此,RIOK1的表达与体外和体内HCC细胞的生长相关,尽管其机制尚未明确。
关于RIOK1敲低如何影响HCC细胞增殖的一个线索是诱导了“荷包蛋”细胞表型,暗示了细胞衰老。事实上,SA-β-半乳糖苷酶染色显示,在RIOK1敲低后,衰老细胞明显增多,并伴随着γ-H2AX焦点的积累,表明与衰老相关的异染色质焦点(图1o-q)。通过比较RNA-seq和京都基因与基因组百科全书(KEGG)通路富集分析发现,RIOK1敲低所改变的基因与PI3K/AKT信号通路相关,表明该通路是RIOK1的下游通路。对关键调控和衰老检查点标记物的分析显示,在RIOK1敲低后,PTEN、p21、p27和γ-H2AX蛋白水平升高,而RIOK1过表达则降低了这些蛋白水。值得注意的是,RIOK1操作后PTEN mRNA水平保持不变,而p21和p27的转录水平与其蛋白变化一。进一步值得注意的是,沉默RIOK1抑制了PTEN下游信号传导,显著降低了Akt-Thr308、p70S6K和4E-BP1的磷酸化。这些发现共同表明,高RIOK1表达可能促进HCC的进展。
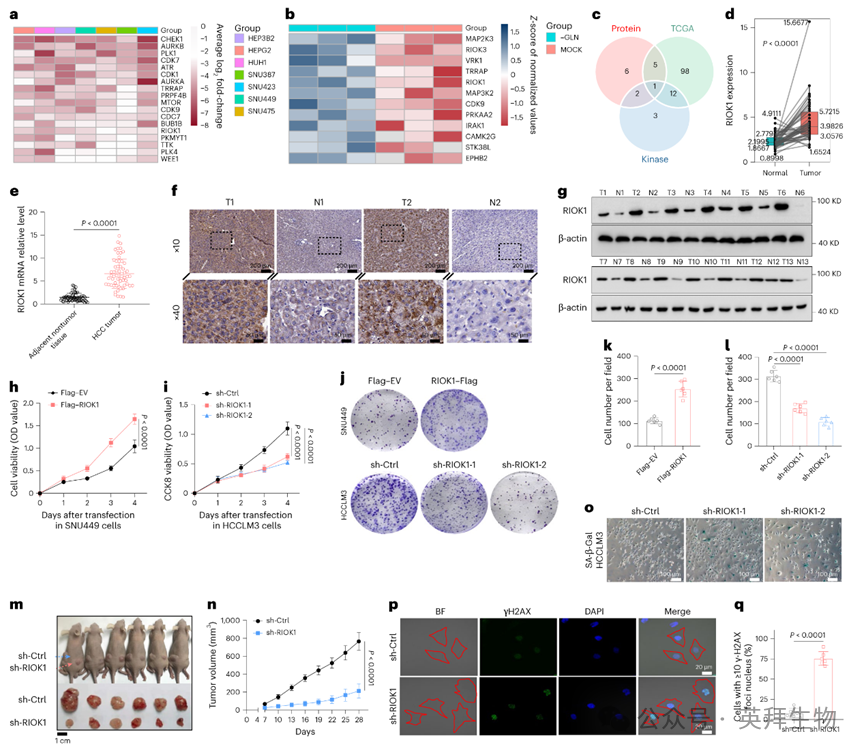
图1:RIOK1是与HCC进展相关的激酶相关基因
2、RIOK1通过IGF2BP1-G3BP1相互作用驱动应激颗粒(SGs)的组装
为了阐明RIOK1的功能,作者通过免疫沉淀(IP)质谱(MS)在HCCLM3细胞中鉴定其结合伙伴。一个显著的共沉淀带与G3BP1和IGF2BP1匹配,这些分别的关联通过Western blotting和共免疫沉淀实验与Flag-RIOK1和HA标记的构建体得到确认(图2a-d)。RIOK1是一种缺乏激活环和底物识别位点的非典型丝氨酸/苏氨酸激酶,尽管其激酶活性与细胞周期进展和核糖体生物发生有关。作者假设RIOK1可能影响G3BP1或IGF2BP1的磷酸化。Phos-tag SDS凝胶实验显示,RIOK1过表达降低了IGF2BP1的磷酸化水平,而RIOK1敲低则增加了其磷酸化水平,尽管对G3BP1的磷酸化没有影响(图2e、f)。此外,体外下拉实验显示RIOK1直接与IGF2BP1结合,但不与G3BP1结合,表明有一个中间蛋白介导了RIOK1-G3BP1的相互作用(图2g、h)。为了确定RIOK1与IGF2BP1相互作用所需的区域,作者使用两种蛋白的截短形式进行了结构域绘图实验。分析显示,RIOK1的羧基末端区域(480-568氨基酸)与IGF2BP1结合,而IGF2BP1的中部区域(345-577氨基酸)介导了其与RIOK1的相互作用(图2i、)。
然后,作者重新考虑了RIOK1和IGF2BP1磷酸化之间的关系。在SNU449细胞中转染RIOK1的激酶区域并未改变IGF2BP1的磷酸化状。相应地,共免疫沉淀实验显示,RIOK1过表达并未影响IGF2BP1的丝氨酸/苏氨酸磷酸化,而是降低了其酪氨酸磷酸化水平(图2k),这意味着RIOK1以激酶独立的方式影响IGF2BP1的磷酸化。作者注意到一个可能的类比,即IGF2BP1的RNA结合活性需要SRC介导的酪氨酸396磷酸化,而且,阻止Tyr396磷酸化会导致IGF2BP1被隔离到细胞质颗粒中,并伴随着其客户转录本的翻译沉默。因此,作者推测RIOK1-IGF2BP1的相互作用旨在抑制IGF2BP1中Tyr396的磷酸化水平,并随之形成依赖IGF2BP1的颗粒。因此,作者使用免疫荧光染色检查了RIOK1表达如何影响IGF2BP1的细胞分布。值得注意的是,异位RIOK1被观察到与IGF2BP1共聚在类似于应激颗粒(SGs)的结构中(图2l)。
与此同时,作者检查了G3BP1,它本身是SG组装的核心节点,并与IGF2BP1合作形成RNA-蛋白(RNP)颗粒,观察到在过表达RIOK1的细胞中,IGF2BP1和G3BP1在类似SG的焦点中表现出强烈的共染色(图2m-)。值得注意的是,这些结构在已知可解聚SGs的CHX处理后分散,并且时间延迟成像显示,共表达G3BP1的RIOK1诱导的颗粒持续了数天(图2p-r)。相反,在arsenate刺激下,RIOK1敲低减少了它们的动态组。这些结果共同表明,RIOK1对于IGF2BP1和G3BP1建立SGs很重要,也表明G3BP1通过IGF2BP1与RIOK1相关联。支持后者的概念,两步免疫沉淀的结果显示,当与HA-IGF2BP1共表达时,内源性G3BP1在第一阶段与Flag-RIOK1的免疫沉淀中更强烈地被回收。在用Flag肽洗脱后,针对HA的第二阶段免疫沉淀确认了Flag-RIOK1、HA-IGFBP1和G3BP1作为一个三元复合体存在(图2s)。综合这些结果表明,RIOK1影响IGF2BP1中的调控磷酸化事件,调节由IGF2BP1和G3BP1形成的RNA结合蛋白(RBPs)的动态。
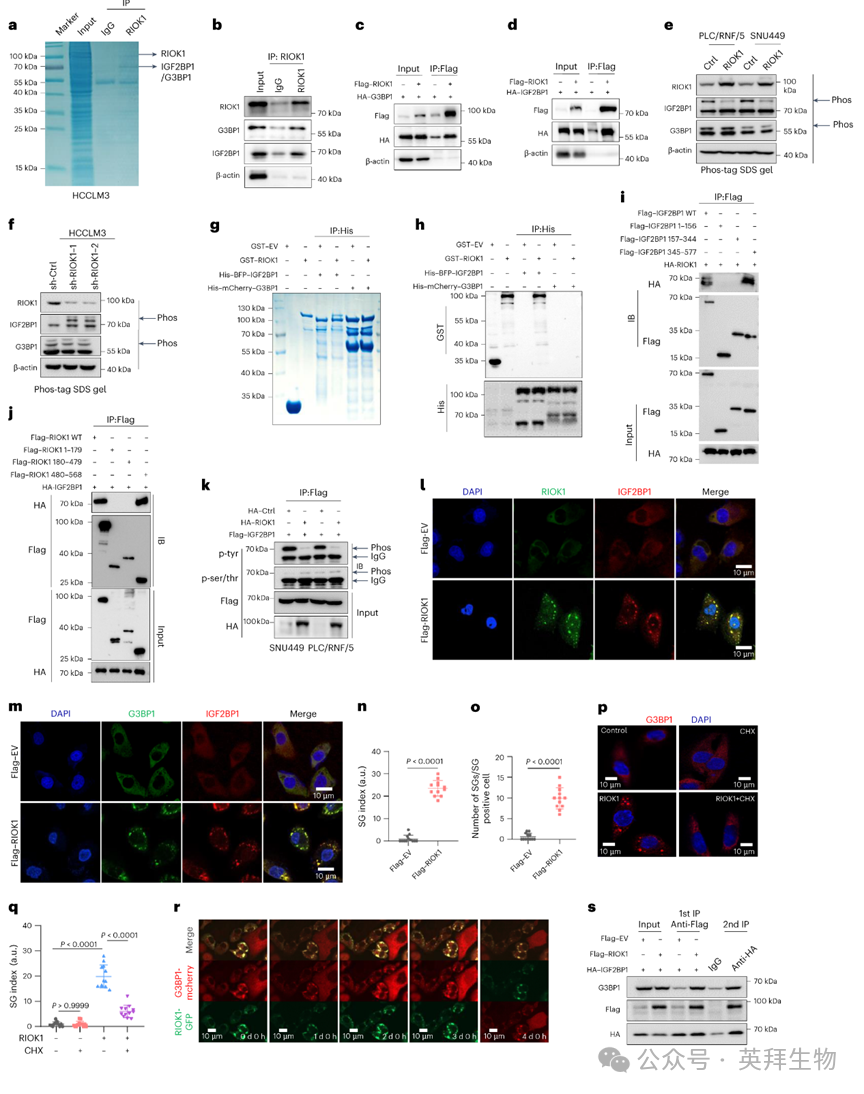
图2:RIOK1促进IGF2BP1和G3BP1之间的相互作用以增强SG组装
3、RIOK1在体内和体外均发生液 - 液相分离(LLPS)
液 - 液相分离可以通过核酸蛋白中的内在无序区域(IDRs)来促进。利用PONDR,作者在RIOK1的C末端检测到了IDRs,这些区域可能有助于相变事件的发生(图3a)。为了验证这一概念,作者将RIOK1-IDR与拟南芥Cry2蛋白的光解酶同源区进行了融合,Cry2蛋白在暴露于蓝光时会发生自我聚集。值得注意的是,RIOK1-IDR-Cry2融合蛋白表现出快速的蓝光依赖性聚集(图3b)。此外,通过实验发现,当删除IDR(ΔIDR-RIOK1)后,异位表达RIOK1-绿色荧光蛋白(GFP)的细胞中细胞质液滴的形成被消除(图3c、d)。
液 - 液相分离结构具有流动性,能够融合、分散,并允许液相内的分子移动。事实上,较小的RIOK1-GFP液滴倾向于聚合成较大的结构,而较大的液滴则会分裂成较小的液滴(图3e)。对细胞内RIOK1-GFP液滴进行光漂白后荧光恢复(FRAP)成像显示,在漂白区域大约30秒后荧光恢复(图3f),这表明RIOK1是移动相的一部分。正如预期的那样,作者发现在体外,重组RIOK1-GFP在聚乙二醇8000存在的情况下以及独立地以浓度依赖的方式形成了液滴(图3g、h)。此外,这些液滴随着时间的推移被观察到融合,FRAP成像显示漂白区域的荧光恢复迅速,这表明在液相中发生了动态交换事件(图3i - k)。因此,RIOK1本质上会发生液 - 液相分离。
为了将RIOK1与应激颗粒(SGs)/RNA结合蛋白(RBPs)的形成与其与IGF2BP1的相互作用联系起来,作者进行了体外相分离实验,发现纯化的RIOK1-GFP和IGF2BP1-BFP能够被整合到可融合的液滴中(图3l)。进一步的实验表明,与ΔIDR-RIOK1-GFP相比,RIOK1-GFP增强了IGF2BP1进入颗粒的能力,而ΔIDR-RIOK1则无法促进IGF2BP1的相变(图3m)。值得注意的是,ΔIDR-RIOK1还显示出抑制IGF2BP1酪氨酸磷酸化的能力降低,这将IGF2BP1的磷酸化与RIOK1介导的LLPS联系起来(图3n)。进一步的实验表明,异位表达的RIOK-GFP、IGF2BP1-BFP和G3BP1-mCherry能够在细胞内的类似SGs的结构中共表达,同时重组蛋白混合物也能够在体外形成可融合的结构。因此,作者的综合发现表明,RIOK1介导的LLPS与IGF2BP1和G3BP1协同促进颗粒的形成。
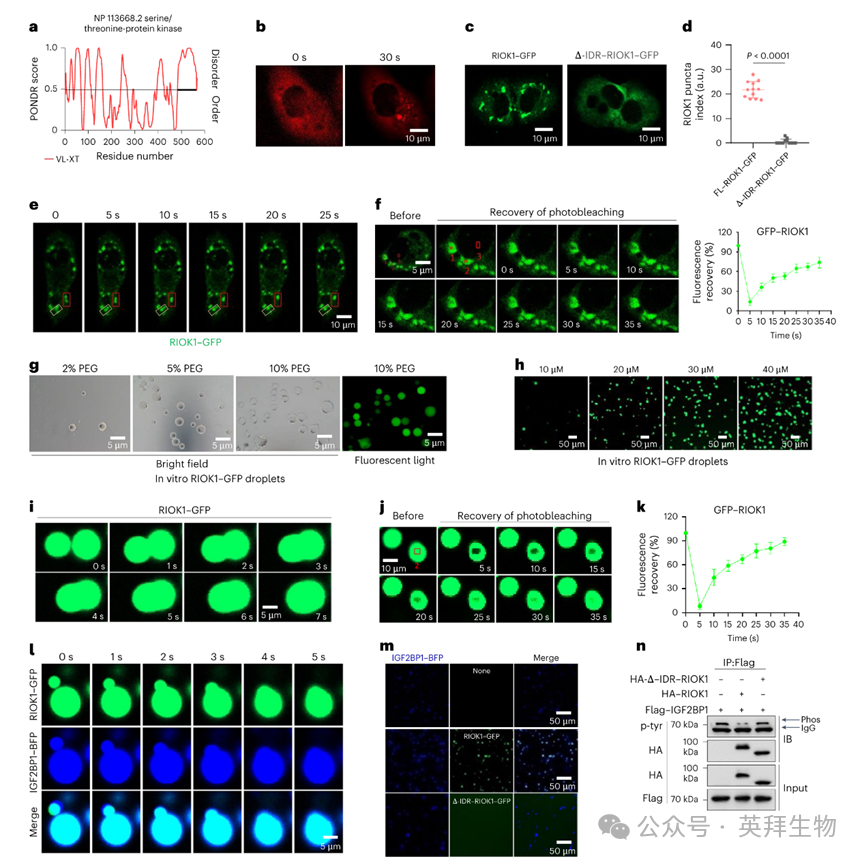
图3:RIOK1通过其羧基末端IDR区经历LLPS
4、RIOK1的LLPS抑制PTEN的翻译
在明确了RIOK1-IGF2BP1-G3BP1复合体之后,作者对其生理相关性进行了研究。鉴于IGF2BP1能够稳定PTEN mRNA的证据以及作者发现的RIOK1驱动的PTEN mRNA翻译阻断,作者假设RIOK1介导的与IGF2BP1/G3BP1的应激颗粒(SG)形成调控了PTEN的翻译状态。支持这一假设的是,在确认了PTEN mRNA smFISH探针的有效性之后,全长RIOK1的过表达(而非ΔIDR-RIOK1突变体)促使PTEN mRNA聚合成IGF2BP1/G3BP1颗粒(图4a - c。在对照组或ΔIDR-RIOK1细胞中,PTEN mRNA和蛋白水平保持不变,而全长RIOK1则降低了PTEN蛋白水平(图4d、e)。
为了更好地定义PTEN mRNA与SG成分之间的复合体,作者在表达HA-IGF2BP1的细胞中进行了两步免疫沉淀实验,这些细胞分别表达Flag-空载体(EV)、Flag-RIOK1或Flag-ΔIDR-RIOK1构建体。第一阶段使用抗HA抗体的免疫沉淀表明,完整的RIOK1对于富集PTEN mRNA的回收至关重要。第二阶段针对G3BP1的免疫沉淀证实,HA-IGF2BP1、G3BP1、Flag-RIOK1和PTEN mRNA形成了四元复合体(图4f),这很可能代表了完整细胞中观察到的SGs。利用纯化的GFP-RIOK1、IGF2BP1-BFP和荧光标记的PTEN mRNA进行的相分离实验进一步表明,全长RIOK1(而非ΔIDR-RIOK1-GFP突变体)增强了含有PTEN mRNA的IGF2BP1液滴的形成(图4g),这表明RIOK1介导的LLPS促进了PTEN mRNA被隔离到SGs中。
多聚体分析实验正式确立了RIOK1与PTEN翻译调控之间的联系。尽管RIOK1的过表达微妙地促进了多聚体的组装,但含有PTEN mRNA的延伸多聚体数量减少,这表明RIOK1通过LLPS劫持PTEN mRNA暂停了其翻译(图4h、i)。支持这一观点的是,在SNU449细胞中通过转染与G3BP1无关的GFP-“合成”构建体来模拟合成SG的形成。该构建体在氧化应激下恢复了G3BP1/2敲低细胞中的SG形成(图4j - m)。在G3BP1敲低细胞中共同表达RIOK1和GFP-“合成”构建体能够在正常条件下诱导SG形成,富集SGs中的PTEN mRNA并降低PTEN表达(图4n - q)。这些结果共同将RIOK1介导的SGs与PTEN mRNA的翻译抑制因果联系起来。
接下来,作者研究了RIOK1、IGF2BP1酪氨酸磷酸化和通过LLPS隔离PTEN mRNA之间的联系。事实上,ΔIDR-RIOK1突变体无法抑制IGF2BP1酪氨酸磷酸化以及无法参与LLPS,这暗示了这两种活性在调控PTEN翻译中的重要性。为了验证这一点,作者构建了一个磷酸化抗性IGF2BP1(Y396A)突变体。正如预期的那样,RIOK1的过表达降低了与野生型IGF2BP1共表达的细胞中的PTEN蛋白水平,但并未降低与Y396A突变体共表达的细胞中的PTEN蛋白水平(图4r)。可视化实验表明,RIOK1增强了含有IGF2BP1、G3BP1和PTEN mRNA的类似SG的结构,但这种增强仅在野生型IGF2BP1存在时出现,而非突变体(图4s - u)。多聚体分析证实,RIOK1介导的PTEN mRNA翻译抑制在表达突变型IGF2BP1的细胞中被消除(图4v、w)。此外,IGF2BP1的沉默减轻了RIOK1过表达细胞中PTEN的下调(图4x)。这些观察结果共同确立了RIOK1介导的LLPS、SG聚集与PTEN翻译抑制之间的直接联系。
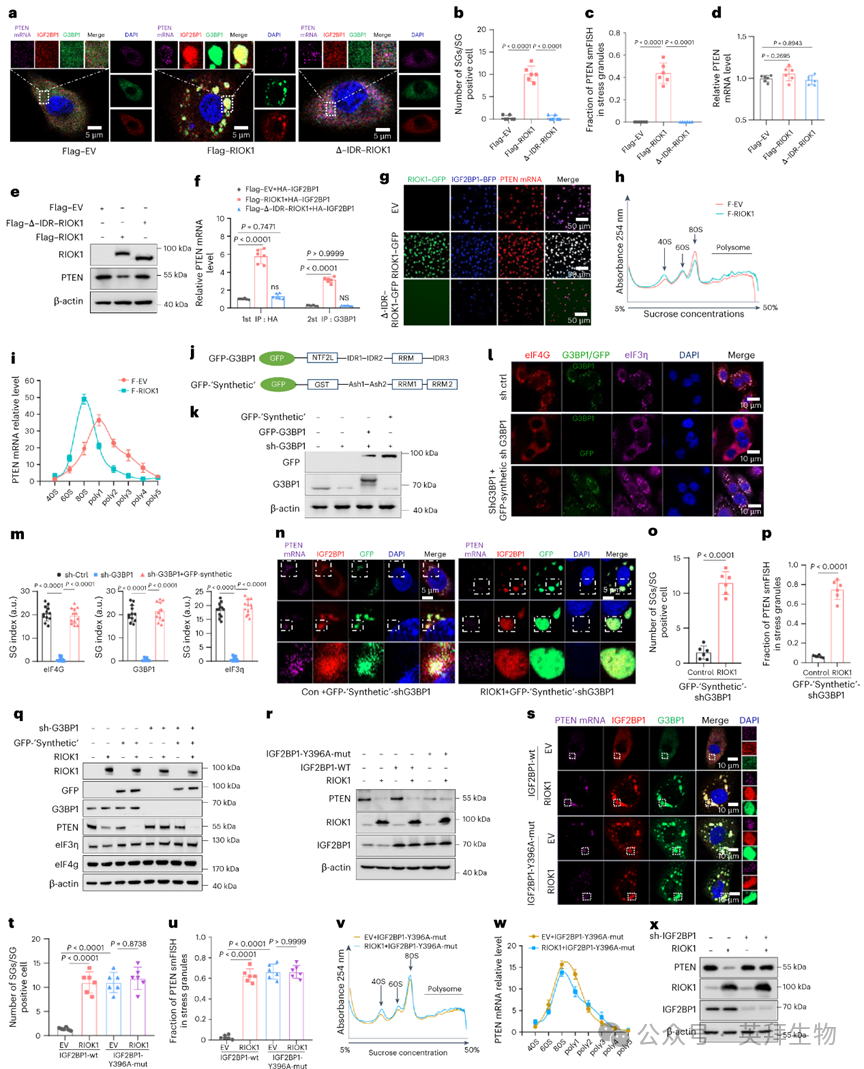
图4:RIOK1 LLPS通过SGs劫持PTEN mRNA抑制PTEN翻译
5、RIOK1驱动PPP并被NRF2转录激活
PTEN的缺失已知通过稳定G6PD来调节PPP和NADPH的产生,G6PD是细胞增殖和氧化还原平衡的关键酶。相应地,非靶向代谢组学揭示了在RIOK1过表达细胞中PPP相关代谢物显著增加以及NADP+/NADPH比率降低,而在RIOK1耗尽的细胞中则观察到相反的效果(图5a - c)。尼罗红染色证实了RIOK1过表达导致的脂质积累增加(图5d)。应激颗粒(SGs)作为一种关键的泛应激适应机制在肿瘤发生中的作用也越来越受到认可。作者接下来利用通过Cre-lox技术生成的肝脏特异性RIOK1条件性敲除(cKO)小鼠来研究其对肿瘤起始和进展的影响。通过水动力尾静脉注射编码MycOE和Trp53KO质粒的Sleeping Beauty转座酶载体,在RIOK1 cKO(Riok1ΔAlb)小鼠中诱导自发性肝脏肿瘤,同时以它们的floxed同窝小鼠(Riok1fl/fl)作为对照。或者,利用二乙基亚硝胺(DEN)/CCL4模型诱导肝脏肿瘤。与促肿瘤作用一致,Riok1ΔAlb小鼠出现了较小的肝脏病变,肝脏/体重比降低,肿瘤增殖降低,如Ki67+阳性所示(图5e - i)。在自发性肝脏肿瘤中RIOK1的缺失降低了SGs中的Pten mRNA,增加了PTEN蛋白和G6PD水平(图5j - m)。对Riok1fl/fl和Riok1ΔAlb小鼠肝脏肿瘤的RNA-seq分析显示,RIOK1与外部刺激和防御反应显著相关,支持其在应激适应中的作用。IGF2BP1 Y396A突变体的过表达加速了Riok1ΔAlb cKO小鼠肝脏肿瘤的发生,并增加了肝脏/体重比,突出了IGF2BP1 Tyr396在RIOK1介导的HCC进展中的关键作用。为了确定应激肿瘤细胞中RIOK1上调的机制,作者使用JASPAR分析其启动子,识别出两个高评分的NRF2结合位点(-218/-228和-1169/-1179)。
提示性地,作者在TCGA HCC数据集中发现NRF2和RIOK1 mRNA水平之间存在正相关(图5n)。指导性地,作者观察到NRF2过表达增加了RIOK1 mRNA和蛋白水平,而NRF2敲低则降低了它们(图5o - q)。ChIP实验确认NRF2结合到近端-218/-228位点,荧光素酶报告基因实验显示RIOK1启动子对NRF2过表达有反应,且在位点1突变后活性消失(图5r - t)。先前的研究强调了在谷氨酰胺(GLN)匮乏期间NRF2的激活。在GLN匮乏的细胞中,RIOK1表达随时间增加,与NRF2升高和PTEN降低同时发生,而NRF2沉默则在相同条件下降低了RIOK1表达(图5u、v)。此外,越来越多的证据表明NRF2参与HCC进展和治疗抵抗,例如逃避TKIs的效果。类似于GLN/葡萄糖匮乏反应,缺氧以及索拉非尼和多纳非尼治疗增加了HCC细胞中NRF2和RIOK1的表达,同时抑制了PTEN表达。这些数据表明,NRF2驱动的RIOK1转录激活是HCC细胞应对不利刺激的普遍适应性机制,尽管LLPS是否是常见的下游机制仍有待探索。
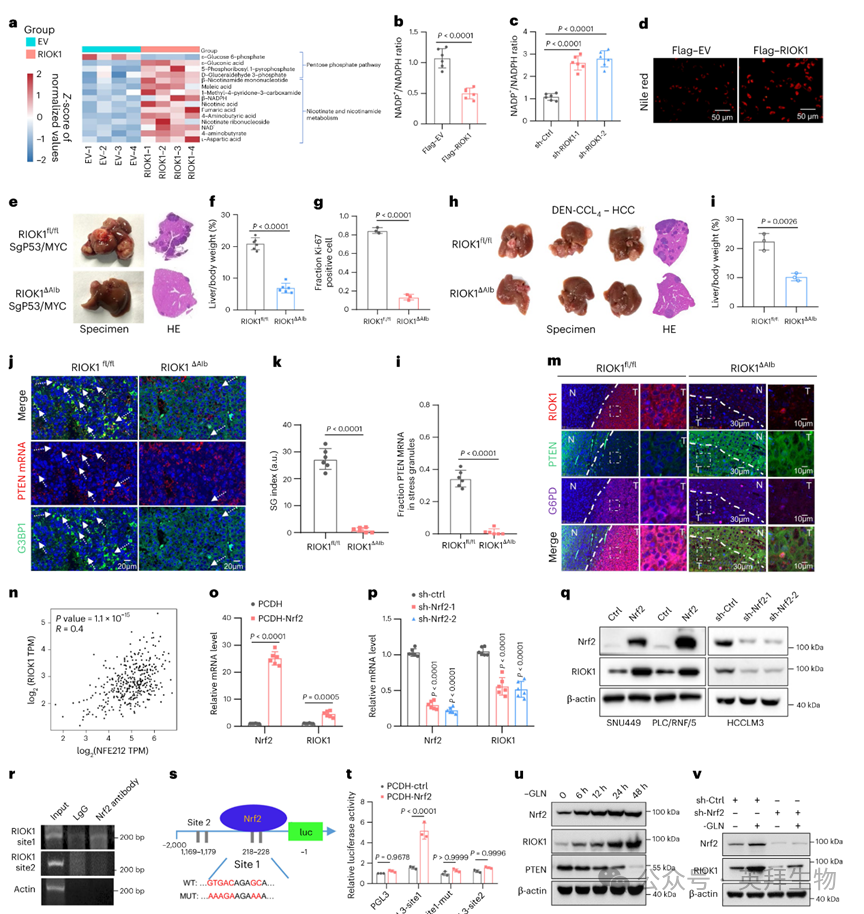
图5:RIOK1驱动PPP并被NRF2反激活
6、RIOK1诱导的LLPS削弱了HCC对TKIs的敏感性
作者进一步研究了 RIOK1 介导的液-液相分离(LLPS)和应激颗粒(SG)形成是否是一种普遍的适应机制,进而导致 PTEN 的抑制。在缺乏谷氨酰胺(GLN)或接受索拉非尼(sorafenib)和多纳非尼(donafenib)处理的 HCCLM3 细胞中,出现了包含 RIOK1/G3BP1/PTEN mRNA 的 SG 样结构(图 6a–c)。相反,在上述条件下沉默 RIOK1 会破坏 IGF2BP1–G3BP1 的相互作用以及 SG 的形成,而 RIOK1 的过表达则增强了对多纳非尼诱导的 SG 形成(图 6d–f),这表明 RIOK1 介导的 SG 形成是对这些应激刺激的共同反应机制。
RIOK1 下游的表现也显示出类似的规律。在多纳非尼处理的细胞中,RIOK1 的过表达降低了 PTEN 的表达,增加了 G6PD 的表达,从而减缓了通常由应激引起的 NADP+/NADPH 比例升高(图 6g,h)。这种代谢平衡的恢复促进了细胞活力,说明 RIOK1 有助于细胞应对多纳非尼诱导的应激(图 6i)。与之相符的是,野生型 RIOK1 过表达细胞在接受索拉非尼或多纳非尼处理后,其细胞死亡比例显著低于表达ΔIDR–RIOK1 突变体的细胞(图 6j)。相反,沉默 RIOK1 会保持 PTEN 表达、抑制 G6PD 的诱导,这增强了氧化应激、降低了细胞活性,并加剧了 TKI 诱导的细胞死亡(图 6k–o)。同样,在 GLN 缺乏条件下,RIOK1 的过表达提高了细胞的存活率,而其敲低则增强了细胞对缺 GLN 处理的敏感性。此外,与 PPP(磷酸戊糖途径)在 TKI 应答中的关键作用一致,使用 G6PDi-1(一种可逆的非竞争性 G6PD 抑制剂)可逆转 RIOK1 过表达细胞对多纳非尼诱导死亡的抗性(图 6p)。同时,通过 2DG 激活 PPP 可恢复 RIOK1 敲低细胞在多纳非尼处理下的活力(图 6q)。这些结果表明,RIOK1 通过激活 PPP 来保护细胞免受 TKI 诱导的死亡。
为了在体内验证这些观察结果,作者使用了 HCCLM3 细胞的小鼠异种移植实验。敲低 RIOK1 的肿瘤生长明显慢于对照组,而 RIOK1 敲低联合多纳非尼处理则显著抑制了肿瘤生长(图 6r,s)。针对 Ki67 的免疫组化染色显示,在 RIOK1 敲低并接受多纳非尼处理的肿瘤中,增殖活性降低。综上所述,这些结果确立了 RIOK1 驱动的 LLPS 和 PTEN 抑制是 TKI 抵抗的核心机制,促进了 HCC 在体内外环境中的生存与治疗耐受。
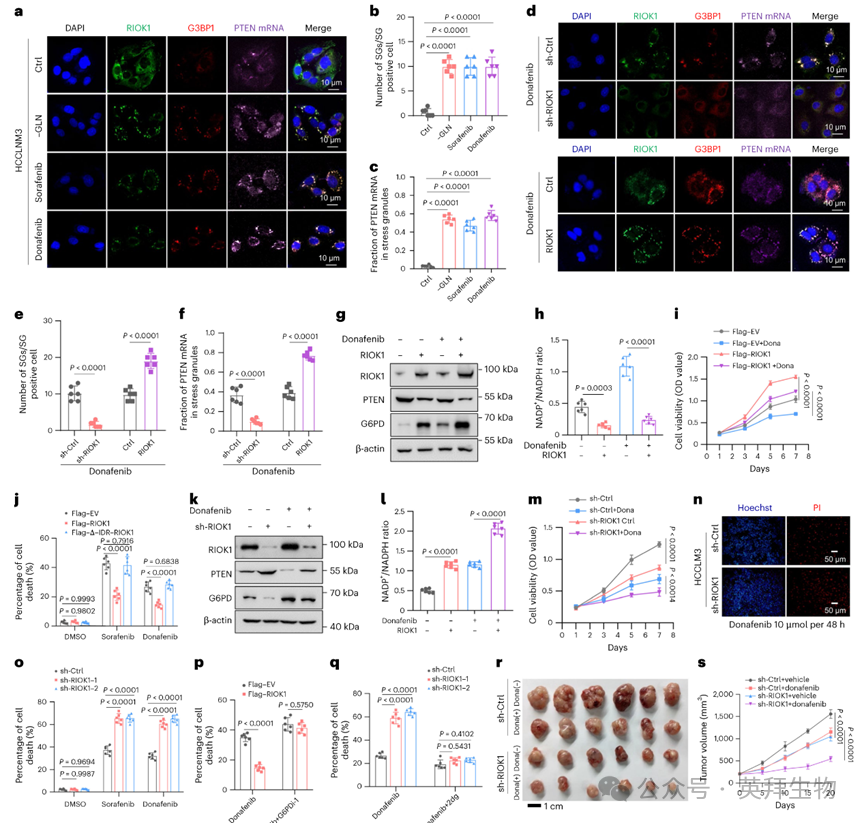
图6:RIOK1消融增强了TKI的抗癌活性
7、西达本胺靶向RIOK1以增强TKI治疗效果
作者的研究结果将RIOK1提议为HCC的治疗靶点。为了验证这一点,作者利用计算机模拟预测了RIOK1结构(PDB ID 6ZXG,包括潜在的泛素化位点K190)与FDA批准药物库中的1806种化合物之间的结合情况(图7a)。根据对接分数,确定的前八种候选化合物是布雷哌唑、去氧胆酸、regorafenib、pexidartinib、多奈哌齐、ruxolitinib、西达本胺和罗格列酮(图7b - e和扩展数据图6a)。对这八种化合物进行初步测试发现,只有西达本胺能够显著降低HCC细胞中RIOK1蛋白水平(图7f)。表面等离子共振(SPR)证实西达本胺与RIOK1具有高亲和力结合(Kd = 22.89μM;图7g),细胞实验显示西达本胺在低微摩尔浓度下诱导RIOK1水平的剂量依赖性降低,这可能是由于RIOK1的多泛素化和蛋白酶体降解所致(图7h - i)。此外,西达本胺显著降低了高RIOK1表达的患者来源异种移植(PDX)肿瘤的生长,但对低RIOK1表达的肿瘤无影响,表明西达本胺在体内的靶向疗效(图7j、k和扩展数据图6b)。此外,与RIOK1敲低类似,西达本胺抑制了HCC细胞对多纳非尼的RIOK1诱导反应,逆转了PTEN下调和G6PD稳定化(图7m)。
为了进一步评估西达本胺的有效性,作者测试了其单独使用以及与多种TKIs在HCC模型中的效果。集落形成和细胞活性实验表明,西达本胺抑制了HCC细胞的生长,并进一步增强了TKIs(包括多纳非尼、仑伐替尼、索拉非尼和regorafenib)的抗肿瘤效果(图7n)。联合指数分析证实了西达本胺与TKI治疗之间的协同作用,尤其是在长时间暴露的情况下。此外,西达本胺增强了多纳非尼对HCC患者来源类器官(PDOs)的生长抑制效果(图7o、p)。
作者将这些发现扩展到体内模型,在PDX和同种异体小鼠Hep1-6 HCC模型中联合使用西达本胺和多纳非尼,并在SgP53/Myc自发性肝脏肿瘤模型中评估生存率。西达本胺单独使用可减少PDX和Hep1-6模型中的肿瘤生长,但联合治疗显示出更大的疗效,并显著提高了携带自发性肝脏肿瘤小鼠的生存率(图7q - u)。治疗过程耐受性良好,仅观察到适度的体重减轻。这些结果突出了靶向RIOK1可以使HCC细胞对TKIs敏感化。
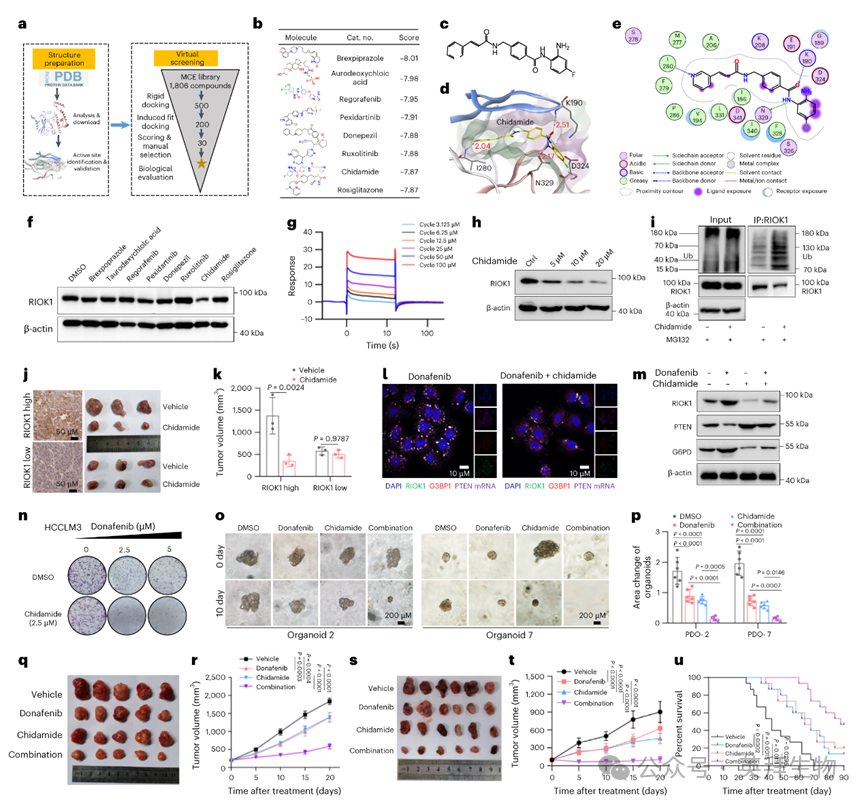
图7:Chidamide靶向RIOK1,协同TKI治疗效果
8、RIOK1 与 TKI 耐药及不良预后相关
作者的初步研究发现,在肝细胞癌(HCC)中,RIOK1 的高表达与更差的临床结局相关。为了在患者中验证这一机制,作者比较了正常肝组织与 HCC 组织中 RIOK1 的表达水平以及应激颗粒(SG)的出现情况。结果显示,在肿瘤组织中,共表达 RIOK1 和 G3BP1 的 SG 样结构大量存在,而在正常肝细胞中则极为罕见(图 8a,b)。
此外,对 HCC 组织的免疫组织化学(IHC)分析显示,RIOK1 的表达水平与 NRF2 和 G6PD 呈正相关,与 PTEN 呈负相关(图 8c–f),这与作者此前实验揭示的调控机制一致。作者进一步分析了高风险HCC 患者在术后接受多纳非尼辅助治疗时,RIOK1 表达水平与 TKI 应答之间的关系(图 8g)。多重免疫荧光成像结果显示,在接受多纳非尼治疗的患者中,原发肿瘤组织中不敏感肿瘤的点状结构中 RIOK1 表达更高,G6PD 水平也更高,相比之下,对多纳非尼敏感的肿瘤则较低(图 8h–k)。
进一步分析表明,RIOK1 高表达的患者无论在总体生存期还是无进展生存期方面均明显低于 RIOK1 低表达的患者(图 8l,m)。这些发现表明,RIOK1–SG 应激反应机制在临床 HCC 中是活跃的,并突出了其作为潜在治疗靶点的重要性(图 8n)。
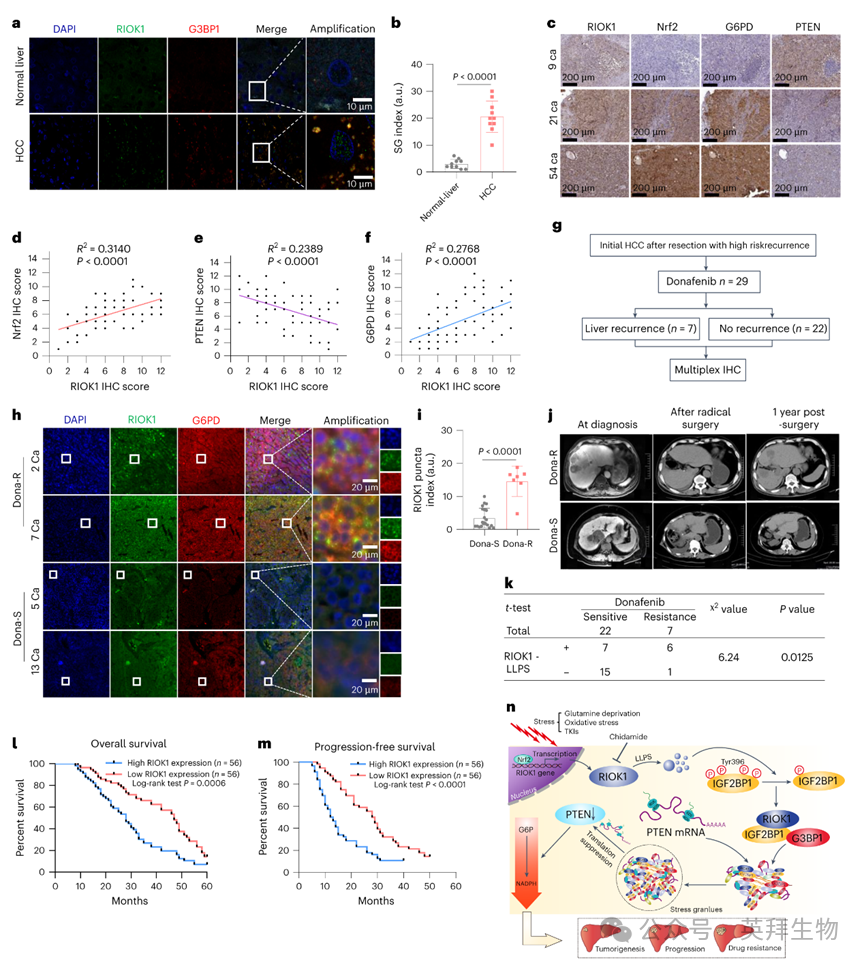
图8:RIOK1与多纳非尼疗效负相关,与患者预后差
结论:
综上所述,作者证明了RIOK1 作为 HCC 生物标志物和治疗靶点的临床转化潜力,并确定了 chidamide 作为开发候选药物的良好先导分子。
参考文献:
Meng F, Li H, Huang Y, Wang C, Liu Y, Zhang C, Chen D, Zeng T, Zhang S, Li Y, Zhang B, Lang C, Xia J, Xiong W, Pan S, Sun X, Thorne RF, Liu Y, Wang J, Zhang S, Song R, Wang J, Liu L. RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma. Nat Cancer. 2025 Jul;6(7):1223-1241. doi: 10.1038/s43018-025-00984-5. Epub 2025 Jun 4. Erratum in: Nat Cancer. 2025 Aug 4. doi: 10.1038/s43018-025-01043-9. PMID: 40467995.






