核外核孔蛋白 sPOM121 通过转录机制驱动 β-连环蛋白介导的前列腺癌进展和免疫逃逸
细胞核基质中核孔复合体蛋白(NUP)在实体瘤(包括前列腺癌)中的作用尚不清楚。在本研究中,作者揭示了非孔隙NUP——可溶性POM121(sPOM121)的临床意义及其作为关键转录调控因子的机制作用,它增强了转移性前列腺癌的侵袭性。通过在人类样本中使用正交方法,sPOM121被鉴定为前列腺癌中主要表达的核基质NUP。无偏见的蛋白质组学和表观基因组学研究表明,sPOM121通过其C末端与染色质重塑因子SMARCA5在基因启动子位点相互作用,并定位于核凝聚体,从而重编程基因表达。事实上,sPOM121调控了一个独特的癌基因网络,包括β-连环蛋白,导致前列腺癌进展和免疫逃逸。重要的是,在患者来源的临床前和同种异体小鼠模型中靶向sPOM121/β-连环蛋白轴可以阻止前列腺癌的侵袭性,并增强抗肿瘤免疫。总之,作者的这些发现揭示了非孔隙NUP在实体瘤中以前未知的可操作的重编程功能。该研究于2025年7月发表在《Cancer Discovery》,IF 33.3分。
技术路线:
主要研究结果:
1、sPOM121促进前列腺癌的侵袭性
为了确定促进前列腺癌发病机制的非孔隙核基质NUPs,作者在转录本水平挖掘了癌症基因组图谱(TCGA)转录组数据集,以确定仅在核基质中定位的NUPs(如sPOM121)以及既在核孔复合体(NPC)又在核基质中定位的NUPs的表达情况。这一分析发现,与正常前列腺组织相比,sPOM121是前列腺癌中上调最显著的核基质定位NUP(图1A)。值得注意的是,通过互补的正交方法,作者发现sPOM121的mRNA和蛋白表达在前列腺癌的自然病程中增加,且在晚期转移性肿瘤样本中水平最高。为了特异性检测和定量sPOM121 mRNA,作者对一组原发性和转移性前列腺癌患者的组织进行了RNA原位杂交(RNA-ISH)-RNAscope检测,使用针对其独特的非编码外显子(二和三)的探针,这些外显子位于其独特的5′非翻译区(UTR)。RNA-ISH信号分析显示,sPOM121 mRNA表达从正常前列腺到原发性前列腺癌显著增加,且在转移性样本中水平最高(图1B)。作为阳性对照,作者使用针对其独特的跨膜(TM)结构域编码外显子的探针,在相同样本中评估了与NPC相关的POM121(TM-POM121)。通过针对sPOM121 5′UTR的siRNA在多种前列腺癌细胞中验证了针对每种POM121转录本亚型的探针的特异性,该siRNA特异性地降低了sPOM121的mRNA和蛋白表达,核基质检测和RNA-ISH信号,而不影响TM-POM121。使用能检测两种POM121亚型的抗体对患者肿瘤组织进行免疫组化(IHC;图1C)和透射电子显微镜分析(图1D)揭示了sPOM121的非孔隙核基质定位。在蛋白水平对核基质sPOM121的定量证实,sPOM121在转移性前列腺癌样本中的表达最高。值得注意的是,与正常前列腺和原发性前列腺癌细胞模型相比,转移性去势抵抗性前列腺癌细胞中sPOM121的表达也更高。总之,这些结果首次确定了核基质定位的NUP——sPOM121在前列腺癌中的表达,并且随着疾病进展到晚期转移阶段,其表达增加。
为了确定sPOM121表达对前列腺癌侵袭性的体内影响,作者使用针对其5′UTR的短发夹RNA(shRNA)评估了sPOM121耗竭的影响,该shRNA能高效耗竭sPOM121 mRNA和蛋白,而不影响TM-POM121水平。为了研究sPOM121表达对转移性疾病的影响,进行了前列腺癌细胞的尾静脉注射实验。将sPOM121耗竭的、带有荧光素酶标记的前列腺癌细胞(DU145和22Rv1)尾静脉注射到小鼠体内,诱导肿瘤负荷显著减少(图1E)并增加小鼠存活率。相反,将sPOM121过表达的前列腺癌细胞尾静脉注射到小鼠体内,与接受空载体(EV)对照细胞尾静脉注射的小鼠相比,肿瘤负荷增加,存活率降低。值得注意的是,使用患者来源的临床前模型进一步证实了sPOM121在调节前列腺癌侵袭性方面的作用。事实上,在由患者来源异种移植瘤(PDX)生成的三个类器官模型中敲低sPOM121(图1F)减少了类器官的数量和大小。此外,将sPOM121耗竭的类器官前列腺癌细胞尾静脉注射到小鼠体内,与对照组相比,小鼠存活率增加(图1G)。总体而言,这些数据表明sPOM121可能在转移性前列腺癌中发挥关键作用,并为研究其促进疾病侵袭性的机制提供了依据。
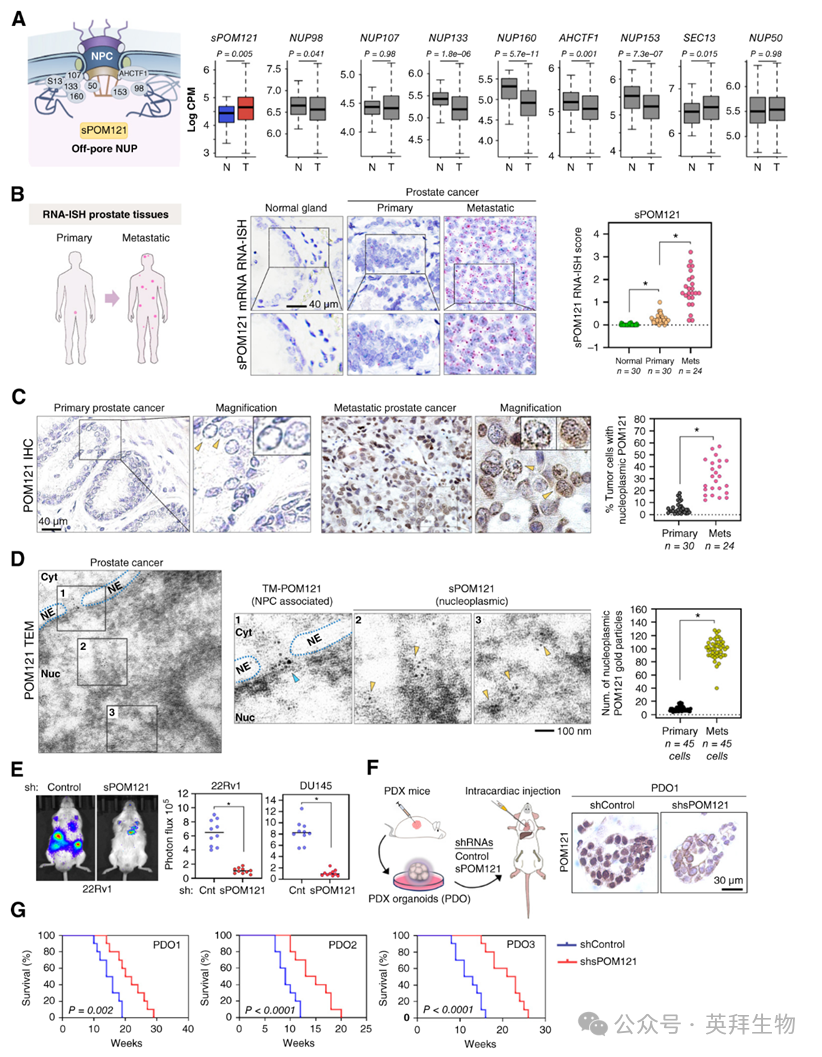
图1:sPOM121有助于致死性前列腺癌的侵袭性
2、与染色质相关的sPOM121在基因启动子处富集
接下来,作者旨在确定sPOM121在晚期前列腺癌中的分子功能。由于sPOM121的核基质定位,作者首先研究了sPOM121与染色质的关联。为此,作者使用前列腺癌细胞模型(DU145和22Rv1)进行了亚细胞分离实验。这一分析显示,sPOM121优先富集在染色质部分,并且在sPOM121敲低后无法检测到,而全长TM-POM121则富集在核部分(图2A)。为了进一步研究与染色质相关的sPOM121的潜在作用,作者通过染色质免疫沉淀测序(ChIP-seq)评估了其全基因组定位,并发现其与启动子和5′UTR基因组区域有46%的重叠(图2B),接近转录起始位点(TSS)。有趣的是,基序分析显示sPOM121峰值高度富集RNA聚合酶II(Pol II)相关辅因子基序,如TATA盒结合蛋白相关因子1(TAF1;图2C)。事实上,使用核和染色质部分进行POM121免疫沉淀以及邻近连接分析(PLA)表明sPOM121与RNA Pol II(总Pol II、磷酸化S2和磷酸化S5 Pol II;图2D)密切相关。最值得注意的是,支持这一观察结果的临床相关性的是,与局部原发性前列腺癌组织相比,通过PLA观察到的sPOM121与磷酸化S5 RNA Pol II之间的相互作用在人类转移性前列腺肿瘤样本中显著增加(图2E)。
此外,sPOM121峰值的基因本体分析发现了与转录相关过程、细胞-细胞粘附和细胞分裂富集的类别(图2F)。最初根据其TSS附近强烈的sPOM121 ChIP-seq峰值选择了前五个基因本体类别中的五个基因进行进一步验证,包括CTNNB1、CXXC1、PREB、CRK和ENSA(图2G),这些基因通过比较对照组和sPOM121耗竭的前列腺癌细胞的ChIP-qPCR得到了证实。这些数据表明,sPOM121定位于前列腺癌细胞核基质中基因启动子附近的活跃转录位点。
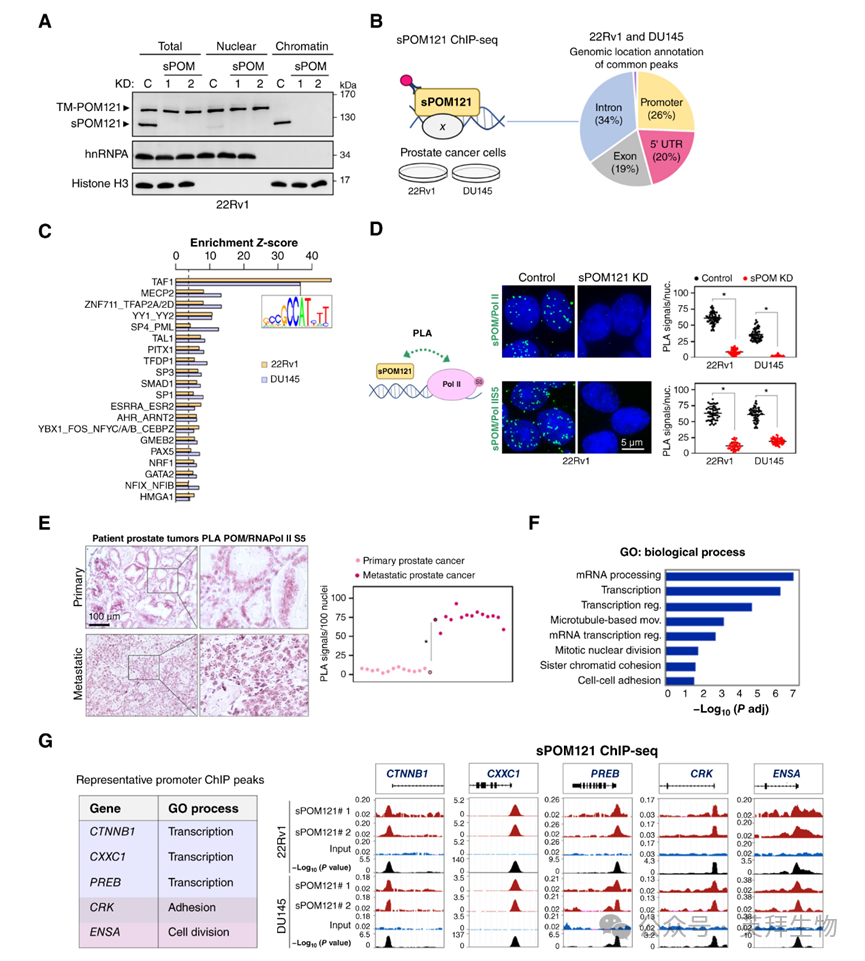
图2:sPOM121在基因启动子上优先富集
3、sPOM121通过与SMARCA5的相互作用定位于基因启动子
为了揭示sPOM121的染色质相互作用组,作者进行了快速免疫沉淀质谱分析(RIME)实验,比较了对照组和sPOM121耗竭的细胞。在对照组和sPOM121敲低样本之间比较时,有超过250种蛋白的富集程度存在差异,其中168种(67.2%)蛋白在三种前列腺癌细胞模型中sPOM121耗竭后表达降低(图3A)。值得注意的是,sPOM121 RIME数据显示富集了与染色质结合、mRNA调节和转录相关的生物通路,表明这种可溶性NUP参与了这些过程(图3B)。根据肽段富集(最大剃刀+独特肽段)、sPOM121敲低后最大倍数变化降低(sPOM121/对照敲低)以及在所有三种细胞模型中IgG对照中缺失,对sPOM121相互作用蛋白进行排名(图3C)。值得注意的是,蛋白质组数据挖掘发现,在作者的RIME研究中与sPOM121相互作用最强的蛋白与之前显示与RNA Pol II形成复合体的蛋白重叠,包括SMARCA5、SLTM、DDX54或RBM25。
为了验证作者的RIME数据并确定sPOM121在染色质上的最强相互作用蛋白,作者使用总蛋白或核部分进行了免疫沉淀(IP)实验(图3D)。作者发现SMARCA5是三种独立前列腺癌细胞模型中染色质部分中sPOM121的主要相互作用蛋白。这一结果通过使用相同前列腺癌细胞提取物和核部分对SMARCA5进行反向IP得到证实。随后,邻近连接分析(PLA)证实了sPOM121与SMARCA5在前列腺癌细胞核中密切相关(图3E)。这些发现在前列腺癌组织样本中通过PLA得到证实,与原发性前列腺癌样本相比,sPOM121-SMARCA5相互作用在转移性肿瘤中最高(图3F)。由于SMARCA5被发现与RNA Pol II形成复合体(见图3C),并且是作者RIME分析中仅有被鉴定为在染色质上与sPOM121特异性相互作用的蛋白(见图3D),作者旨在进一步研究它们相互作用的性质及其功能后果。
SMARCA5(SNF2H)是ISWI家族的染色质重塑因子,专门在启动子区域促进转录激活。因此,作者研究了SMARCA5是否能够结合作者在sPOM121顺式作用元件分析中鉴定的基因。为此,作者进行了SMARCA5 ChIP-seq实验,发现其与sPOM121 ChIP-seq有很强的重叠(图3G),包括在sPOM121调控的基因中的峰值(图3H)。事实上,通过ChIP-qPCR比较对照组和SMARCA5耗竭条件,证实了SMARCA5在sPOM121调控的基因中的富集。重要的是,在SMARCA5敲低后,sPOM121在基因启动子上的占据度降低(图3I)。综上所述,这些结果表明SMARCA5在促进sPOM121定位于基因启动子位点方面起着关键作用。
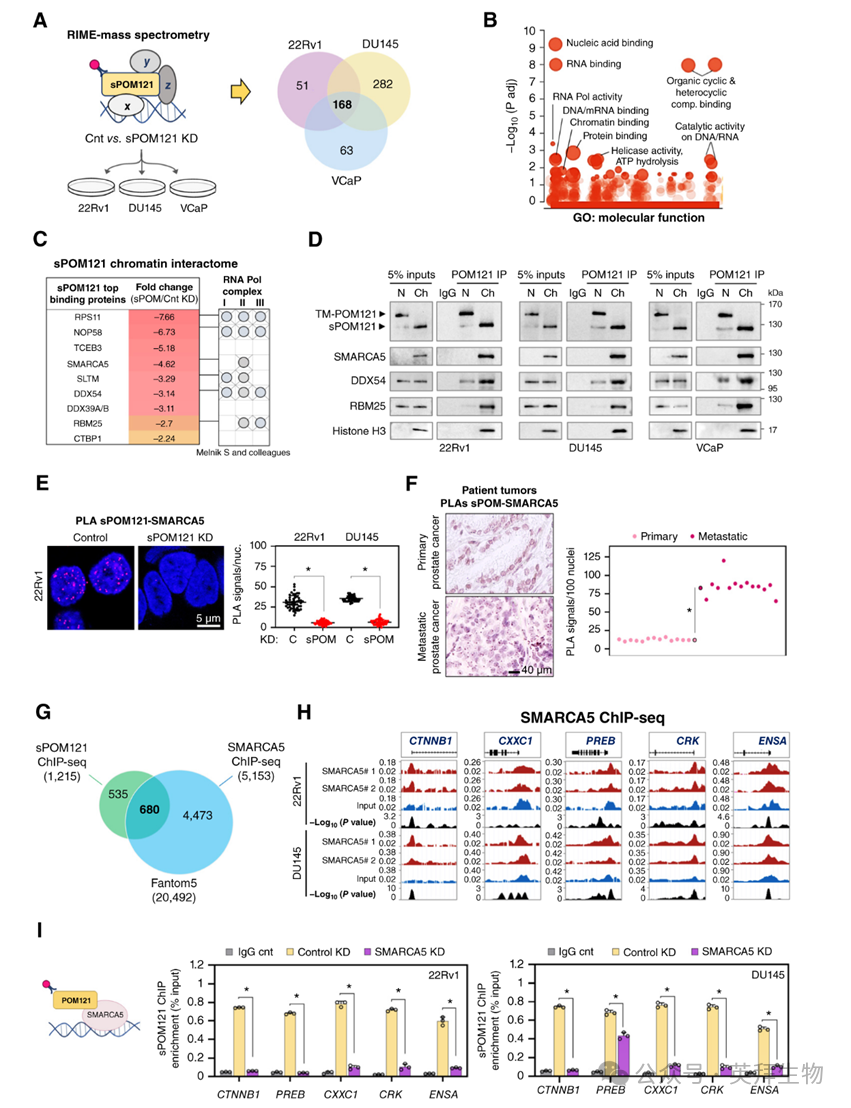
图3:sPOM121通过SMARCA5相互作用定位于基因启动子
4、sPOM121的C末端对于SMARCA5的相互作用和核基质凝聚体的定位至关重要
接下来,作者旨在研究sPOM121蛋白区域与SMARCA5的相互作用及其在基因调控中的潜在功能相关性。为此,作者生成了带有不同蛋白区域缺失的sPOM121-GFP融合突变体(图4A),这些突变体在前列腺癌细胞中稳定表达水平相似,并通过IP实验测试了它们与SMARCA5相互作用的能力。作者发现sPOM121的C末端片段对于其与SMARCA5的相互作用是必要且充分的。sPOM121的ΔC和M突变体与SMARCA5没有相互作用,而单独表达的sPOM121 C末端片段与SMARCA5相互作用(图4B)。这些结果通过反向SMARCA5 IP得到证实(图4C)。
然后,作者研究了sPOM121 C末端缺失对与SMARCA5共调控基因启动子的结合能力。在内源性sPOM121敲低后,在表达sPOM121-GFP缺失突变体的前列腺癌细胞中进行ChIP-qPCR实验,结果表明,与全长sPOM121(sPOM121-FL)相比,sPOM121ΔC对共调控基因(CTNNB1、CXXC1和ENSA)的富集显著降低(图4D)。值得注意的是,sPOM121 C末端片段的表达挽救了这一效应(图4D)。重要的是,与sPOM121-FL相比,sPOM121ΔC突变体的表达导致sPOM121和SMARCA5共调控基因的总mRNA和新生mRNA水平降低。
此外,详细的荧光显微镜分析显示,C末端缺失降低了sPOM121在核基质焦点的定位,而单独表达C末端片段与sPOM121-FL和sPOM121ΔC相比增加了焦点数量(图4E)。有趣的是,sPOM121的C末端富含苯丙氨酸-甘氨酸(FG)重复序列(31-33),这些内在无序区域(IDR)被报道对于形成作为转录调控中心的致癌凝聚体至关重要。这些结果促使作者评估sPOM121核基质焦点是否定位于凝聚体。支持sPOM121定位于凝聚体的证据是,作者观察到sPOM121在用生物素标记的异噁唑(b-isox)沉淀IDR蛋白时能高效沉淀(图4F)。值得注意的是,sPOM121的FG富含C末端片段主要与b-isox沉淀。此外,在用1,6-己二醇(HD)处理前列腺癌细胞后,sPOM121焦点以时间依赖的方式消失,HD是一种用于溶解凝聚体的化合物(图4G)。此外,荧光恢复后光漂白(FRAP)实验显示sPOM121在核焦点处具有动态扩散,平均半衰期为2.6±1.2秒,移动分数为0.7±0.10(图4H)。
为了进一步阐明sPOM121定位于核凝聚体的功能作用,作者将FG重复序列中的苯丙氨酸残基突变为丝氨酸(FS)。作者发现,尽管FS突变导致sPOM121-FL和C末端片段的核基质凝聚体减少(图4I),并阻碍了sPOM121和SMARCA5对共调控靶基因的结合(图4J),但sPOM121和SMARCA5之间的相互作用仍然保持完整(图4K)。值得注意的是,这些结果在用HD溶解凝聚体并进行共IP、PLA和ChIP-qPCR实验时得到了证实,表明凝聚体有助于sPOM121-SMARCA5靶向基因启动子。为了进一步研究这一观察结果,作者生成了一个嵌合体,其中sPOM121中的FG富含C末端片段被FUS的IDR替换,FUS是一种已知能形成核凝聚体的蛋白。这种结构域替换将sPOM121重新靶向到核凝聚体(图4L),但阻碍了与SMARCA5的相互作用(图4M)。此外,免疫荧光-DNA-FISH分析显示sPOM121焦点与CTNNB1启动子在空间上共定位,而FUS-IDR嵌合体的焦点则没有。最重要的是,作者观察到FS突变体和sPOM121-FUS嵌合体显著降低了sPOM121靶基因的表达水平(图4N)。
综上所述,这些结果表明,sPOM121影响了一个离散基因网络的转录,该基因网络在晚期前列腺癌中驱动关键的生物学特性。
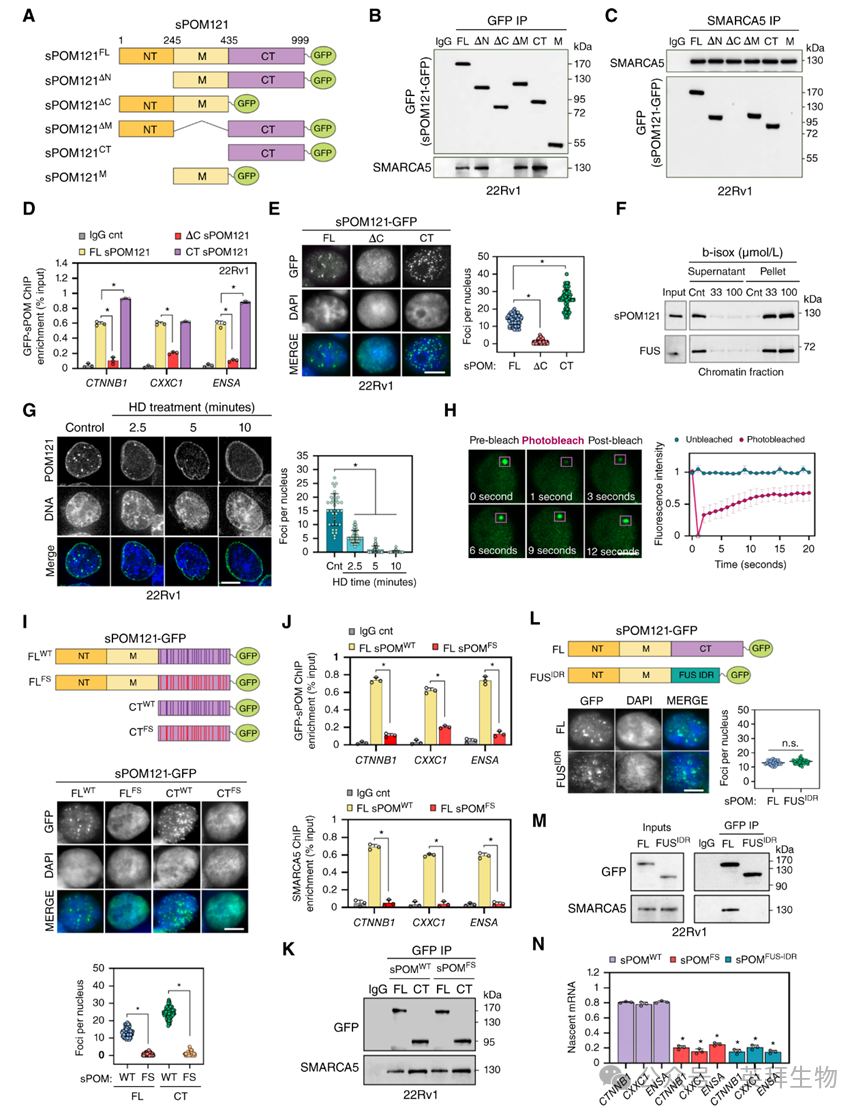
图4:sPOM121的c端对于SMARCA5相互作用和定位到核质凝聚体至关重要
5、sPOM121重塑转移性前列腺癌的转录组
为了确定sPOM121影响的转录程序,作者在sPOM121耗竭的前列腺癌细胞中联合进行了转座酶可及染色质测序(ATAC-seq)和转录组分析[RNA测序(RNA-seq)]。值得注意的是,这些研究表明sPOM121敲低的RNA-seq与sPOM121和SMARCA5敲低细胞的ATAC-seq之间存在很强的重叠(图5A)。
作者构建了一个功能性sPOM121基因签名,该签名由sPOM121和SMARCA5敲低中一致的启动子可及性变化的基因以及sPOM121敲低时表达变化的基因的交集组成(图5B)。值得注意的是,这个基因签名包括之前通过ChIP-seq鉴定的特定sPOM121和SMARCA5富集的基因启动子(图5C和D)。通过在总RNA和新生转录合成上进行qRT-PCR,进一步证实了sPOM121敲低对这些基因表达的影响。
基于REACTOME、HALLMARK和京都基因与基因组百科全书数据库的转录组元分析揭示了sPOM121靶基因签名的独特诱导(图5E)。有趣的是,与sPOM121耗竭细胞相比,多种癌基因信号(例如,MYC和WNT/β-连环蛋白)和G2/M细胞周期(例如,G2/M检查点和姐妹染色单体分离)反应在对照细胞中显著富集,而免疫(例如,IFNα和IL6)、翻译(例如,起始和延伸)和代谢(例如,糖基化和脂肪酸)反应在sPOM121敲低后显著诱导。最值得注意的是,支持其临床相关性,作者观察到sPOM121靶基因签名在转移性温尸检前列腺癌组织中显著富集,与原发性前列腺癌相比(图5F)。
综上所述,这些结果表明sPOM121影响一个独特的基因网络的转录,驱动前列腺癌晚期的关键生物学特性。
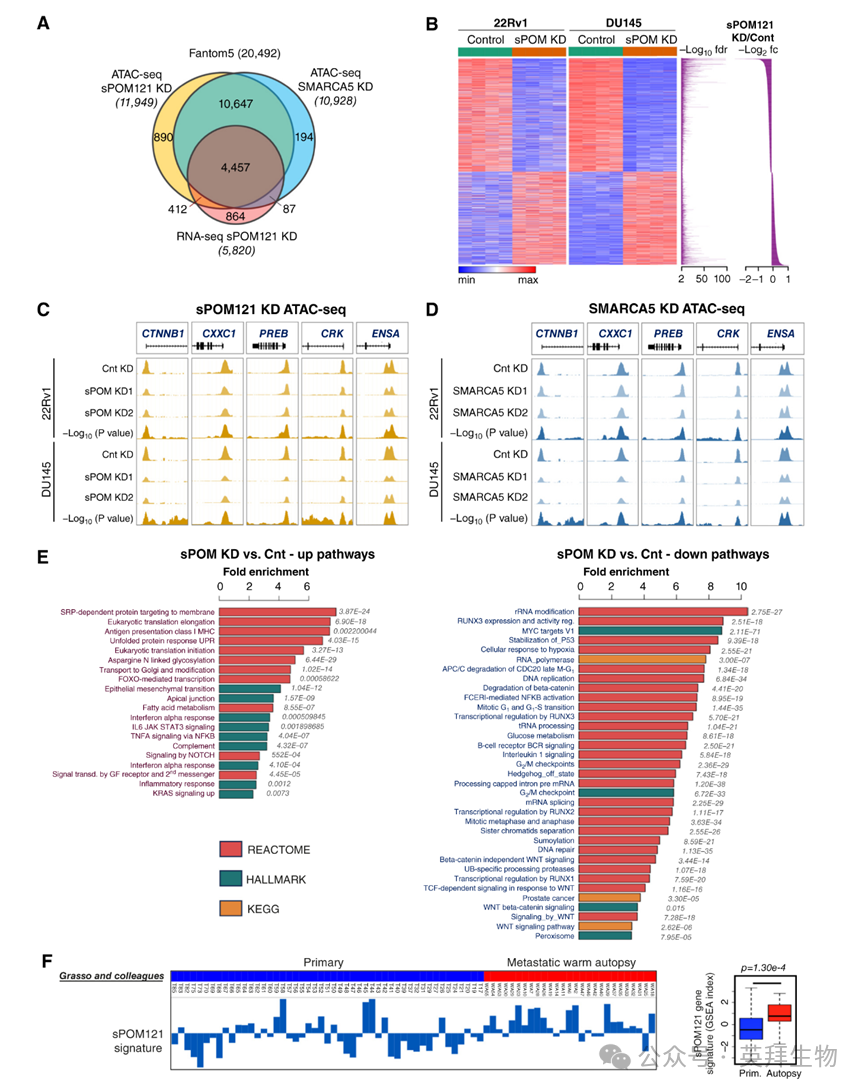
图5:sPOM121重新编程致死性前列腺癌
6、sPOM121通过β-连环蛋白上调促进前列腺癌的侵袭性
接下来,作者试图确定促进转移性前列腺癌侵袭性的主要sPOM121下游效应通路。作者关注WNT/β-连环蛋白通路,因为CTNNB1(β-连环蛋白)基因表达在sPOM121耗竭后显著下降,并且已知在多种肿瘤类型中,包括前列腺癌,在肿瘤进展中发挥作用。证实sPOM121在调节β-连环蛋白水平中的作用,作者观察到sPOM121或SMARCA5耗竭降低了β-连环蛋白蛋白表达。相反,在前列腺癌细胞中过表达sPOM121导致β-连环蛋白蛋白水平增加。值得注意的是,不结合β-连环蛋白启动子的sPOM121 C末端缺失突变体无法在sPOM121内源性耗竭后挽救β-连环蛋白表达,而sPOM121 C末端片段诱导了高水平的β-连环蛋白表达。
支持sPOM121/β-连环蛋白轴的潜在临床意义,作者观察到高sPOM121表达的肿瘤也显示出更高的β-连环蛋白蛋白水平(图6A)。在前列腺癌患者的TCGA数据集中也观察到sPOM121和CTNNB1 mRNA之间的正相关(图6B)。此外,前列腺癌细胞系也显示出类似的关联,高sPOM121表达的细胞显示出更高的β-连环蛋白水平。
由于β-连环蛋白上调促进肿瘤侵袭性和干细胞特性,作者专注于研究sPOM121在调节这些生物学特性中的作用。为此,作者研究了单独过表达sPOM121的前列腺癌细胞以及与β-连环蛋白敲低相结合的侵袭性和成球能力。值得注意的是,作者观察到sPOM121过表达增加了前列腺癌细胞的侵袭性和干细胞特性,而这种效应在耗竭β-连环蛋白时显著被挽救。此外,活性β-连环蛋白(ΔN89)的表达部分挽救了sPOM121耗竭引起的效应。值得注意的是,体内研究表明,耗竭β-连环蛋白显著降低了sPOM121过表达细胞的肿瘤侵袭性,如通过减少肿瘤负荷(图6C)和增加小鼠存活率(图6D)所示。
此外,基于WNT/β-连环蛋白通路可能使前列腺癌对雄激素拮抗剂(例如,恩杂鲁胺)和紫杉醇类(例如,多西他赛)治疗产生耐药性,作者研究了sPOM121表达是否可能影响这些治疗的疗效。为了测试这一假设,作者在高sPOM121水平的去势抵抗性PDX来源的类器官中耗竭了sPOM121,这反过来又降低了β-连环蛋白表达。值得注意的是,sPOM121耗竭使类器官对多西他赛和恩杂鲁胺都敏感,这种效应在过表达活性β-连环蛋白(ΔN89;图6E)时部分被挽救。此外,在表达高水平sPOM121的类器官模型中,与sPOM121耗竭的类器官模型相比,用ICG-001或PRI-724药理学靶向WNT/β-连环蛋白与多西他赛或恩杂鲁胺联合使用时效果更明显。此外,在体内,用ICG-001治疗携带由高sPOM121/β-连环蛋白表达的PDX类器官癌细胞生成的皮下肿瘤的小鼠,显著提高了多西他赛或恩杂鲁胺的疗效(图6F)。
综上所述,这些结果表明,sPOM121通过增强癌基因(例如,WNT/β-连环蛋白)信号,促进前列腺癌进展到转移性耐药阶段。
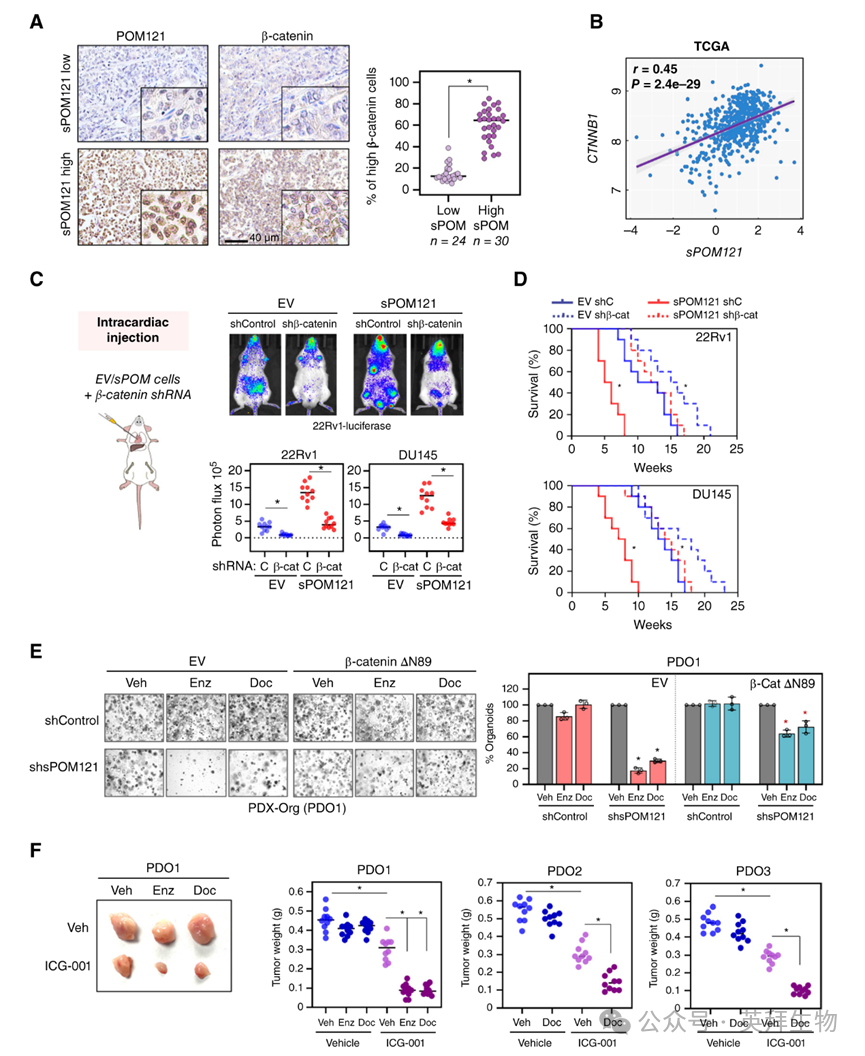
图6:sPOM121通过调节β-连环蛋白的表达促进前列腺癌的侵袭性
7、sPOM121促进前列腺癌的免疫逃逸
基于sPOM121在转录调控免疫生物学过程中的潜在作用(见图5E)以及WNT/β-连环蛋白通路之前已被报道在多种肿瘤类型中促进免疫逃逸,作者决定研究这一轴在前列腺癌中对这种表型的贡献。
为了确定sPOM121是否抑制肿瘤免疫监视,作者使用小鼠前列腺癌细胞系(TRAMP-C2和MyC-CaP)和免疫能力正常的小鼠(C57BL/6和FVB小鼠)来分析抗肿瘤免疫反应。值得注意的是,sPOM121在啮齿动物中不表达,因为这种亚型是晚期进化获得的,在人科动物中被选择。事实上,作者确认小鼠前列腺癌细胞缺乏sPOM121表达。接下来,作者在TRAMP-C2和MyC-CaP细胞中表达sPOM121,并观察到sPOM121表达增加了β-连环蛋白的mRNA和蛋白水平。为了功能性研究sPOM121对免疫逃逸的影响,作者将表达sPOM121或空载体(EV)的TRAMP-C2和MyC-CaP细胞分别皮下注射到C57BL/6和FVB/N雄性小鼠中。一旦肿瘤形成,就通过瘤内注射Poly(I:C)来触发免疫反应。Poly(I:C)给药降低了对照组(EV)肿瘤的生长,而Poly(I:C)的生长抑制效应在表达sPOM121的肿瘤中消失了(图7A)。重要的是,作者观察到用Poly(I:C)处理的表达sPOM121的肿瘤中细胞毒性CD8+ T肿瘤浸润性淋巴细胞显著减少,包括通过飞行时间细胞术(CyTOF;图7B)和免疫组化分析的细胞毒性颗粒酶B阳性CD8+ T细胞。为了确定观察到的sPOM121免疫抑制效应是否通过β-连环蛋白介导,作者分析了由耗竭β-连环蛋白的sPOM121表达的小鼠前列腺癌细胞生成的肿瘤中肿瘤浸润性CD8+ T淋巴细胞,并观察到β-连环蛋白耗竭增加了CD8+ T淋巴细胞浸润(图7C),并减少了用Poly(I:C)处理的表达sPOM121的肿瘤的重量(图7D)。为了进一步确定T细胞监视对sPOM121依赖性肿瘤生长的贡献,作者将空载体(EV,对照)和sPOM121或β-连环蛋白过表达的小鼠前列腺癌细胞分别皮下注射到免疫能力正常(C57BL/6和FVB/N)或免疫能力受损(NOD/SCID)的小鼠中,后者缺乏功能性T细胞。值得注意的是,作者观察到NOD/SCID小鼠中缺乏T细胞减少了对照组和sPOM121以及β-连环蛋白过表达肿瘤之间的肿瘤生长差异。
支持这一轴的临床相关性,高水平的sPOM121与前列腺癌患者组织样本中激活的CD8+ T淋巴细胞的浸润减少显著相关(图7E)。最后,作者研究了sPOM121/β-连环蛋白轴是否能够使免疫检查点抑制剂治疗产生耐药性。与作者对Poly(I:C)的观察类似,sPOM121表达不仅降低了抗PD-1的治疗效果,还减少了TRAMP-C2和MyC-CaP肿瘤中CD8+ T淋巴细胞的积累。重要的是,将表达sPOM121的肿瘤小鼠暴露于联合抗PD-1和β-连环蛋白抑制剂ICG-001的治疗中,显著增强了抗PD-1疗法的疗效(图7F),并提高了小鼠的存活率(图7G),这与肿瘤中CD8+ T淋巴细胞浸润的增加有关。值得注意的是,联合使用ICG-001和抗PD-1的效果在CD8+ T细胞耗竭后显著减弱。
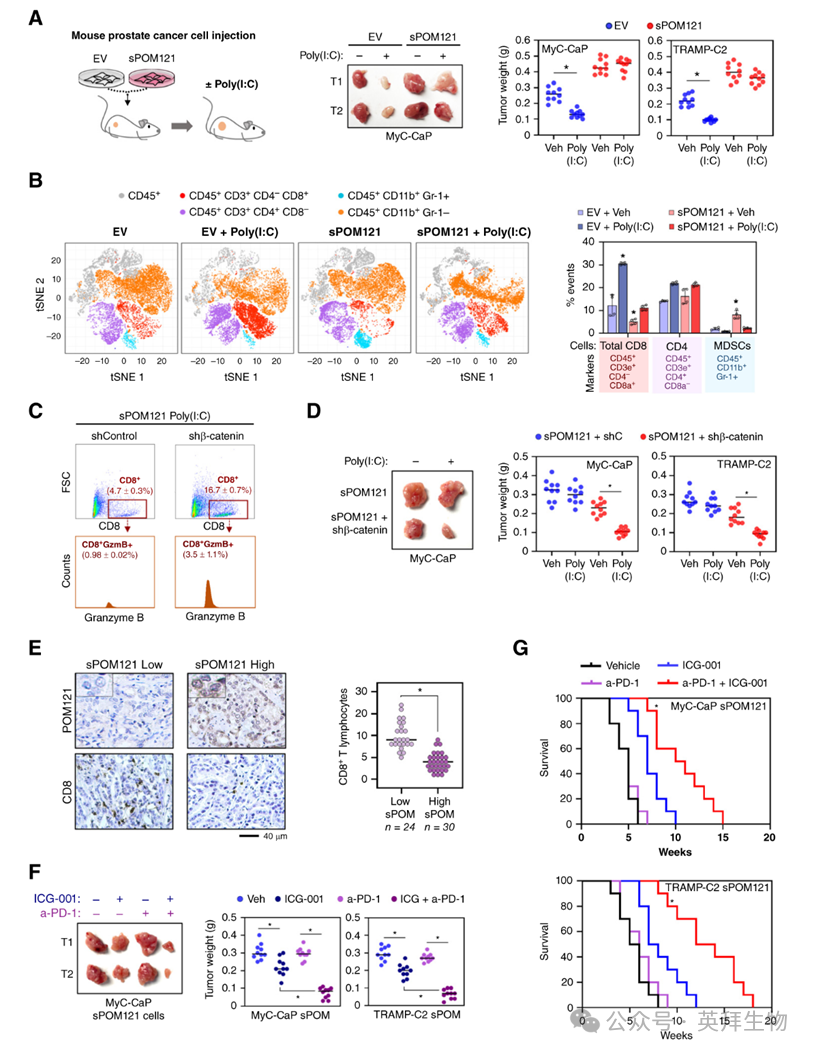
图7:sPOM121促进前列腺癌免疫逃避
结论:
综上所述,这些发现表明,sPOM121/β-连环蛋白轴抑制了T细胞介导的免疫反应,从而导致前列腺癌中免疫检查点抑制剂的临床疗效有限。作者的发现将sPOM121定位为核凝聚体中转录枢纽的关键协调者,该枢纽放大了如β-连环蛋白等癌基因程序,以推动前列腺癌的侵袭性。
参考文献:
Kirthika P, Jawalagatti V, Li P, Xu M, Carceles-Cordon M, Ertel A, Quinn SA, Petrylak DP, Orme JJ, Dehm SM, Antonarakis ES, Heath EI, Pandey MK, Cordon-Cardo C, Huang H, Dong H, Zhu S, Domingo-Domenech J, Rodriguez-Bravo V. Off-pore nucleoporin sPOM121 transcriptionally propels β-Catenin driven tumor progression and immune escape in prostate cancer. Cancer Discov. 2025 Jul 28. doi: 10.1158/2159-8290.CD-25-0629IF: 33.3 Q1 . Epub ahead of print. PMID: 40709833.






