新型生物标志物SIGLEC15:评估乳腺癌恶性程度与免疫状态的“指南针”
先前研究表明,唾液酸结合免疫球蛋白样凝集素15(SIGLEC15)与恶性肿瘤进展及免疫细胞浸润存在显著关联。本研究通过人群队列数据的mRNA测序技术,系统分析并阐明了SIGLEC15在乳腺癌中的功能及其相关机制。我们通过基于人群的数据集进行mRNA测序,分析了SIGLEC15的表达水平并预测其功能。运用单细胞RNA测序技术,探究了SIGLEC15在肿瘤微环境(TME)中的生物学作用。最后通过体内外实验验证了RNA测序分析所得结果。SIGLEC15高表达与乳腺癌患者预后良好相关。高表达SIGLEC15的肿瘤细胞相较低表达细胞表现出较弱的上皮-间质转化(EMT)倾向,可能通过调控ZEB1表达实现。然而,含有此类肿瘤细胞的TME中抗肿瘤免疫反应显著受抑。患者样本蛋白表达分析揭示SIGLEC15表达与CD4、CD8 T细胞浸润呈负相关。小鼠模型实验表明,SIGLEC15过表达肿瘤细胞的侵袭性和迁移能力显著降低。此外,体外与体内实验均证实Nutlin-3a对高表达SIGLEC15的乳腺癌细胞具有更显著的抑制作用。该研究于2025年8月发表在《Genes & Diseases》,IF:9.4。
技术路线

研究结果
1.SIGLEC15水平升高与BRCA患者预后改善相关
为评估SIGLEC15作为癌症治疗靶点的潜力,我们研究了多种癌症中SIGLEC15的同源重组修复(HRD)和杂合性缺失(LOH)情况,这些因素与铂类药物及聚ADP核糖聚合酶(PARP)抑制剂的敏感性密切相关(图1A、B)。在BRCA相关癌症中,SIGLEC15的关联系数表明:表达水平越高的患者对铂类药物及PARP抑制剂的敏感性越低,这证实了SIGLEC15作为治疗靶点的潜力。
通过分析TCGA和GTEx数据集,我们发现不同类型肿瘤组织与其对应正常组织(包括BRCA)中SIGLEC15的表达水平存在显著差异(图1C)。随后我们聚焦BRCA研究发现,BRCA肿瘤中的SIGLEC15表达水平高于正常组织。为验证该结果,我们通过两个GEO数据库(GSE162228和GSE42568)验证了SIGLEC15的表达水平(图1D),结果与TCGA和GTEx数据计算结果一致。
进一步分析发现,肿瘤组织中T1期与T2期之间、T1期与T3期之间均存在显著差异(图1E)。T1期BRCA患者中SIGLEC15表达水平较高,提示该分子可能成为早期BRCA的标志物。随后我们深入探究了SIGLEC15在肿瘤组织中的作用机制。SIGLEC15高表达组(SHES)患者的生存率显著高于低表达组(SLES)(图1F),表明SIGLEC15是BRCA患者的保护性因子。在这些BRCA患者中,SIGLEC15高表达水平与更长的生存期相关。
随后我们研究了SIGLEC15在BRCA细胞系中的表达水平(图1G)。结果显示,SIGLEC15在正常乳腺上皮细胞(MCF10A)和雌激素受体阳性乳腺癌细胞系中的表达显著较高,而在雌激素受体阴性乳腺癌细胞系中则明显较低。这些发现为后续实验提供了重要参考依据。为验证该结果,我们对64例乳腺癌患者的原发肿瘤与邻近非癌组织配对样本进行了SIGLEC15免疫组化染色(图1H)。定量分析显示,正常邻近组织中SIGLEC15表达显著高于肿瘤组织(图1I)。进一步按PAM50分子亚型分层分析发现,相较于HER2富集型和基底样亚型,导管型BRCA亚型的SIGLEC15蛋白水平明显升高(图1J)。生存分析显示,SHES队列患者五年生存率更高(图1K)。这些结果表明,SIGLEC15低表达预示着更高的恶性程度和不良预后。
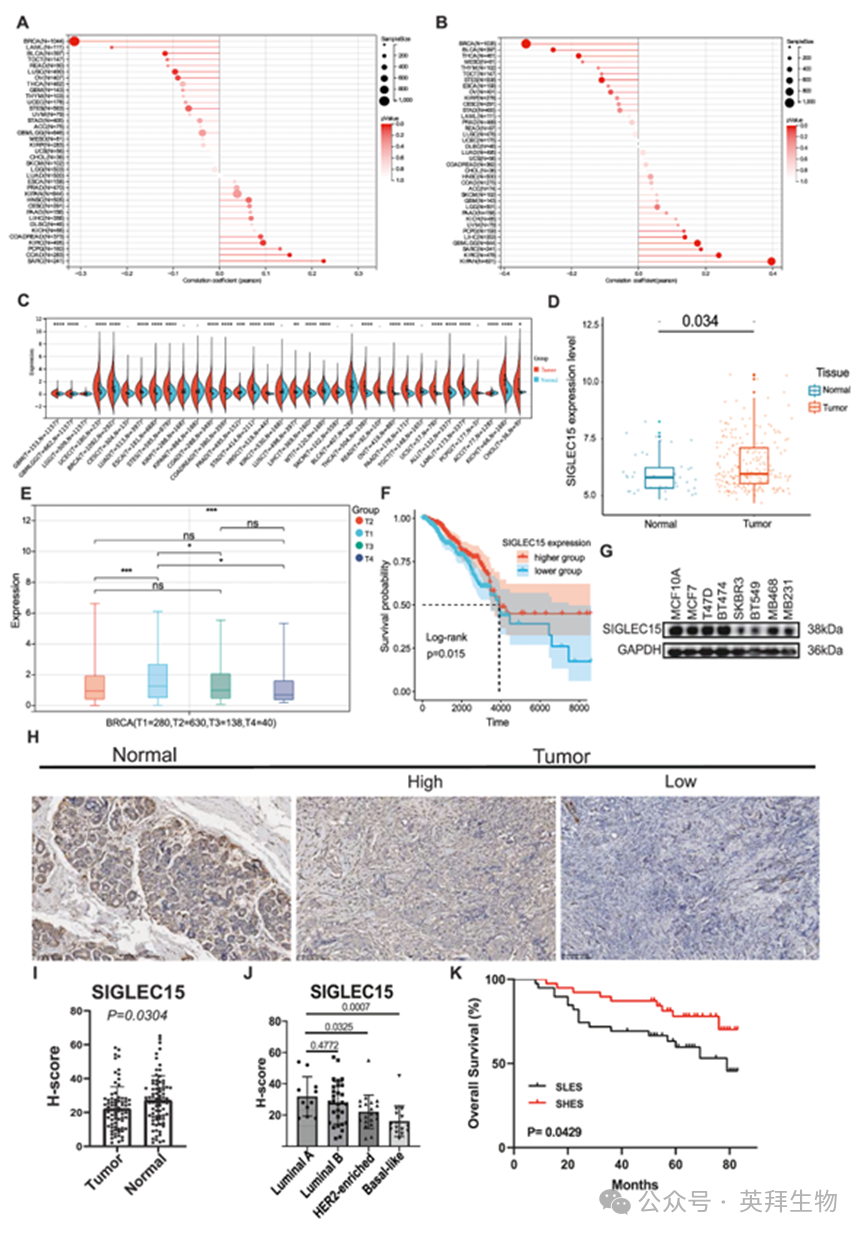
图1.BRCA患者中SIGLEC15的分布
2.SIGLEC15影响BRCA的TME
为探究SIGLEC15是否影响BRCATME,我们通过ESTIMATEScores评估了SIGLEC15表达水平与肿瘤组织细胞之间的关联。结果显示,在BRCA样本中,SIGLEC15表达水平与免疫细胞及间质细胞的存在呈正相关(图2A)。
我们通过CIBERSORT分析比较了SHES组与SLES组的细胞组成。结果显示,随着SIGLEC15表达增加,M0和M1巨噬细胞数量减少,而树突状细胞数量增加,表明抗肿瘤免疫监视增强(图2B)。此外,SHES组中初始B细胞和肥大细胞数量增加,提示TME中体液免疫和炎症反应被激活。SIGLEC15可能抑制细胞免疫功能。
随后我们通过差异表达分析识别SHES与SLES间的差异,发现两组间存在71个下调基因和444个上调基因(图2C)。其中PIP、ANKRD30A、LINC00993和TFF1等基因已知参与BRCA相关重要生物学过程。基于REACTOME和KEGG数据库的通路富集分析显示,差异表达基因主要参与细胞运输、上皮细胞发育及细胞结构改变(图2D)。
不同SIGLEC15表达水平组的基因表达谱分析(GSVA)显示,在SHES组中,细胞分裂相关功能和能量代谢功能下调,而脂质代谢和细胞异型性等功能上调(图2E)。这表明随着SIGLEC15表达水平升高,体液免疫可能被激活,同时伴随能量代谢改变发生细胞异型性。
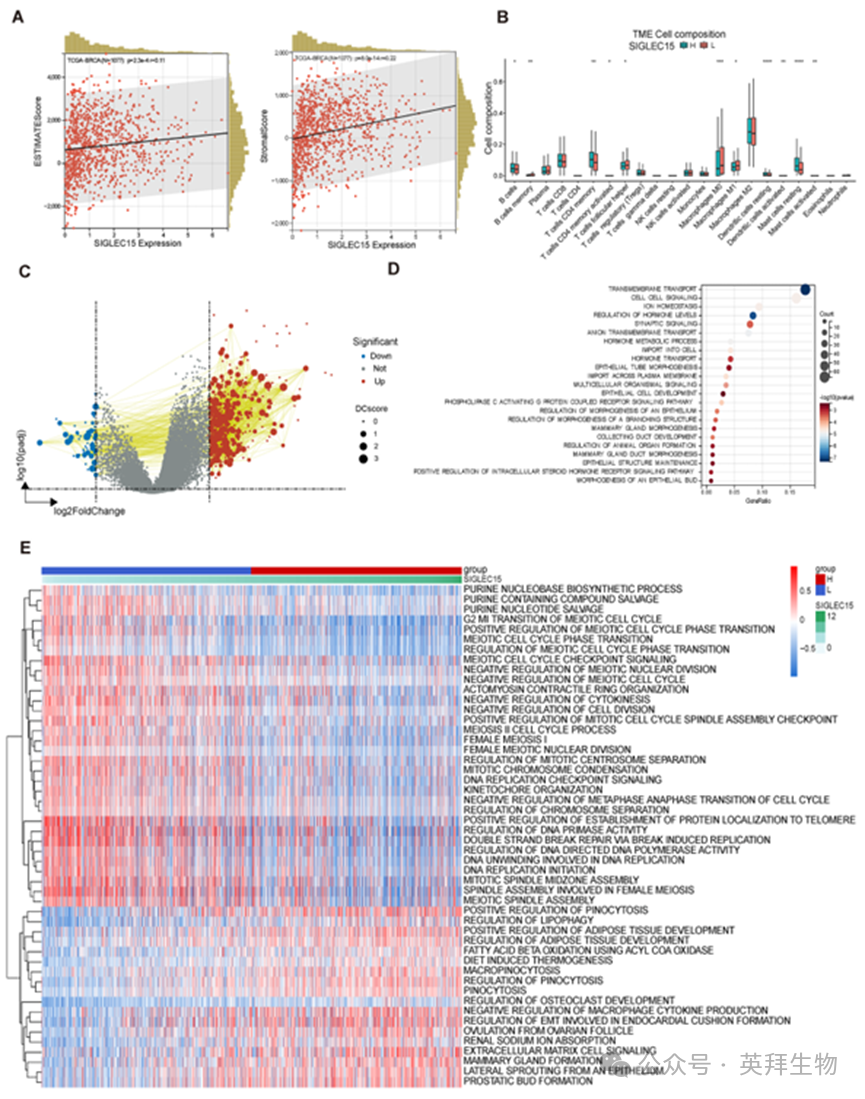
图2.不同SIGLEC15表达水平的免疫细胞图谱及其预测功能取决于TCGA-BRCA数据库
3.SIGLEC15与不同的TME组成及恶性细胞比例相关
我们的目标是确定SIGLEC15主要表达的特定细胞类型。通过单细胞RNA测序数据集GSE176078,我们发现SIGLEC15主要在上皮细胞中表达(图3A)。图3B展示了各类细胞的标志基因,进一步证实SIGLEC15主要表达于恶性细胞(图3C)。此外,我们比较了两组样本中各类细胞的比例(图3D),并分析了T细胞亚型(图S1A、S1B)。
为深入解析TME的构成,我们对比了SHES与SLES中所有细胞类型的分布情况(图3E)。SHES中恶性细胞比例更高,而SLES中调节性T细胞、间质细胞、NK T细胞和CD8 T细胞的比例更高。SHES与SLES在免疫细胞和恶性细胞比例上的显著差异促使我们聚焦于TME。通过CellChat分析发现,SHES中细胞间相互作用强度较低且数量较少(图3F)。
SHES中活跃信号通路包括PERIOSTIN、FGF、SEMA3、COMPLEMENT、VEGF、TNF、MK和SPP1,而SLES中活跃通路包含CALCR、BAFF、MIF、ANNEXIN、CXCL、GALECTIN、CCL、TGFb、FASLG、GAS、 GDF、CSF、PARS和IFN-2(图3G)。我们发现SHES与SLES间存在显著的细胞间相互作用差异,尤其体现在CD4+ T细胞、恶性细胞和间充质细胞之间(图3H)。
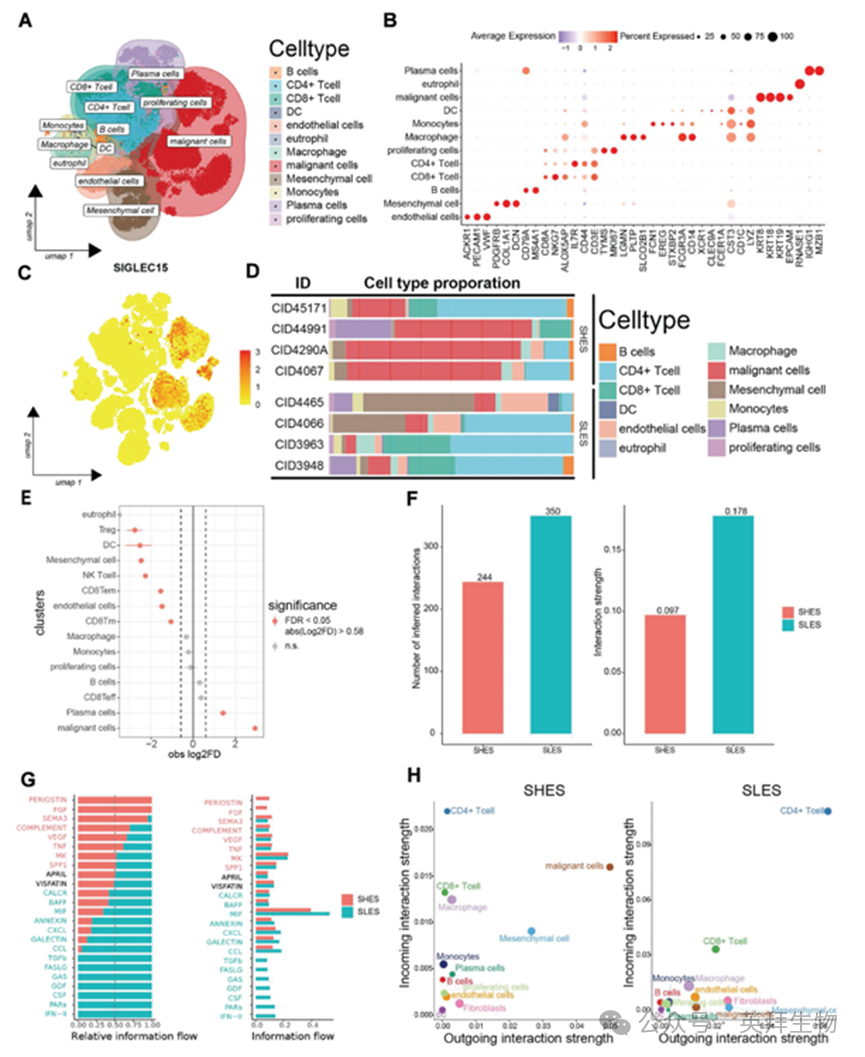
图3.单细胞分析揭示了SIGLEC15在TME中的功能
4.SIGLEC15表达抑制乳腺癌微环境中的T细胞浸润
随后我们聚焦于CD4+ T细胞。我们重点研究了CD4+ T细胞的作用机制:在SLES组中,该细胞群分别呈现出从巨噬细胞接收并向其他细胞分泌巨噬细胞迁移抑制因子(MIF)的增强现象。该现象已被证实具有抑制抗肿瘤免疫的作用(图4A、B)。值得注意的是,SLES组与SHES组的CD4+ T细胞在相互作用模式及细胞比例上存在显著差异。通路评分分析显示,SLES组CD4+ T细胞中IFN-γ、IFN-α和IL-2等信号通路活性增强。相反,SHES组中与T细胞活化及T细胞介导的肿瘤反应相关的通路显著下调(图4C)。这提示存在可能促进肿瘤免疫反应和转移的潜在危险因子。尽管SLES组恶性细胞比例较低,我们推测该组活跃的抗肿瘤免疫通过靶向免疫反应有效消灭了大部分恶性细胞。然而,TME中存在的MIF可能为残留恶性细胞提供保护,使其得以逃避免疫介导的清除。
我们采用hdWGCNA方法对TME内的动态功能模块进行了深入研究。通过该分析,我们发现了与SIGLEC15表达相关的九个模块(图S1D)。在模块S2、S3、S8、S7和S5中观察到正相关,其余模块在SHES中呈现负相关(图4D)。这些模块间存在相互关联,且每个模块均可映射至特定细胞类型聚类(图4E)。研究发现S1基因模块在SLES来源的CD8+ T细胞中呈现高表达水平(图4D,E)。该模块基因富集的通路提示CD8+ T细胞活化状态,包括IL-21、IL-9、IL-2信号通路及T细胞受体复合物(图4F)。在SIGLEC15表达下调的背景下,TME中的T细胞处于激活状态,同时承受着增强的MIF刺激。值得注意的是,MIF作为恶性细胞转移的关键相关因子,能抑制CD4+和CD8+ T细胞对局部肿瘤细胞的细胞毒性活性。
为验证生物信息学分析结果,我们通过切片染色技术验证了该群体内的实际状况(图4G)。在乳腺癌患者的肿瘤组织中,SIGLEC15表达水平与CD4和CD8表达呈负相关。此外,SIGLEC15表达上调与肿瘤组织中PD-1、FOXP3和CXCR1水平升高以及CD69水平降低相关(图4H;图S1E)。这些观察结果进一步证实了SIGLEC15在乳腺癌TME中抑制T细胞功能的作用。
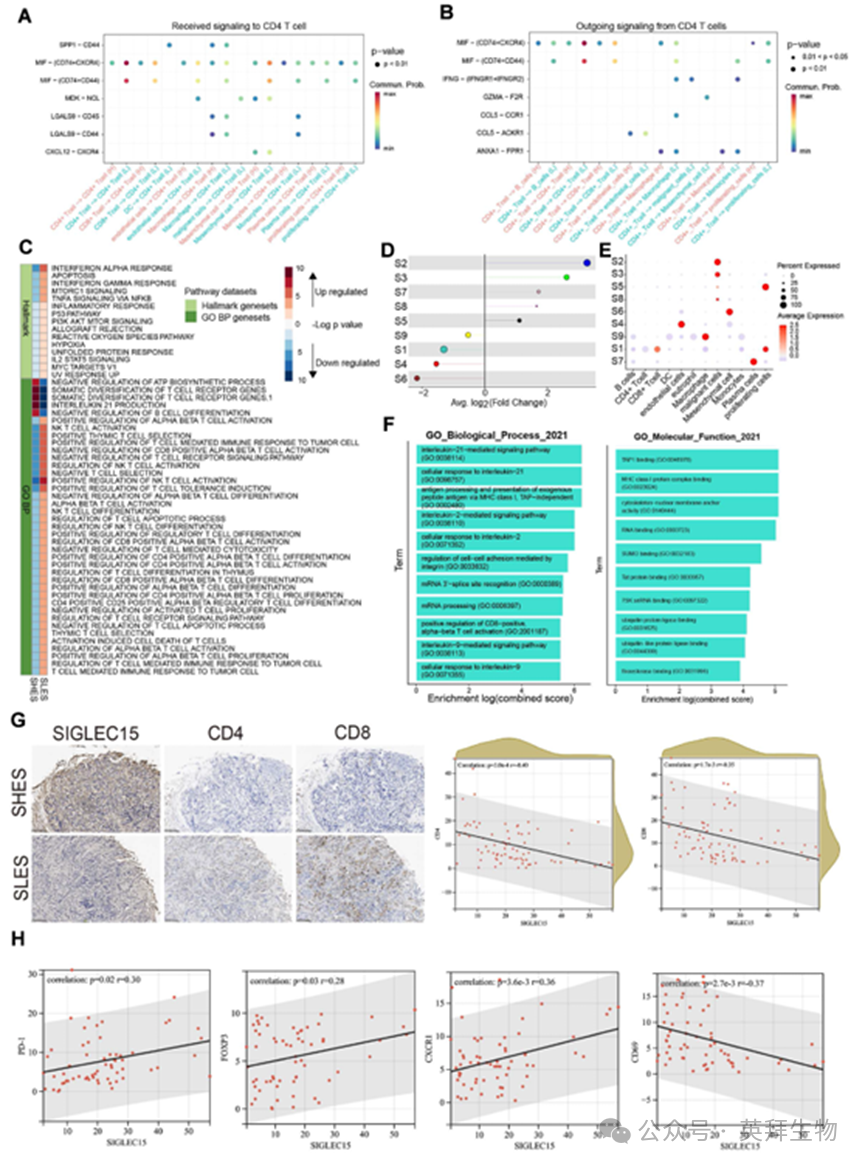
图4.对原发性BRCATME的分析显示,SHES中存在显著的T细胞抑制现象
5.SIGLEC15表达抑制乳腺癌EMT及转移能力
在我们的分析中,SHES亚组显示出显著更高的恶性细胞比例和更低的中胚层细胞比例,同时伴随EMT通路的抑制。从机制上讲,发现SIGLEC15表达能抑制乳腺癌细胞中的EMT通路,从而阻碍恶性细胞向间质样表型的转分化。恶性细胞的通路评分分析支持该假说(图5A),显示SHES中EMT通路呈下调状态。同时伴随移植物排斥通路的下调,以及与上皮细胞形态成熟度和维持相关的通路显著激活。相反地,在间质细胞中,上调的EMT路、顶端表面与顶端连接的改善,以及SHES中间质细胞发育通路的上调,均凸显了间质细胞的活跃功能,这可能与其细胞间紧密连接有关(图5B)。
基于这些发现,我们提出恶性细胞在两组间表现出不同的EMT状态,这可能导致肿瘤转移差异。为验证该假说,我们采用CytoTRACE技术评估了BRCA骨转移上皮细胞中恶性细胞的分化状态(图5C;图S2A、S2B)。恶性细胞被划分为三个亚群(T1、T2和T3),其中T1和T2的分化潜能高于T3。通过monocle3计算的分化轨迹显示,T1和T2亚群可分化为T3亚群(图5D)。值得注意的是,与SLES相比,SHES中T1细胞比例显著升高而T3细胞比例降低(图5E)。我们运用AUCell分析了SHES和SLES中的上皮-间质转化(EMT)通路评分(图5F)。相较于T1和T2亚群,T3亚群的EMT通路呈现上调状态。
为验证该发现,我们构建了SIGLEC15过表达的BT549和MB231乳腺癌细胞系,并检测了EMT通路相关分子的蛋白表达水平(图5G)。结果显示,SIGLEC15过表达显著降低了MB231和BT549细胞中ZEB1、N-钙粘蛋白和波形蛋白的蛋白表达水平。在MB231和BT549细胞系中均观察到类似效应。这些发现表明EMT程序受到抑制,暗示其可能影响乳腺癌细胞的转移能力。为进一步验证SIGLEC15在EMT和转移中的作用,我们进行了伤口愈合实验和Transwell实验。在SIGLEC15过表达的BT549和MB231细胞中,其迁移和侵袭能力均显著低于对照组细胞(图5H、I;图S2C)。相反,敲低SIGLEC15的MB231细胞表现出增强的迁移和侵袭能力,同时伴随上皮间质转化主调控因子ZEB1和间质标志物N-钙粘蛋白的蛋白水平升高(图S2D–S2H)。这些功能实验共同证明SIGLEC15可抑制乳腺癌细胞的EMT进展和转移能力。
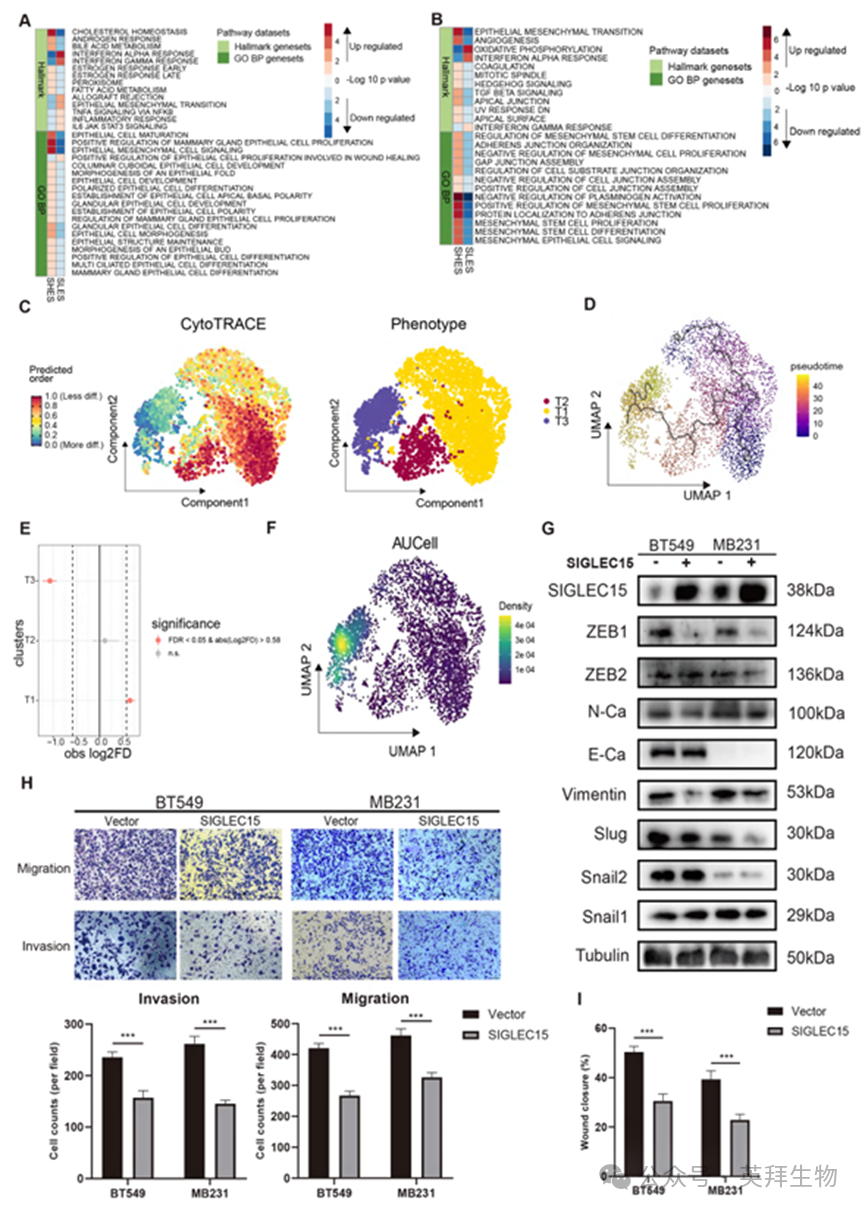
图5.SIGLEC15表达抑制乳腺癌EMT及转移能力
6.SIGLEC15通过下调ZEB1表达抑制EMT过程
在我们的分析中,SHES亚组显示出显著更高的恶性细胞比例和更低的中胚层细胞比例,同时伴随EMT通路的抑制。从机制上讲,发现SIGLEC15的表达能抑制乳腺癌细胞中的EMT通路,从而阻碍恶性细胞向间质样表型的转分化。SIGLEC15与EMT之间的关系仍不清楚。为解答此问题,我们运用恶性细胞解耦分析法识别显著改变的转录因子(图6A)。发现可促进EMT生物过程的ZEB1在SLES中高度表达。由于SIGLEC15过表达细胞中ZEB1下调,我们推断ZEB1是SIGLEC15的下游因子。
接下来,我们对单细胞RNA测序样本进行了高密度WGCNA分析,以识别与SIGLEC15表达水平相关的基因模块。其中,模块S2、S3和S8在表达SIGLEC15的恶性细胞中呈现更强的相关性。通过模块S3的GOBP通路进行功能富集分析,揭示了与ZEB活性相关的显著通路,如TGF-β和Wnt3信号通路(图6B)。
为验证SIGLEC15与ZEB1的关联性,我们构建了ZEB1过表达质粒。ZEB1过表达后,BT549和MB231乳腺癌细胞的EMT通路上调,表现为N-钙粘蛋白和波形蛋白表达增加。ZEB1可逆转SIGLEC15过表达对EMT通路的抑制作用(图6C)。体外实验同样获得相同结果:ZEB1过表达可逆转SIGLEC15对三阴性乳腺癌细胞迁移和侵袭的抑制作用(图6D-F;图S3)。SIGLEC15通过调控ZEB1表达抑制EMT通路,从而调控乳腺癌细胞的生物学行为。
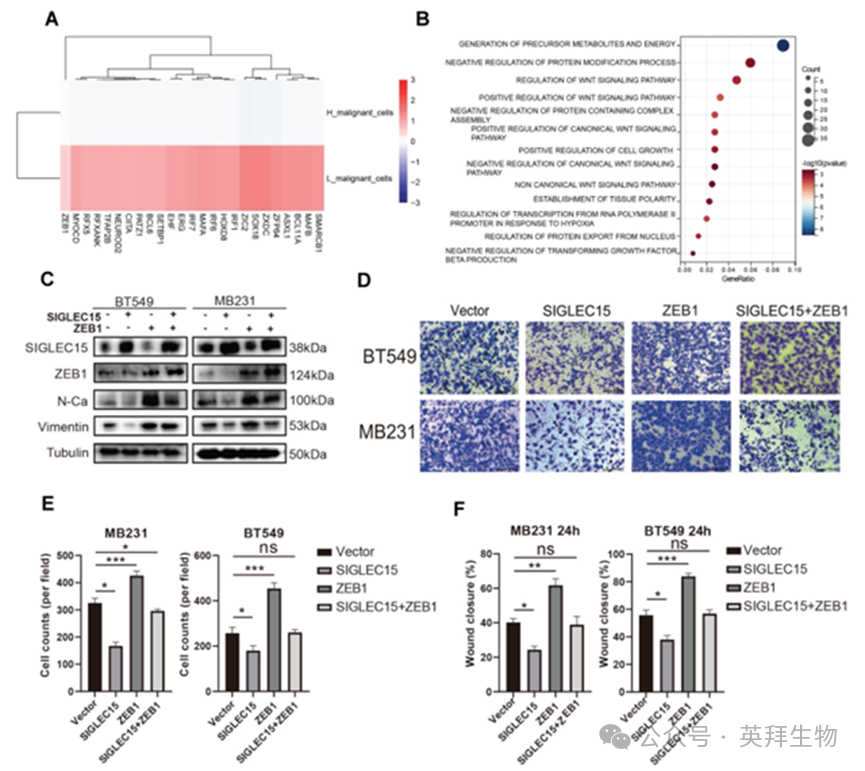
图6.SIGLEC15通过下调ZEB1表达抑制EMT过程
7.SIGLEC15调控三阴性乳腺癌细胞增殖并制定差异化治疗策略
此前我们观察到,SIGLEC15的高表达赋予铂类药物耐药性,并伴随免疫细胞浸润减少,这可能导致免疫疗法疗效降低。无限细胞分裂与增殖是该生物学环境的特征性表现。我们首先探究了SIGLEC15过表达后MB231和BT549细胞增殖能力的改变。数据表明,SIGLEC15过表达显著降低了细胞板克隆形成效率和细胞存活率。相反,敲低SIGLEC15则显著增强了MB231细胞的增殖能力(图7A、B;图S4A-S4C)。此外,细胞周期相关蛋白分析表明SIGLEC15与Cyclin D1蛋白表达呈负相关(图S4D, S4E)。随后我们利用GDSC乳腺癌数据库筛选针对SIGLEC15过表达乳腺癌细胞的潜在药物(图7C)。研究发现Nutlin-3a在候选药物中敏感性最高(表S1)。作为高效的MDM2抑制剂,Nutlin-3a可阻断MDM2与p53的相互作用,稳定p53蛋白,并诱导细胞自噬与凋亡。因此,我们采用平板克隆实验和CCK8增殖实验评估了药物对SIGLEC15过表达乳腺癌细胞增殖的影响。结果表明,Nutlin-3a对SIGLEC15过表达细胞系具有强效抑制作用(图7D、E)。相反,卡铂显著抑制了SIGLEC15敲低MB231细胞的增殖(图7F、G;图S4G)。
此外,我们在体内验证了这些发现,结果与体外实验一致,表明SIGLEC15表达水平较高的肿瘤显著小于对照组。Nutlin-3a治疗进一步抑制了高SIGLEC15表达肿瘤的生长(图7H)。此外,我们采用SIGLEC15敲低MB231细胞开展体内肿瘤形成实验。结果显示,SIGLEC15敲低MB231细胞的体内肿瘤体积大于对照组,且卡铂对低表达SIGLEC15的肿瘤具有显著抑制作用(图7I)。通过整合数据库、临床样本及体内/体外实验数据的综合分析,我们全面阐明了SIGLEC15在乳腺癌(尤其是三阴性乳腺癌)中的作用机制(图8)。
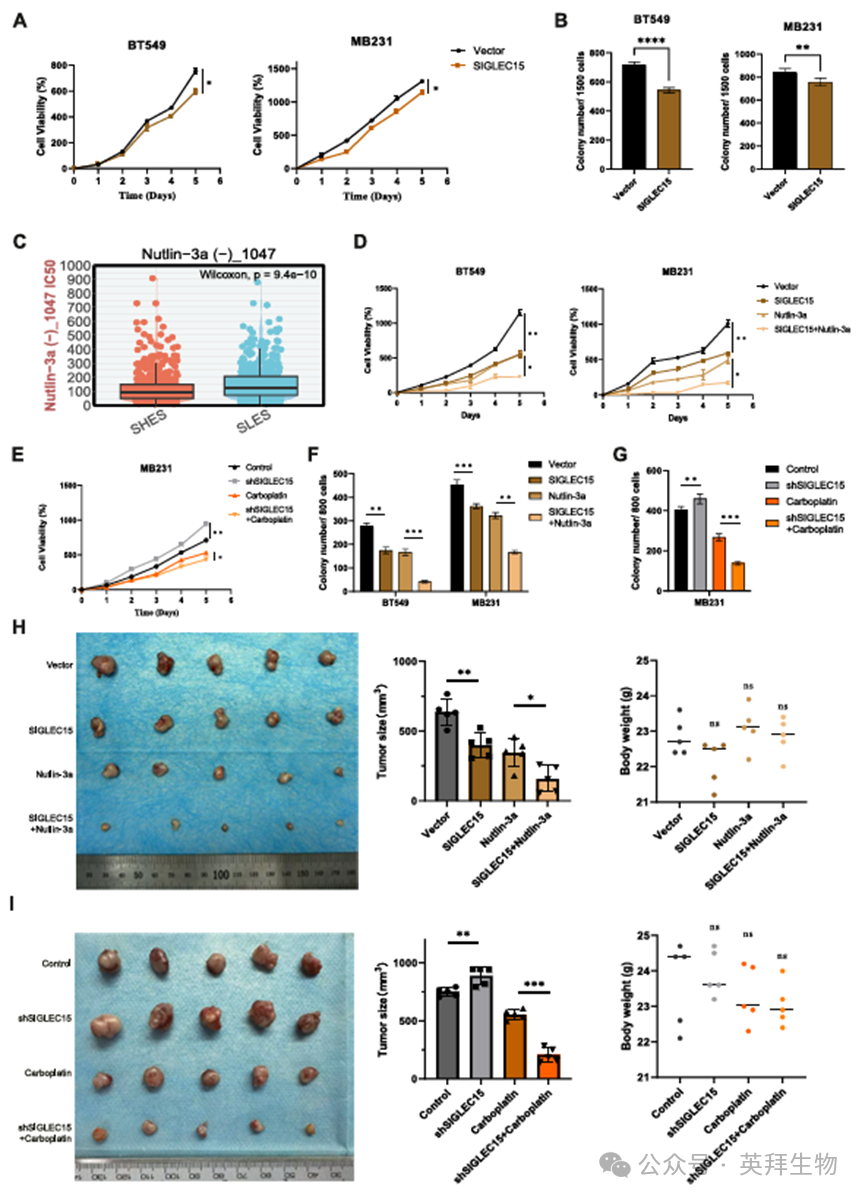
图7.体内和体外实验验证了SIGLEC15对乳腺癌增殖的影响,并基于其表达水平探索了治疗策略
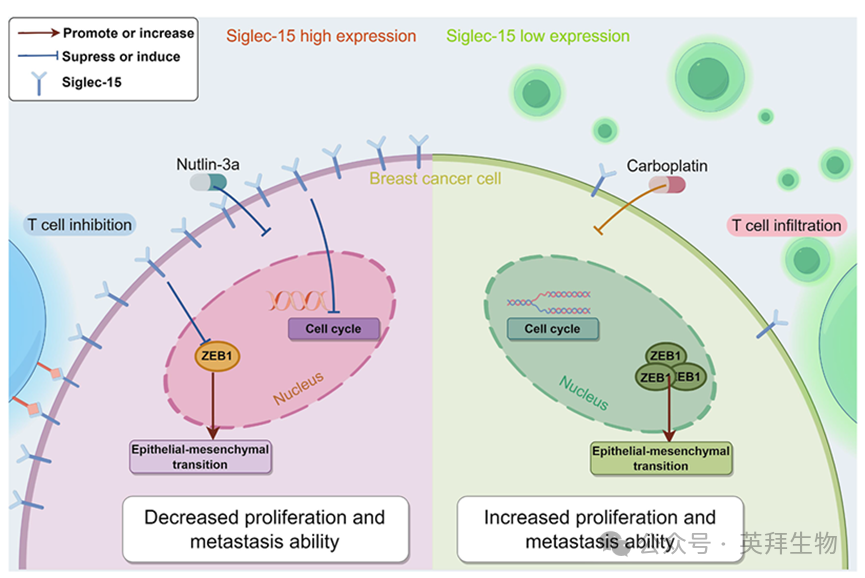
图8.SIGLEC15表达异质性在调控乳腺癌细胞-微环境相互作用中的机制及其靶向治疗策略
结论
综上所述,本研究阐明了SIGLEC15在BRCATME中的双重作用。具体而言,SIGLEC15既参与抑制T细胞活性,又同时减轻BRCA肿瘤细胞的转移能力。这种双功能特性表明,治疗策略可根据SIGLEC15表达水平进行更精准的定制。对于SIGLEC15低表达的三阴性乳腺癌患者,免疫疗法或卡铂治疗可能更具疗效。反之,Nutlin-3a对SIGLEC15高表达患者可能更为有效。
参考文献
Tan Z, Xin H, Chen J, Lei M, Tu G, Tang L. SIGLEC15 modulates the immunosuppressive microenvironment and suppresses malignant phenotypes in triple-negative breast cancer. Genes Dis. 2025 Aug 9;13(1):101799. doi: 10.1016/j.gendis.2025.101799. PMID: 41158758; PMCID: PMC12557572.






