新型自噬抑制剂对羟基肉桂醛通过靶向LDHA磷酸化介导的代谢重编程抑制食管鳞状细胞癌
自噬是食管鳞状细胞癌(ESCC)快速增殖的关键,其调控为治疗干预提供了有前景的途径。最近的研究阐明了自噬和葡萄糖代谢之间的相互作用,而同时靶向这两种生物过程的抗癌药物很少。在这项研究中,研究者鉴定一种天然化合物,对羟基肉桂醛(CMSP),最初由研究者的研究小组从木鳖子(CMS)中分离出来,在体外和体内模型中都对ESCC表现出显著的抗癌活性。该研究表明,CMSP通过破坏自噬通量诱导ESCC细胞系和患者来源的类器官(PDO)模型的凋亡。从机制上讲,CMSP特异性结合细胞质中的糖酵解酶LDHA,通过阻断其膜转位来阻碍其磷酸化,从而破坏其与FGFR1的相互作用。这种抑制导致糖酵解产生的乳酸减少,溶酶体酸度降低,AMPK/mTOR通路受到抑制,最终导致自噬阻断和凋亡诱导。此外,体内研究强调了CMSP通过破坏自噬在ESCC中的潜在临床应用。总之,研究者提出了一种新的治疗策略,通过同时靶向糖酵解介导的自噬来精确治疗ESCC。该研究于2026年1月发表在《Research (Wash D C)》,IF 10.9分。
技术路线:
主要研究结果:
1、CMSP促进ESCC细胞和患者来源类器官凋亡
CMSP最初由研究者的研究团队从木鳖子(Cochinchina momordica seed, CMS)中分离得到,已有文献记载其在10至40μg/ml浓度下可抑制ESCC细胞活力。然而,其具体作用机制尚待阐明。在本研究中,研究者将不同浓度的CMSP给予ESCC细胞系和正常食管上皮细胞系HEEC。结果证实,CMSP以剂量依赖性方式有效降低ESCC细胞活力,而对HEEC增殖影响较小(图S1A和B)。此外,流式细胞术分析一致表明,CMSP以浓度依赖性方式诱导ESCC细胞凋亡(图1A和B)。另外,在CMSP处理后观察到ESCC细胞中裂解型caspase-3、caspase-8和caspase-9以及凋亡小体水平升高(图1C和图S1C)。这些发现表明CMSP显著促进ESCC细胞凋亡。
患者来源类器官(PDOs)因其具有优于其他体外模型的疾病特征捕获能力,为验证潜在抗癌药物提供了宝贵平台。因此,研究者从新鲜解剖的ESCC组织中建立了具有三维结构的PDOs模型,两条类器官细胞系均表现出圆形形态,缺乏任何管腔结构,这是ESCC类器官的标志(图1D)。进一步结果显示了肿瘤类器官的组织学特征,与ESCC组织中观察到的特征高度相似(图1E)。随后的分析表明,CMSP以剂量依赖性方式显著抑制ESCC类器官细胞系(PDO-1和PDO-2)的生长和有机构象(图1F和G)。重要的是,PDOs活力的抑制率根据特定类器官谱系而显著不同(图S1D)。同样,TUNEL(末端脱氧核苷酸转移酶介导的脱氧尿苷三磷酸缺口末端标记)染色结果显示,与对照组相比,经CMSP处理的类器官中异硫氰酸荧光素(FITC)阳性细胞比例显著更高,表明细胞凋亡(图1H),证实CMSP给药诱导ESCC类器官凋亡。
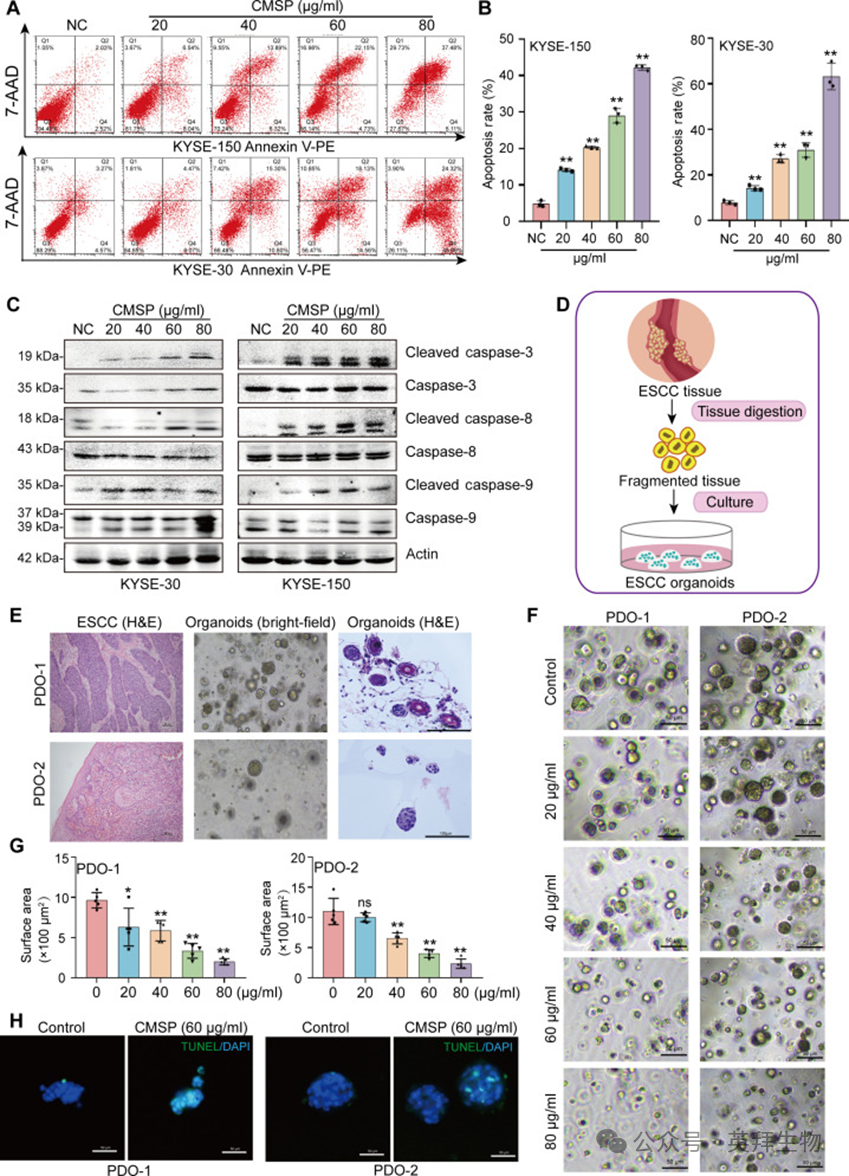
图1:CMSP促进ESCC细胞和类器官的凋亡
2、CMSP在ESCC细胞中调控自噬和糖酵解
为深入探究CMSP诱导凋亡的分子机制,研究者对经CMSP处理或未经处理的KYSE-30细胞进行了无标记定量蛋白质组学分析(图2A)。主成分分析(PCA)显示,与对照组相比,CMSP组的PC1发生显著偏移(图S2A)。初步筛选基于|倍数变化|>2和P<0.05的标准,在CMSP组中鉴定出1,554个下调蛋白和673个上调蛋白(表S1和S2以及图S2B和C)。一致地,基因集富集分析(GSEA)显示CMSP处理组中凋亡通路显著富集(图2B)。接下来,观察到CMSP处理后差异表达蛋白显著改变的生物学功能富集于自噬、糖酵解、氧化磷酸化和AMPK通路(图2C和图S2D)。
为进一步剖析其分子机制,研究者研究了CMSP如何影响自噬水平和糖酵解进程。首先,透射电子显微镜(TEM)显示,与对照细胞相比,自噬空泡数量显著增加(图2D和图S2E)。此外,共聚焦显微镜分析证实了CMSP对ESCC细胞瞬时表达绿色荧光蛋白(GFP)标记LC3B的自噬调节作用,且CMSP处理优先诱导GFP-LC3B点状聚集增加(图2E和图S2F),表明CMSP增加了ESCC细胞的自噬体。为进一步探索完整自噬流的特征,对自噬标志蛋白LC3B和p62进行了初步检测。因此,研究者的发现揭示了CMSP处理的ESCC细胞中LC3B-II和p62蛋白表达呈剂量和时间依赖性累积(图2F和G)。一致地,在经CMSP处理的ESCC类器官中观察到LC3B和p62水平升高(图2H)。总的来说,这些观察强烈表明CMSP处理抑制了ESCC细胞中的溶酶体降解。溶酶体酸化和自噬体-溶酶体融合对于维持功能性自噬流至关重要。因此,研究者利用串联荧光标记LC3B来提高对酸性自噬溶酶体与中性自噬体之间pH差异的认识。与上述结果一致,CMSP处理的细胞显示出黄色点状形成显著增加,但红色点状数量没有相应增加(图2I和图S2G),进一步证实了CMSP通过抑制自噬流来抑制ESCC细胞自噬。
此外,蛋白质组学分析表明CMSP介导的自噬与氧化磷酸化和糖酵解/糖异生通路密切相关(图2J)。研究者接下来通过Seahorse分析仪评估细胞外酸化率(ECAR)和氧消耗率(OCR)来研究糖酵解通量。结果显示,CMSP处理降低了整体糖酵解通量(图2K和L),同时增加了氧消耗水平(图2M和N)。这些结果共同表明CMSP同时破坏ESCC细胞中的自噬流和糖酵解。
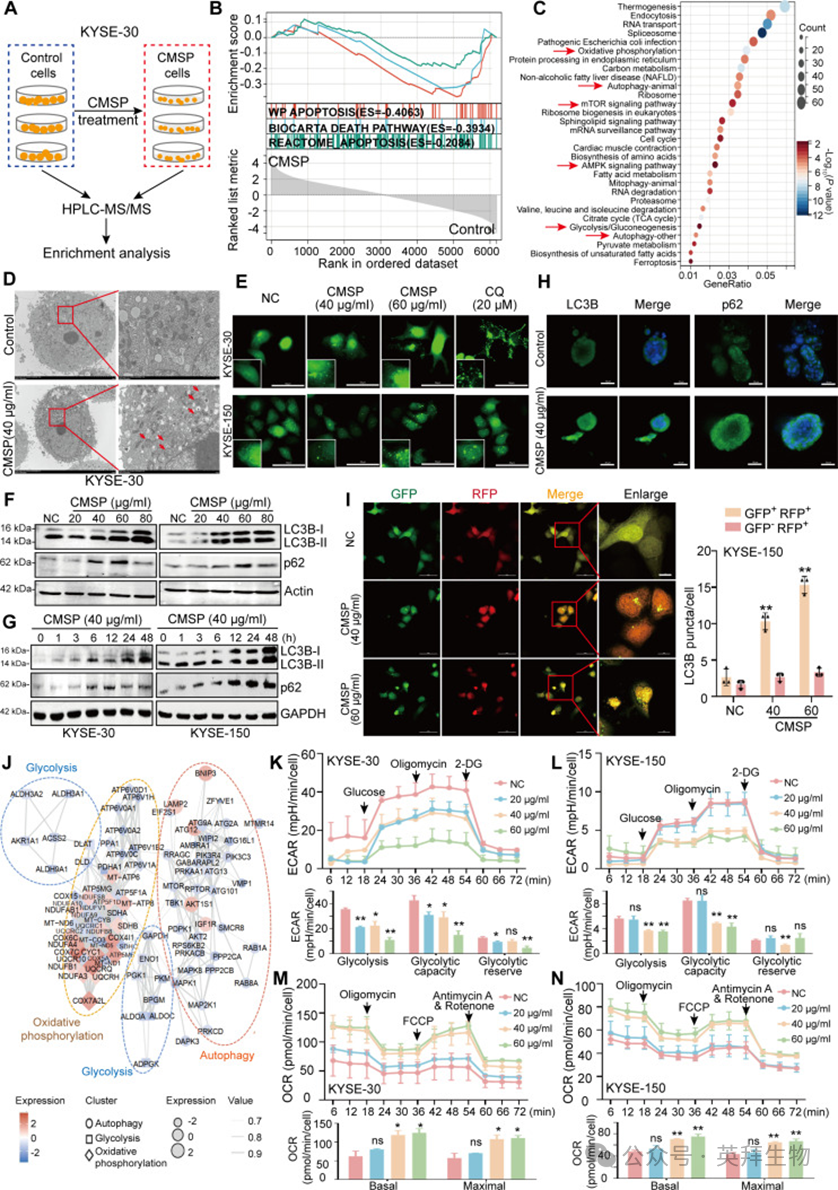
图2:CMSP抑制ESCC细胞自噬和糖酵解
3、CMSP通过抑制自噬和糖酵解诱导ESCC凋亡
鉴于观察到CMSP处理不仅促进凋亡,而且抑制ESCC细胞中的自噬和糖酵解,研究者进一步剖析了自噬和糖酵解抑制在CMSP诱导凋亡中的作用。众所周知,自噬和凋亡相互作用,一些研究人员认为它们是相互抑制的,各种细胞分子通过抑制自噬来增强细胞凋亡,从而导致肿瘤生长减少。在此,为进一步阐明自噬在CMSP诱导凋亡中的参与,随后使用了自噬激活剂雷帕霉素。首先,研究者的研究显示,雷帕霉素给药显著恢复了CMSP处理主要改变的LC3B-II和p62水平(图3A)。随后,经CMSP处理的KYSE-30和KYSE-150细胞表现出增殖抑制显著增加,而当雷帕霉素与CMSP联合使用时,这种效应显著减弱(图3B)。一致地,流式细胞术和裂解型caspase-3分析表明,CMSP增强了ESCC细胞凋亡,而联合使用雷帕霉素显著逆转了这一效应(图3C和D)。
此外,采用寡霉素作为糖酵解刺激剂来阐明糖酵解在CMSP诱导凋亡中的作用。流式细胞术分析表明,寡霉素部分挽救了CMSP诱导的凋亡(图3E)。此外,寡霉素处理显著恢复了CMSP处理主要改变的LC3B-II和p62水平(图3F)。在寡霉素处理后,观察到类似的结果,即CMSP诱导的自噬流抑制被部分逆转(图3G)。总的来说,数据表明CMSP通过抑制自噬和糖酵解来促进ESCC凋亡,而糖酵解的激活可以拮抗CMSP诱导的自噬抑制。
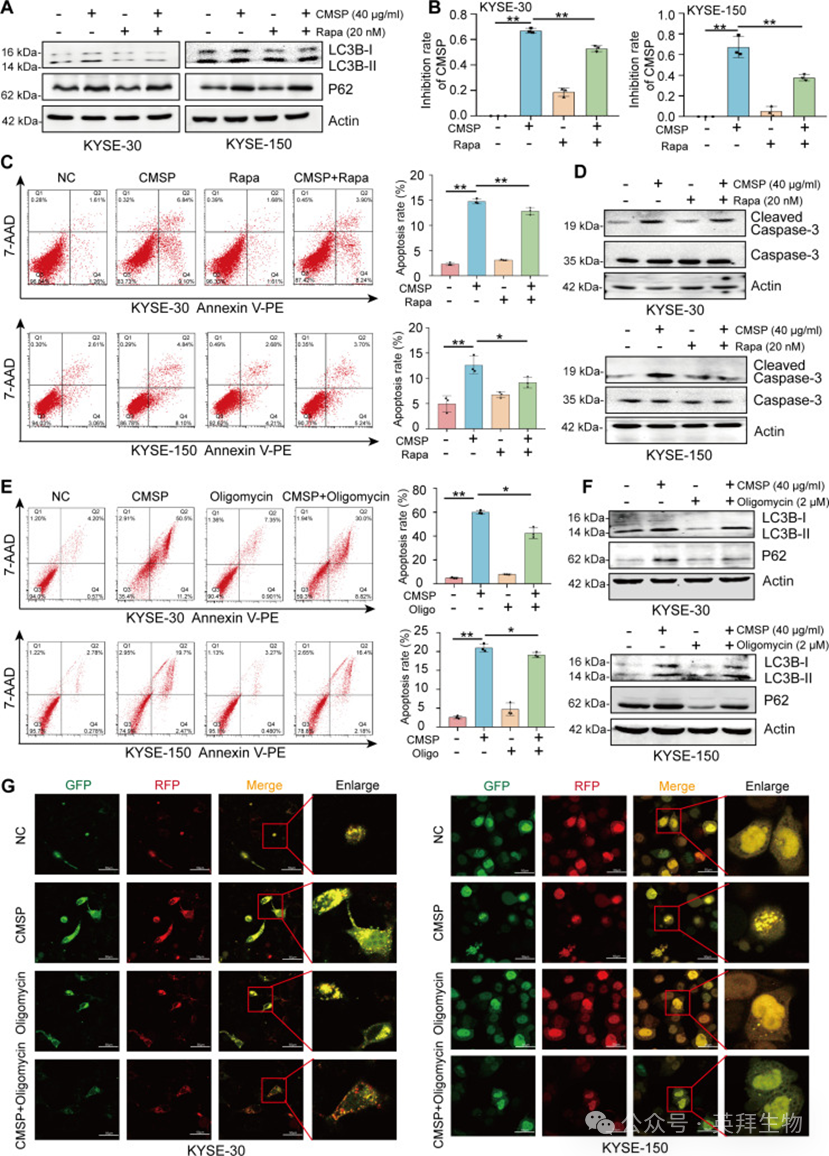
图3:CMSP通过抑制自噬诱导ESCC细胞凋亡
4、CMSP直接与LDHA结合并通过阻断与FGFR1的相互作用来抑制其磷酸化
为阐明CMSP诱导ESCC细胞凋亡的潜在机制,研究者合成了一种生物素标记探针(生物素-CMSP)来研究与CMSP相互作用的特定蛋白(图S3A和B)。pull-down测定显示生物素-CMSP组有一条明显的条带(图4A),随后的高效液相色谱-串联质谱(HPLC-MS/MS)分析鉴定出516个可能与CMSP结合的蛋白(表S3)。值得注意的是,糖酵解酶LDHA位于前5个富集结合蛋白之中(图4B和C)。进一步的pull-down/蛋白质免疫印迹试验证实LDHA蛋白为潜在靶点(图4D)。如图S3C所示,根据UALCAN和GEPIA的公共数据,与正常对照相比,ESCC样本中LDHA表达显著升高。此外,LDHA被公认为在瓦博格效应(Warburg effect)中发挥关键作用;因此,研究者假设这可能解释了CMSP在ESCC细胞中抑制糖酵解的分子机制。此外,分子对接和动力学模拟表明CMSP与LDHA蛋白相互作用,可能通过残基Tyr82、Gly96和Ala97实现(图4E)。为确认计算预测,研究者纯化了LDHA蛋白以及LDHA Y82突变体、LDHA G96突变体和LDHA A97突变体蛋白,其中分别突变了Tyr82、Gly96和Ala97(图S3D和E)。生物层干涉测定(BLI)结果显示CMSP可以与LDHA结合,Kd为3.202×10^-6,而当LDHA的Tyr82、Gly96或Ala97发生突变时,这种结合被破坏(Kd Y82突变体=2.4×10^-4,Kd G96突变体=1.1×10^-4,Kd A97突变体=5.8×10^-5)(图4F和图S3F)。这些发现提供了直接证据,表明CMSP优先与野生型LDHA而非突变体结合,表明Tyr82、Gly96或Ala97在此结合过程中起关键作用。随后,研究者采用细胞热迁移试验(CETSA)揭示CMSP在46至62°C温度范围内增强了LDHA的热耐受性(图4G)。这些发现表明CMSP特异性结合LDHA。
然而,研究者的进一步结果表明CMSP并未改变LDHA的整体表达水平(图4H)。鉴于研究表明在Y10位点的直接磷酸化可增加LDHA的酶活性,研究者发现CMSP处理显著降低了这种磷酸化(图4I),与这一假设一致。同样,在经CMSP处理的ESCC类器官中也观察到磷酸化LDHA减少(图4J)。此外,有文献记载LDHA的磷酸化受FGFR1调控,FGFR1是一种在多种癌症中经常过度表达的膜受体酪氨酸激酶。随后,研究者对ESCC组织芯片中FGFR1和p-LDHA的表达进行了分析。结果显示,与正常组织相比,ESCC组织中FGFR1和p-LDHA显著过度表达,且在ESCC样本中FGFR1与p-LDHA表达之间存在显著正相关(图S4A)。随后,His标签pull-down试验证实了重组LDHA(rLDHA)与FGFR1(rFGFR1)之间的直接相互作用,而CMSP的存在减弱了这种相互作用(图4K),尽管CMSP不影响FGFR1表达水平,也未检测到CMSP与FGFR1之间的任何相互作用(图S4B和C)。
考虑到FGFR1是一种膜相关蛋白,研究者假设CMSP可能影响LDHA的细胞内分布,从而抑制膜上FGFR1诱导的磷酸化。首先,观察到LDHA和CMSP均定位于细胞质中(图4L)。随后的共聚焦显微镜显示FGFR1和LDHA在细胞膜上共定位。然而,在加入CMSP后,这种共定位减少(图4M)。一致地,亚细胞分级分离分析证实CMSP处理导致LDHA的膜定位减少(图4N)。综上所述,这些发现表明CMSP在细胞内与LDHA相互作用,破坏其膜定位,并竞争性抑制FGFR1与酶的结合,从而阻碍其磷酸化。
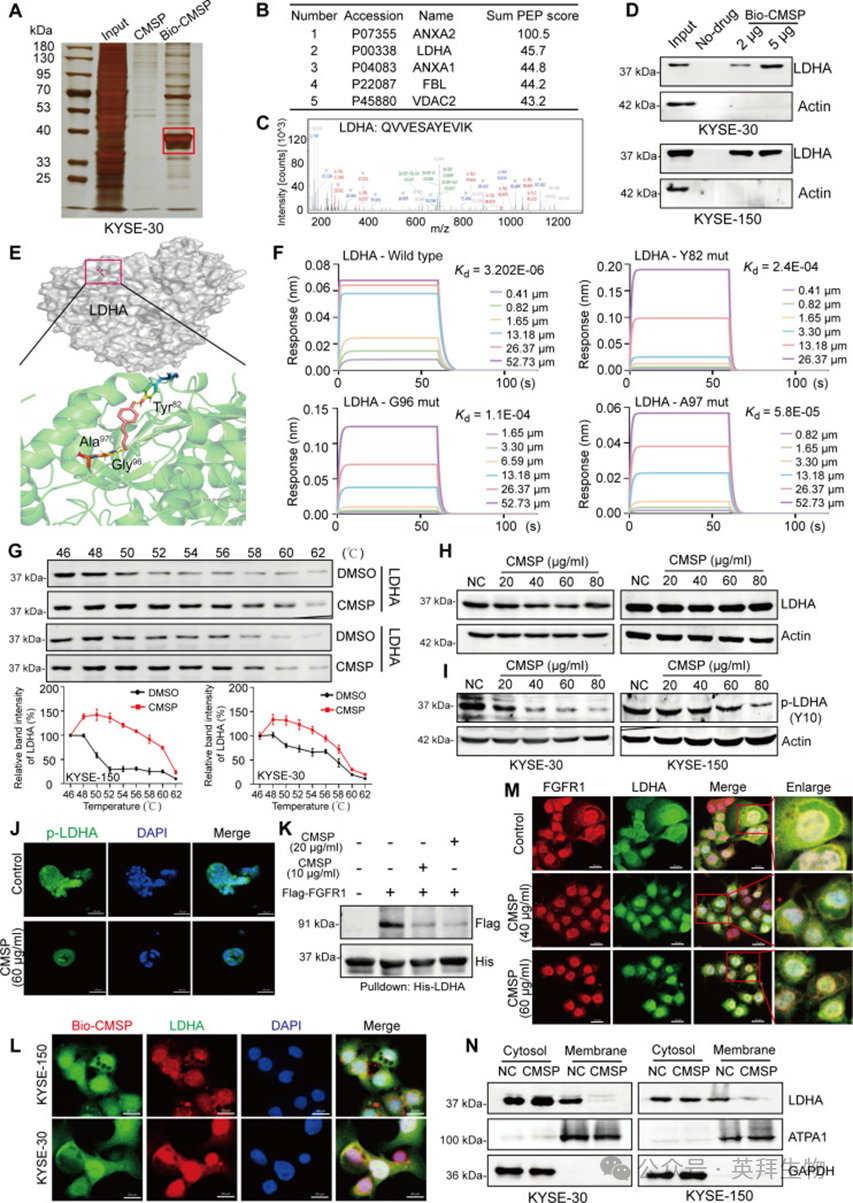
图4:CMSP直接结合LDHA,并通过与FGFR1断开抑制磷酸化
5、CMSP通过阻碍糖酵解介导的溶酶体酸化来抑制自噬
考虑到LDHA在需氧糖酵解中的关键作用,可以假设CMSP与糖酵解酶的相互作用对细胞中的糖酵解代谢通路产生影响。因此,采用靶向代谢组学评估CMSP处理后中心碳代谢物的变化(图5A)。根据结果,CMSP处理下糖酵解途径中涉及的大多数中间产物浓度普遍降低,而与三羧酸(TCA)循环相关的中间产物浓度升高(图5B和图S5A)。随后的分析揭示了ESCC细胞内的乳酸含量。结果显示,CMSP处理后KYSE-30和KYSE-150细胞中的乳酸产生减少(图5C),从而证实CMSP有效抑制ESCC细胞中的糖酵解及随后的乳酸产生。越来越多的发现指出乳酸在促进癌细胞溶酶体酸化和自噬中的作用,意味着CMSP可能通过调节糖酵解代谢产生的乳酸水平来影响自噬活性。吖啶橙(AO)在细胞质结构中显示绿色荧光,在完整的酸性溶酶体环境中显示红色荧光。因此,它可以作为检测溶酶体酸度和完整性变化的指标。相应地,在厄尔平衡盐溶液(EBSS)处理的ESCC细胞(阳性对照)中红色荧光增加,而在暴露于CMSP和CQ(氯喹)的细胞中显著降低(图5D和E),表明CMSP处理后溶酶体pH升高。随后,研究者评估了CMSP处理对溶酶体酶组织蛋白酶B(CTSB)和组织蛋白酶D(CTSD)表达水平的影响,以确定CMSP是否影响溶酶体功能。结果显示,CMSP以剂量依赖性和在指定时间点显著降低了CTSB和CTSD的蛋白表达水平(图5F)。为进一步验证溶酶体功能的特征,用表达GFP-LC3B的ESCC细胞与溶酶体特异性染料LysoTracker染色,以检测自噬体与溶酶体的共定位。作为阳性对照,EBSS饥饿处理显著增强了GFP-LC3B点状聚集与LysoTracker染色亚区的共定位。相比之下,在CMSP或CQ存在下,这种共定位被破坏(图5G和H)。总的来说,这些发现表明CMSP处理通过阻碍溶酶体显著抑制了ESCC细胞中的自噬。
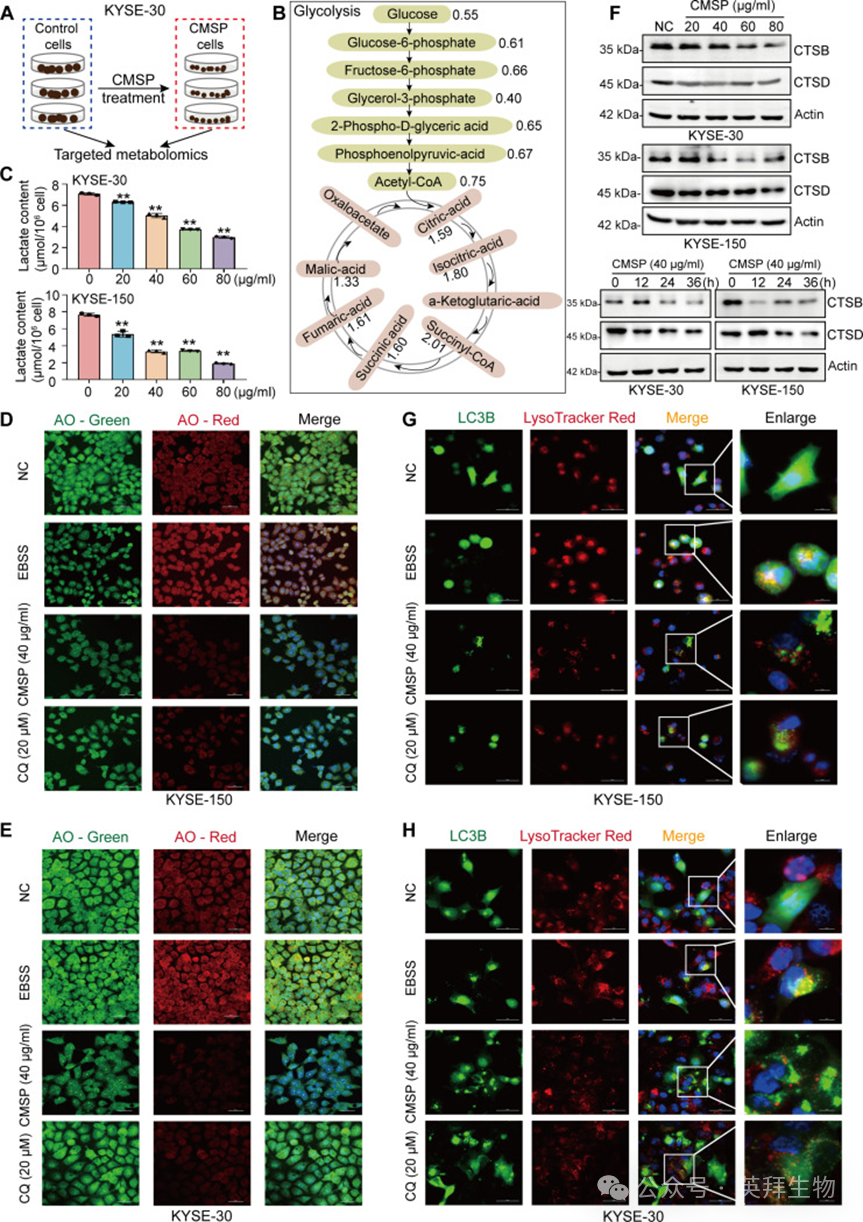
图5:CMSP通过阻碍溶酶体酸化来抑制自噬
6、CMSP降低ESCC细胞中糖酵解调控的AMPK/mTOR通路活性
随后,研究者探索了CMSP通过糖酵解调控抑制自噬的详细分子机制。众所周知,AMPK的激活可抑制mTOR磷酸化,从而启动自噬。此外,AMPK负责调节细胞能量稳态。因此,研究者推断CMSP通过糖酵解介导的AMPK/mTOR通路调控来抑制自噬。首先,研究者的结果表明,CMSP介导的糖酵解抑制和氧化磷酸化增强导致肿瘤细胞中AMP/ATP比率降低和乳酸产生减少(图6A)。此外,CMSP处理有效降低了KYSE-30和KYSE-150细胞中p-AMPK(Thr172)的激活,且呈剂量和时间依赖性。与此一致,p-AMPK的下游靶点p-ULK1表现出类似趋势,而p-mTOR和p-P70S6K的表达水平显著升高(图6B和C)。然而,对AMPK、ULK1、mTOR和P70S6K的整体表达水平未观察到显著影响(图S5B和C)。此外,用雷帕霉素处理逆转了这些蛋白的表达变化,进一步证实CMSP抑制AMPK信号通路(图6D和图S5D)。总的来说,研究者的发现表明CMSP通过糖酵解调控的AMPK/mTOR通路来抑制ESCC细胞中的自噬。
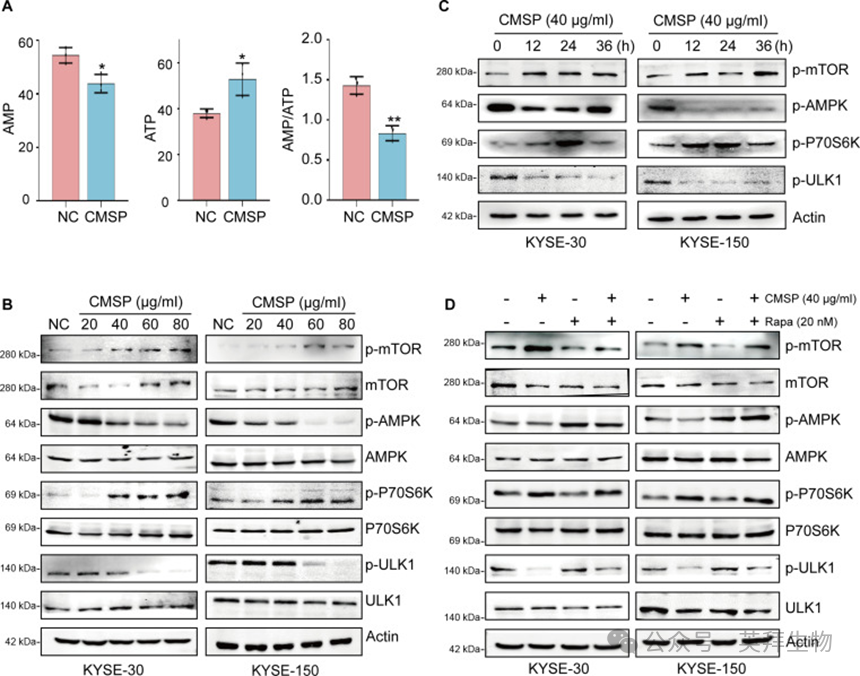
图6:CMSP降低了ESCC细胞中AMPK/mTOR通路活性
7、CMSP抑制自噬,从而在体内诱导ESCC凋亡
上述结果表明CMSP通过抑制细胞自噬来诱导ESCC凋亡。接下来,为研究CMSP在体内的抑制功能,研究者使用BALB/c小鼠建立了ESCC异种移植肿瘤模型(图7A)。经过35天治疗后,与对照组相比,经CMSP(10或30 mg/kg)治疗的异种移植肿瘤在重量和体积上均表现出显著减少,而这种效应被雷帕霉素与CMSP的联合治疗部分逆转(图7B至D),表明CMSP的治疗作用可能通过抑制自噬而发生。随后的TUNEL染色结果显示,在CMSP治疗组中,FITC阳性细胞比例显著增加,表明细胞凋亡。这种效应被雷帕霉素治疗逆转,表明CMSP通过抑制自噬来诱导ESCC凋亡(图7E)。此外,对异种移植肿瘤切片进行了免疫组织化学(IHC)检测,以评估Ki67、LC3B、p62、裂解型caspase-3、p-LDHA和LDHA的表达。经CMSP治疗后,治疗组表现出Ki67水平显著降低,表明癌细胞增殖受到抑制。此外,与对照组相比,CMSP治疗组的肿瘤组织表现出LC3B、p62和裂解型caspase-3表达水平升高,同时p-LDHA表达降低。这些分子改变在CMSP与雷帕霉素联合给药后被逆转。值得注意的是,LDHA的表达保持不变(图7F和G)。这些观察结果与免疫印迹分析获得的结果一致。此外,对异种移植肿瘤切片的透射电镜(TEM)分析显示,CMSP治疗后自噬体发生累积(图7H)。为进一步评估CMSP在体内的潜在毒性,随后进行了实验。结果显示,各组小鼠之间体重没有显著差异(图S6A)。各组之间天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、尿素(UREA)和肌酐(CREA)的血清水平相当(图S6B)。此外,主要器官的hematoxylin和伊红(H&E)分析显示,CMSP组内没有显著的肝脏和肾脏损伤、肺毒性或脾脏炎症浸润(图S6C)。总的来说,这些发现表明CMSP通过在体内抑制自噬有效抑制ESCC进展并诱导凋亡,同时显示出良好的安全性。
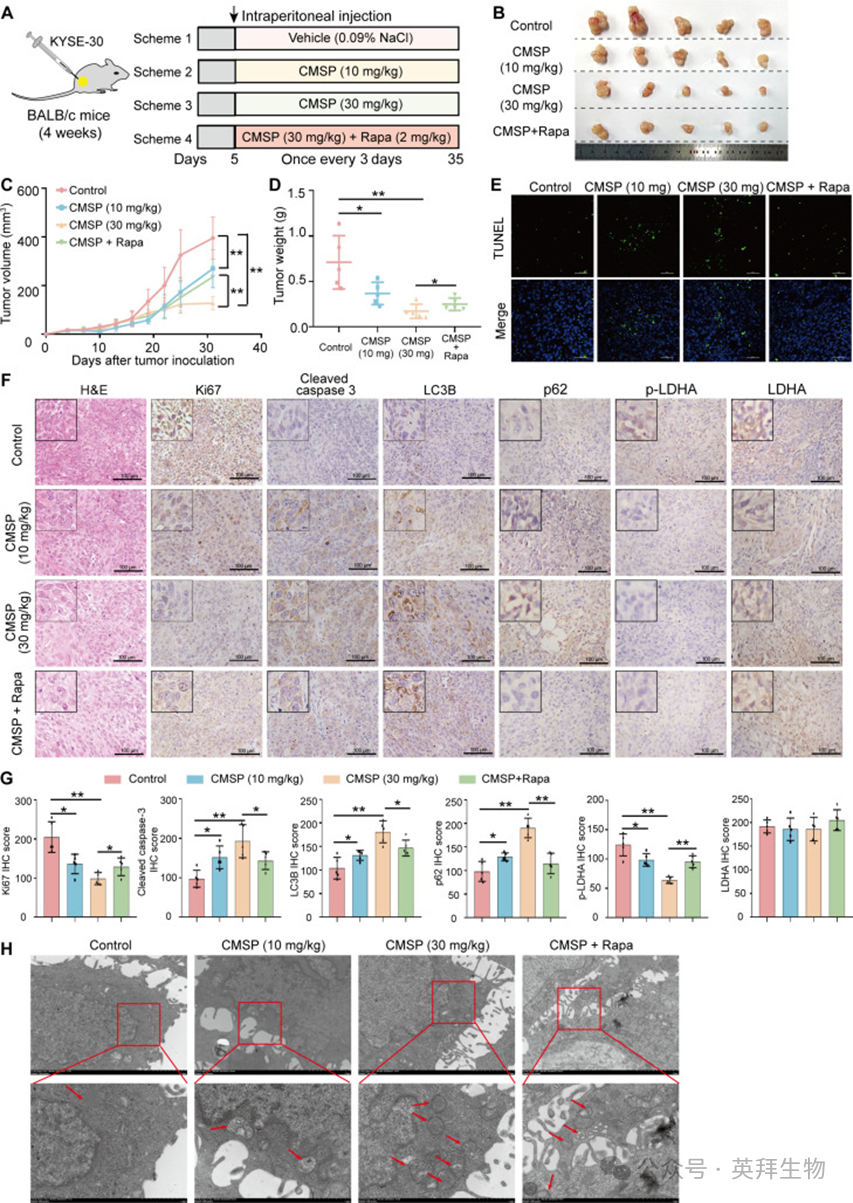
图7:CMSP通过在体内抑制自噬诱导ESCC凋亡
结论:
总之,研究者的研究结果阐明了CMSP、糖酵解、自噬和肿瘤细胞凋亡之间的复杂相互作用。研究者首次证明,CMSP通过与LDHA的相互作用破坏自噬通量,诱导ESCC细胞凋亡。这种相互作用导致糖酵解减少、乳酸产生抑制和AMPK/mTOR通路抑制,从而抑制细胞自噬。研究者的研究结果表明,自噬调节小分子CMSP具有在癌症治疗中作为有效治疗剂的潜力。此外,靶向糖酵解可能提供一种有前景的治疗策略。
参考文献:
Wei S, Wang J, Zhang Z, Fu Y, Zhao L, Bi Y, Li X, Dai S, Zhang C, Zhu W, Min L, Shan B, Zhao L. A Novel Autophagy Inhibitor p-Hydroxylcinnamaldehyde Suppresses Esophageal Squamous Cell Carcinoma by Targeting LDHA Phosphorylation-Mediated Metabolic Reprogramming. Research (Wash D C). 2026 Jan 12;9:1070. doi: 10.34133/research.1070. PMID: 41531896; PMCID: PMC12794202.






