“水凝胶”仿生淋巴结:一招激活免疫,精准狙击肿瘤!
非特异性分布的三级淋巴结(TLS)诱导药物可能引发自身免疫性疾病。我们开发了一种自转化壳聚糖水凝胶(COS),使其作为仿生TLS。将壳聚糖水凝胶溶液注射至小鼠细菌定植肿瘤的肿瘤周围,随后实现快速原位凝胶化。经多柔比星和头孢他啶杀灭肿瘤细胞及肿瘤内细菌后,该水凝胶高效吸附了细菌病原体相关分子模式、肿瘤细胞衍生的损伤相关分子模式及肿瘤相关抗原。这些危险信号显著增强了免疫细胞向水凝胶的招募,并通过吸附DNA介导的cGAS-STING激活充分激活树突状细胞(DCs)。活化的DCs将T细胞转化为细胞毒性T细胞,这些激活的免疫细胞通过水凝胶孔隙迁移至肿瘤组织,有效重塑免疫抑制性微环境,从而抑制肿瘤生长与转移。这些发现揭示了一种全新的安全、易控且高效的仿生肿瘤免疫微环境构建方法,为更新当前针对多种肿瘤的联合免疫疗法提供了前景广阔的策略。该研究于2026年1月发表在《Science Advances》,IF:12.5。
技术路线

主要研究结果:
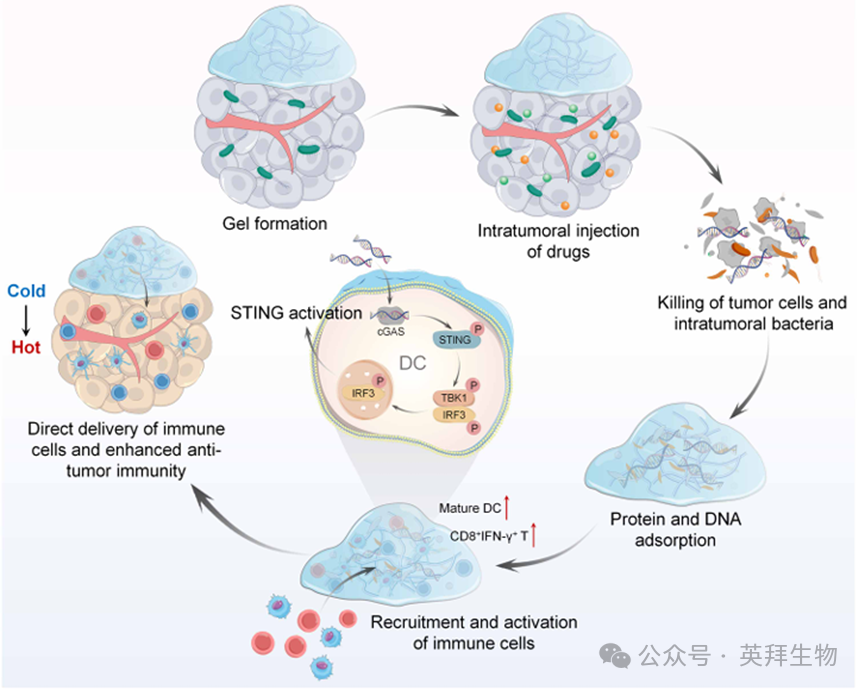
图1.基于水凝胶的TLSs展现出强效的抗肿瘤作用
1.COS的制备与表征
该可控释放水凝胶(COS)通过溶胶-凝胶法制备(图2A)。预水凝胶液体呈现温度依赖性凝胶化行为,在37℃下20分钟内实现稳定凝胶化,而在0℃时保持液态(图2B)。前驱体溶液的可注射性表明其适用于后续体内应用(图2C)。扫描电子显微镜(SEM)图像显示水凝胶具有多孔结构(图2D),有利于免疫细胞招募。通过拉伸测试考察水凝胶的力学性能,发现其最大压缩载荷达4 N,足以维持体内原有形态(图2E)。尽管力学性能中等,该水凝胶在常温(25°C)或冷藏(4°C)条件下仍能维持结构完整性,6周内未见明显降解(图2F)。在BALB/c小鼠体内进行的水凝胶前体溶液凝胶化评估表明:水凝胶植入3天后可在注射部位观察到皮下肿胀,第10天可检测到不规则水凝胶结节(0.5厘米×0.3厘米)(图2G)。此外,对收获的水凝胶结节进行 hematoxylin-伊红(H&E)染色显示,COS的定义佐剂特性促使多种免疫细胞被招募至水凝胶基质中(图2H)。
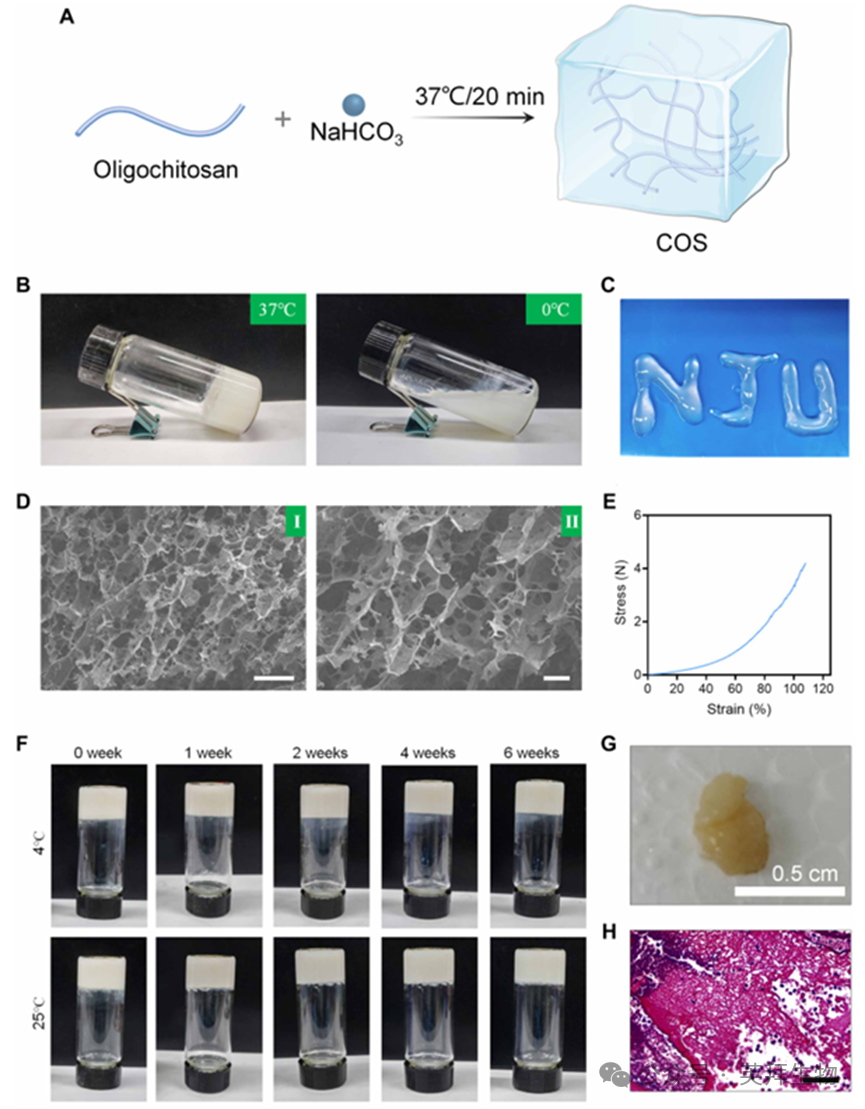
图2.COS的制备与表征
2.基于水凝胶的系统在体外对肿瘤/细菌的杀灭作用及其蛋白质/DNA吸附能力
通过抗生素敏感性试验(表S1),在多种抗生素中筛选出头孢噻肟(CTX)作为对抗大肠杆菌的有效抗生素。结果显示,CTX(50 μg/ml)在12小时共培养后能有效抑制大肠杆菌(图S1)。值得注意的是,即使在100 μg/ml浓度下,CTX对4T1细胞亦未表现出可观测的细胞毒性(图S2)。如预期所示,DOX对4T1细胞呈现浓度依赖性细胞毒性,当DOX浓度为5 μg/ml时,4T1细胞存活率为53.38%(图S3)。最终采用上述药物浓度进行后续实验。
随后,如图3A所示,对不同处理方案进行了抗菌实验。实验结果表明,通过菌落计数法检测发现,经COS处理的细菌对大肠杆菌具有显著的抗菌活性(图3B和D)。DOX(5 μg/ml)同样展现抗菌活性,而联合处理组[COS、CTX与DOX(COS-CTX-DOX)]呈现协同抗菌效应,该结果与OD600(600纳米波长下的光密度)测量数据一致(图3D及图S4)。此外,扫描电子显微镜图像显示,经不同样品处理的大肠杆菌呈现不同程度的结构损伤。其中COS-CTX-DOX处理组的细菌结构破坏最为明显,进一步证实该组合的卓越抗菌活性(图3C)。另通过CCK-8试剂盒评估了各样品对4T1肿瘤细胞的细胞毒性(图3E)。通过CCK-8细胞计数试剂盒检测发现,COS组及COS-CTX组对4T1细胞无明显细胞毒性(图3F)。而经COS-DOX或COS-CTX-DOX处理的肿瘤细胞存活率约为53%。荧光活死细胞染色图像显示,COS及COS-CTX处理未影响4T1细胞存活率(图3G)。相比之下,含DOX的系统(COS-DOX和COS-CTX-DOX)导致4T1细胞内活细胞(绿色)明显减少,死细胞(红色)显著增加。因此,我们推测这些治疗组的细胞毒性主要源于DOX。
在高效杀灭肿瘤细胞和细菌之后,COS对细胞成分和细菌碎片的吸附能力对下游免疫激活至关重要。首先,选择牛血清白蛋白(BSA)作为模型蛋白进行蛋白吸附测试(图3H)。结果发现,BSA可在孵育24小时后被水凝胶有效吸附(图3I)。此外,大量证据表明肿瘤细胞和细菌裂解液中的蛋白质成分同样能被水凝胶充分吸附(图3J)。随后采用牛胸腺DNA作为模型DNA进行吸附实验(图3K),结果显示COS可在4小时内吸附40.6%的DNA(图3L和M)。吸附成分在水凝胶中的空间分布可能影响后续免疫细胞的激活。因此,我们研究了不同分子量组分(荧光素异硫氰酸酯标记多肽、FITC标记牛血清白蛋白及DiR标记细菌/细胞裂解物)在水凝胶基质中的分布情况。荧光图像显示,经4小时共孵育后,这些组分被水凝胶有效吸附(图S5A)。值得注意的是,分子量较小的组分能更快地渗透至水凝胶内部区域,而较大组分的扩散速率则较慢(图S5B至D)。此外,研究还考察了不同吸附组分(牛胸腺DNA、牛血清白蛋白及细菌/细胞裂解物)从水凝胶中的释放行为(图S6A-D)。观察发现这些组分并未被水凝胶静电捕获,部分吸附组分在水凝胶基质中呈游离状态,这有利于免疫细胞对这些组分进行更高效的细胞摄取。水凝胶的这些卓越特性有望为其实现与TLSs相似的免疫功能创造有利条件。
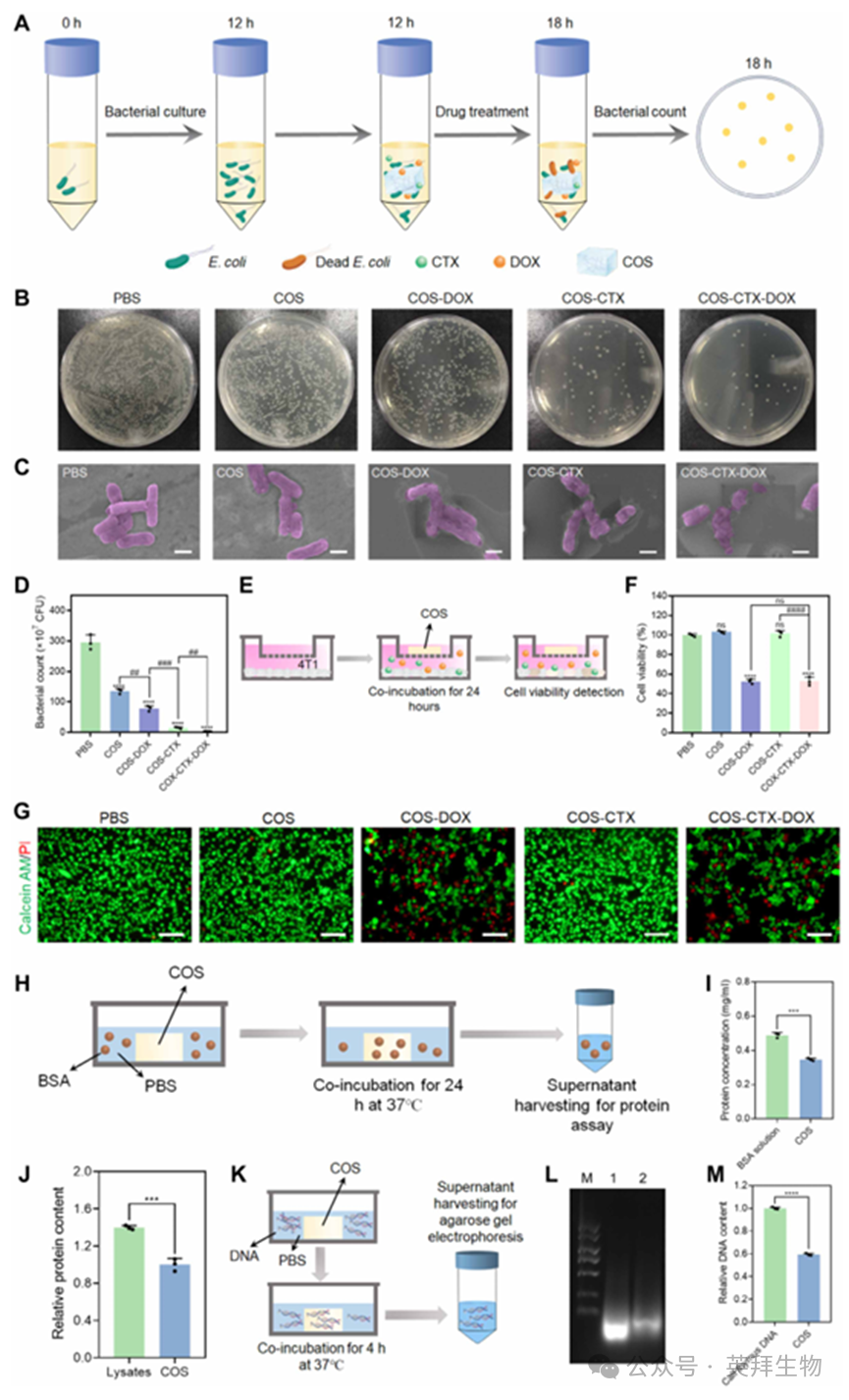
图3.基于水凝胶的系统在体外对肿瘤/细菌的杀灭作用及其蛋白质/DNA吸附能力
3.水凝胶基系统对成熟与细胞迁移的作用
有效的DCs活化对下游抗肿瘤免疫的产生至关重要。因此,本研究探讨了水凝胶系统在吸附细菌和肿瘤细胞裂解物后的DC活化效果(图4A)。将DC2.4细胞用不同水凝胶系统处理24小时后,通过流式细胞术分析这些处理细胞的成熟程度。图4(B和C)结果表明,COS凭借其固有佐剂特性及吸附细菌裂解物产生的刺激信号可增强DC活化——此前研究已证实细菌来源的病原体相关分子模式(PAMPs)能促进DC活化。COS-CTX吸附更多细菌裂解物且杀菌效率更高,该组DC成熟率达17.1%。研究表明化疗杀伤肿瘤细胞后,肿瘤细胞会释放损伤相关分子模式(DAMPs)并暴露肿瘤特异性抗原,而DAMPs已被证实对DC活化具有关键作用。显著的肿瘤及细菌杀伤效应使COS-CTX-DOX组能够吸附大量PAMPs和DAMPs。该组DC成熟率达24.6%,远高于COS-CTX组和COS-DOX组(图4B和C)。研究表明,经DOX杀伤的肿瘤细胞释放的肿瘤DNA可转移至DCs,进而激活DCs中的cGAS-STING通路(38)。鉴于COS具有高效的DNA吸附能力,本研究进一步探讨了不同组别中DC活化的机制。如图4(D和E)所示,经COS处理的DC2.4细胞中,STING激活相关蛋白(p-IRF3、p-TBK1和p-STING)的表达水平较磷酸盐缓冲盐水(PBS)组显著升高,表明除肿瘤DNA外,细菌DNA同样能激活STING信号通路(图4F)。这可能是因为cGAS-STING细胞内DNA感知通路可响应任何外源性DNA。此外,COS-CTX组凭借更强的抗菌效果和更高的细菌DNA吸附量,较COS组进一步促进了cGAS-STING通路的激活。值得注意的是,COS-DOX组相较于COS-CTX组显著增强了STING激活相关蛋白的表达。鉴于COS-DOX的抗菌效果弱于COS-CTX(图3B-D),我们推测肿瘤来源DNA在COS-DOX介导的STING通路激活中起关键作用。此外,该水凝胶体系对肿瘤细胞和细菌的卓越杀伤效果,以及后续的碎片吸附能力,使得COS-CTX-DOX组相较于COS-CTX和COS-DOX组实现了协同增强的STING激活(图4D和E)。总体而言,该水凝胶体系能主动为激活树突状细胞提供必要且有利的条件。此外,我们还分离了骨髓来源的树突状细胞(BMDCs),并研究了不同水凝胶体系对BMDCs中p-STING表达的影响(图S7)。结果发现,该水凝胶系统能通过吸附多种成分有效诱导BMDCs中cGAS-STING通路的激活,我们推测细菌DNA和肿瘤DNA均能高效激活该通路。
免疫细胞从水凝胶向肿瘤组织的成功迁移对产生高效抗肿瘤免疫至关重要。因此,本研究选用DC2.4细胞作为模型细胞,以探究免疫细胞在水凝胶中的迁移行为(图4G)。将分散于20μl PBS溶液中的树突状细胞(5×10⁵)精心植入水凝胶中。随后于细胞植入后0、4、8小时通过显微镜检测水凝胶内DCs的迁移行为。结果显示:植入后0小时水凝胶周边及稍远处均未见细胞踪迹,表明植入细胞未发生直接渗漏(图4H)。此外,植入4小时后,DCs逐渐从水凝胶向培养基迁移。值得注意的是,部分细胞沉积于细胞培养瓶底部(图4H及图S8),部分悬浮于培养基中,表明水凝胶内的细胞迁移为持续性过程。随着观察时间的延长,从水凝胶中迁移的细胞数量持续增加。其中大部分细胞已附着于底部,并呈现出树突状细胞的特征形态。最终在细胞迁移实验结束时,还检测了水凝胶中迁移DCs的细胞活力。荧光图像及荧光强度定量分析表明,绝大多数迁移出的DCs保持良好活性(绿色)(图4I及图S9),这对免疫细胞发挥特异性免疫功能至关重要。综上所述,该水凝胶体系巧妙地为实现DC活化与维持细胞活力创造了优越条件,为其发展成为高质量仿生TLS奠定了坚实基础。
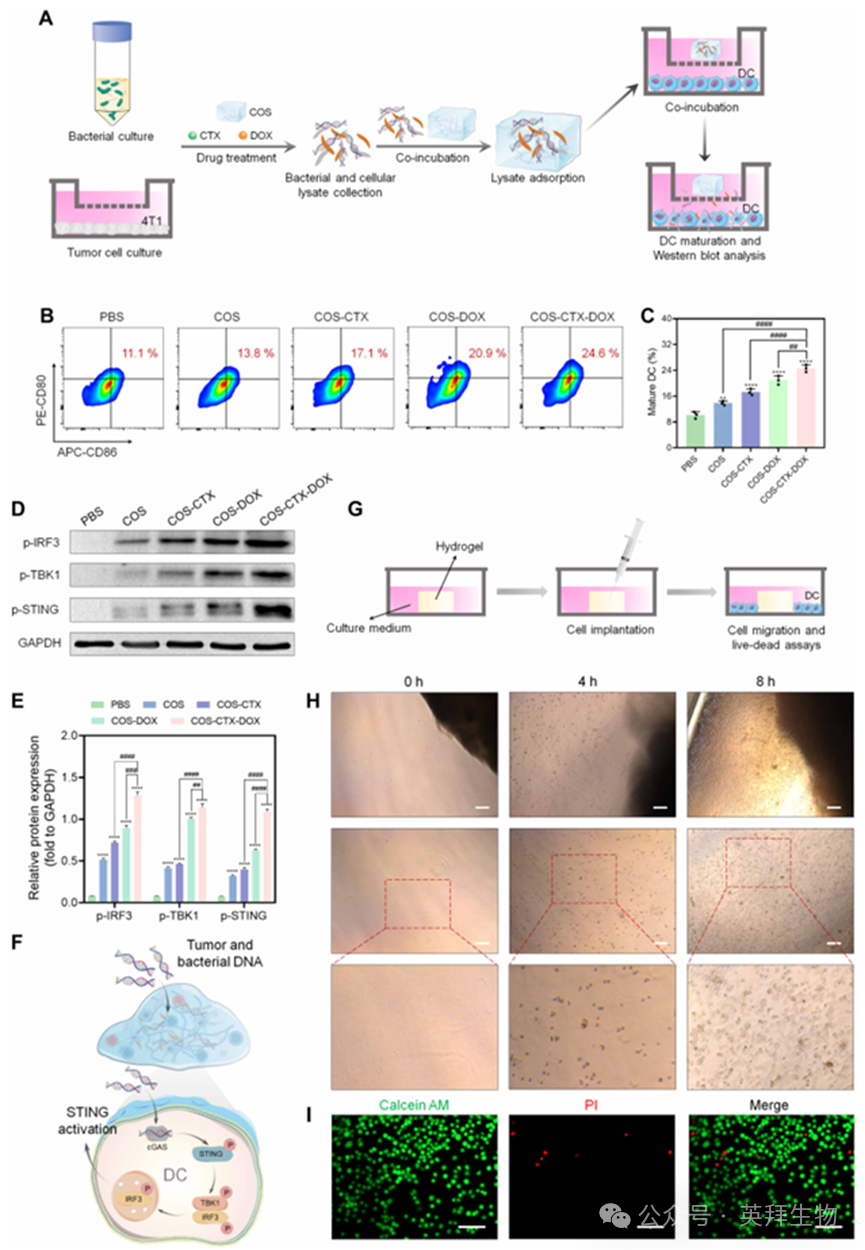
图4.水凝胶基系统在DC成熟及细胞迁移性能中的作用
4.基于水凝胶的仿生TLS在体内的形成
为探究水凝胶基系统能否在体内形成仿生TLS并发挥相应抗肿瘤效应,开展了详细研究(图5A)。图5B图像显示水凝胶系统原位形成于肿瘤组织附近。此外,不同治疗组小鼠体内收获的水凝胶结节的H&E染色图像表明,这些水凝胶系统能有效招募不同细胞。值得注意的是,COS-DOX和COS-CTX-DOX治疗组的水凝胶结节招募的细胞数量显著多于COS和COS-CTX组,这可能是因为COS-DOX和COS-CTX-DOX组的水凝胶结节吸收了更多危险信号,从而增强了COS固有的佐剂特性(图5C)。
为进一步鉴定水凝胶结节内的细胞类型,从COS-CTX-DOX治疗组小鼠体内分离出水凝胶结节,经切片处理后进行免疫荧光染色。免疫荧光图像显示,水凝胶结节内存在多种免疫细胞,包括DCs(红色)、T细胞(绿色)、B细胞(青色)、巨噬细胞(黄色)和中性粒细胞(灰色)(图5D),这些细胞类型基本涵盖了TLS中发现的免疫细胞谱系。此外,Ki67染色的免疫荧光图像表明这些免疫细胞具有良好的增殖能力(图5E),该结果表明水凝胶基质为免疫细胞的增殖和分化提供了理想环境,同时也暗示这种基于水凝胶的仿生TLS可能代表一种成熟表型。
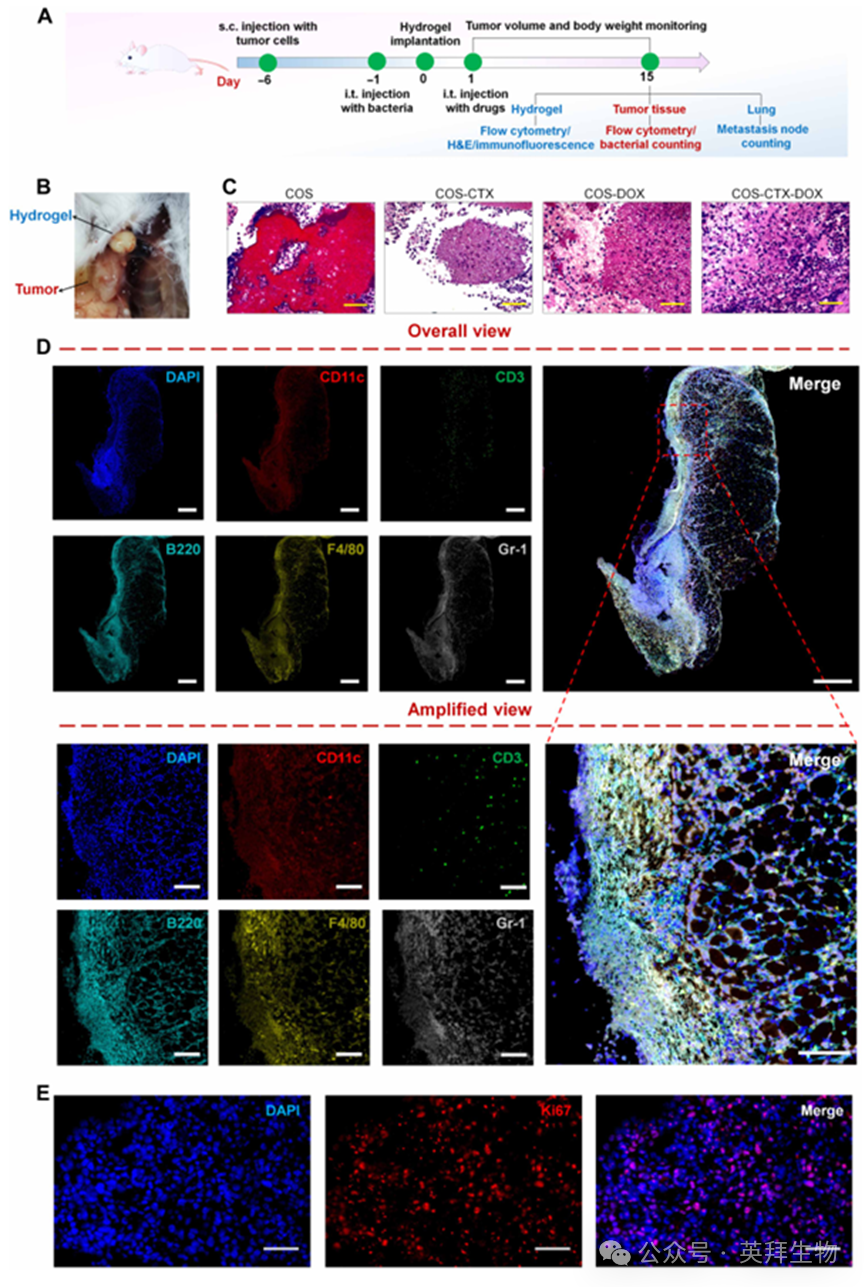
图5.基于水凝胶的仿生TLS在体内的形成
5.COS-CTX-DOX的抗肿瘤免疫反应
通过流式细胞术进一步评估了基于水凝胶的仿生TLS的抗肿瘤免疫应答。图6(A和B)的流式分析结果表明,吸附在水凝胶结节中的DAMPs和PAMPs能增强对树突状细胞的激活作用。COS-CTX-DOX组水凝胶结节中招募的DC成熟率高达50.7%,约为COS组的3.3倍。令人意外的是,这些活化的DCs能在水凝胶中直接激活初始T细胞转化为CTLs,而COS-CTX-DOX组因其卓越的DC活化能力,其T细胞免疫应答表现出显著优势(图6C和D)。考虑到基于水凝胶的仿生TLS中的免疫细胞表现出良好的增殖活性(图5E),COS-CTX-DOX卓越的免疫细胞激活能力使其成为一种优秀的仿生TLS。此外,该仿生TLS富含成熟DC和活化T细胞,其特征与成熟肿瘤相关TLS高度相似。因此,该仿生TLS有望发挥与成熟肿瘤相关TLS相似的功能。
与此同时,进一步探索了肿瘤组织中的抗肿瘤免疫反应。在COS-CTX-DOX治疗组小鼠的肿瘤组织中,高达26.9%的活化树突状细胞和16.1%的细胞毒性T淋巴细胞成功浸润(图6E和G)。总体而言,各治疗组肿瘤组织中的免疫应答效果与其对应水凝胶结节中的效果相似(图6B、D、F和H),这表明水凝胶结节中的活化免疫细胞能够直接浸润至肿瘤组织。此外,观察到COS-DOX或COS-CTX-DOX处理组小鼠血清中白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平显著升高(图6I和J),而IL-10和转化生长因子-β1 (TGF-β1)的生成水平则出现明显下降(图6K和L)。总体而言,这种基于水凝胶的仿生TLS在形成位置、细胞组成和免疫功能方面与肿瘤相关的成熟TLS具有相似性。它能够有效缓解肿瘤免疫抑制性微环境,将免疫抑制性“冷”肿瘤转化为免疫活性“热”肿瘤。
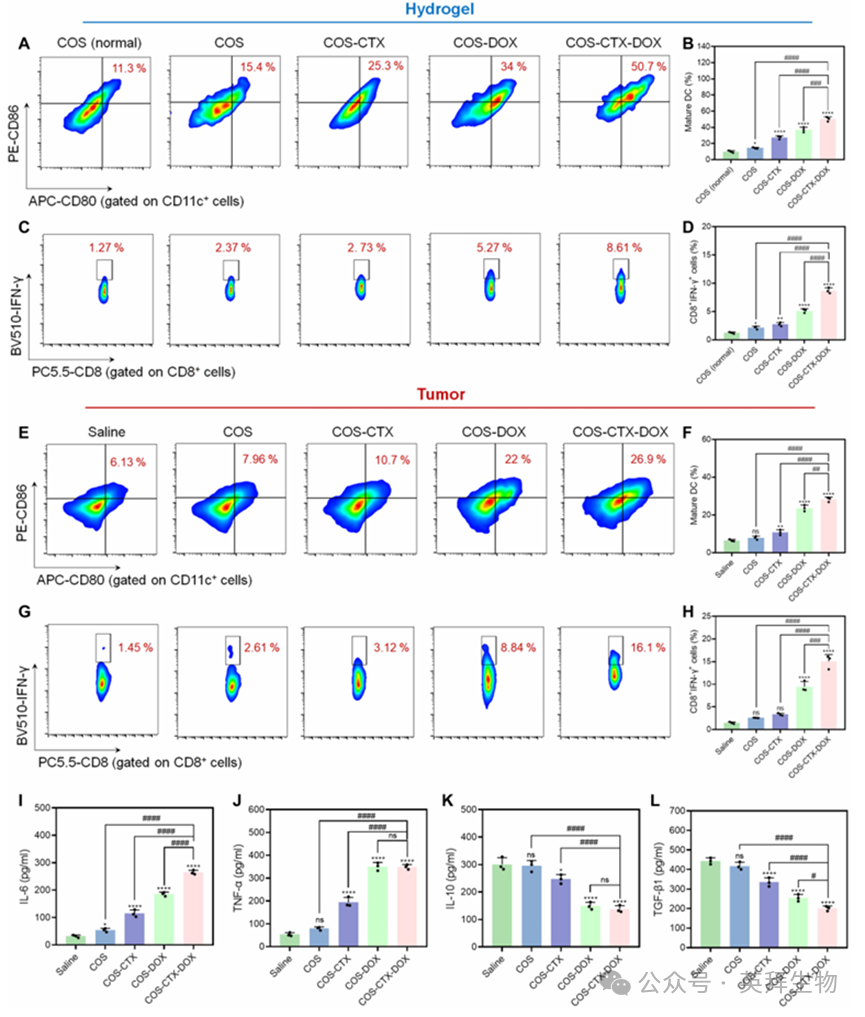
图6.COS-CTX-DOX的抗肿瘤免疫反应
6.COS-CTX-DOX的体内抗肿瘤效应及其生物相容性
除不同组别的抗肿瘤免疫反应外,还研究了各组在治疗期间的抗菌与抗肿瘤效果。COS-CTX-DOX组对肿瘤内大肠杆菌展现出最佳杀灭效率(图7A和B),且各组的体内抗菌效果总体与体外抗菌实验结果(图3D)一致。治疗结束时收获的肿瘤图像及体积曲线表明,COS组未能实现显著的肿瘤抑制(图7C、D及图S10),这表明充分暴露肿瘤抗原并辅以其他免疫刺激成分,是COS发挥有效抗肿瘤免疫作用的必要条件。COS-CTX组对肿瘤生长呈现可观抑制效果,该组分离肿瘤组织体积较生理盐水组减少近两倍,这归因于细菌杀灭介导的免疫抑制性微环境改善(图7D)。此外,COS-DOX和COS-CTX-DOX治疗组通过其主导性抗肿瘤免疫反应,较COS-CTX组展现出更高效的肿瘤生长抑制效果。其中COS-DOX组肿瘤体积较初始阶段略有增加,而COS-CTX-DOX组肿瘤体积甚至小于初始阶段(图7D)。此外,不同组别收集的肿瘤组织H&E染色图像表明,COS-CTX-DOX能有效杀灭肿瘤细胞并破坏肿瘤组织(图7J)。同时,其强大的免疫监测效应赋予了该药物显著抑制4T1肿瘤肺转移的能力(图7F和H)。如图7E所示,所有治疗组小鼠在治疗期间体重均缓慢增长,表明这些治疗方案具有良好安全性。因此,进一步评估了COX-CTX-DOX组的生物相容性。治疗1个月后,从接受COS-CTX-DOX治疗的小鼠体内采集主要器官(心脏、肝脏、脾脏、肺和肾脏)及血液样本进行深入分析。结果显示COS-CTX-DOX组小鼠器官未见明显病变(图7I)。此外,血液生化分析也表明,接受COS-CTX-DOX治疗后小鼠的肝肾功能均处于正常水平(图S11)。
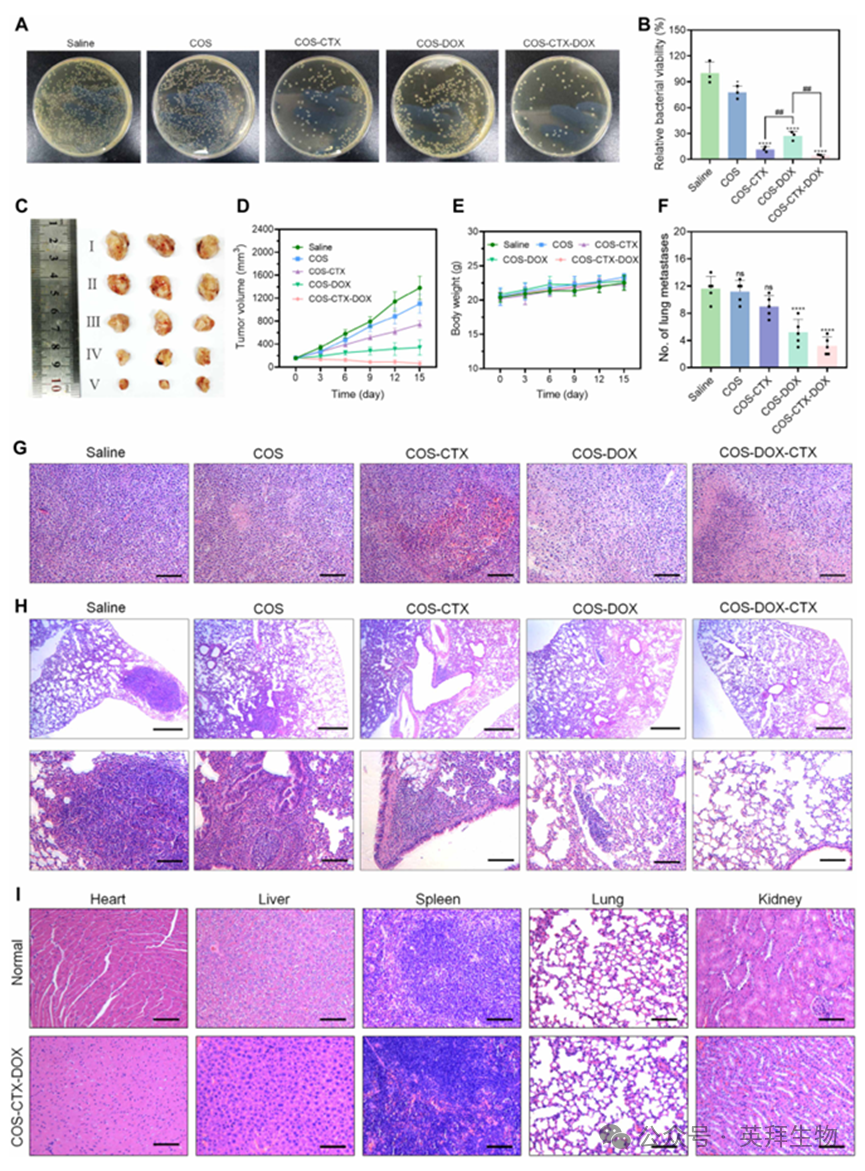
图7.COS-CTX-DOX的体内抗肿瘤效应及其生物相容性
7.COS的体内降解及其长期安全性
水凝胶系统的体内降解特性及其长期安全性对其潜在应用至关重要。因此,本研究评估了植入小鼠体内的COS水凝胶的降解行为及其长期安全性表现。图8A所示图像表明,植入的水凝胶在第2至第4周期间保持了原始结构。值得注意的是,到第五周末水凝胶结节结构转变为不规则形态,至第六周观察结束时植入的水凝胶结节几乎完全消失。第七周末小鼠黏膜表面未见水凝胶结节残留,表明水凝胶结节可在7周内完全降解。这种降解特性凸显了水凝胶系统在潜在实际应用中的便利性,因植入的水凝胶无需通过手术移除。同时,在植入COS的小鼠体内检测到促炎细胞因子IL-6和TNF-α水平升高(图S12),这可能归因于COS固有的佐剂特性。值得注意的是,对小鼠主要器官进行的H&E染色图像显示,在植入的水凝胶完全降解前未观察到病理变化或炎性细胞浸润(图8B),这为基于水凝胶的仿生TLS潜在实用应用提供了依据。
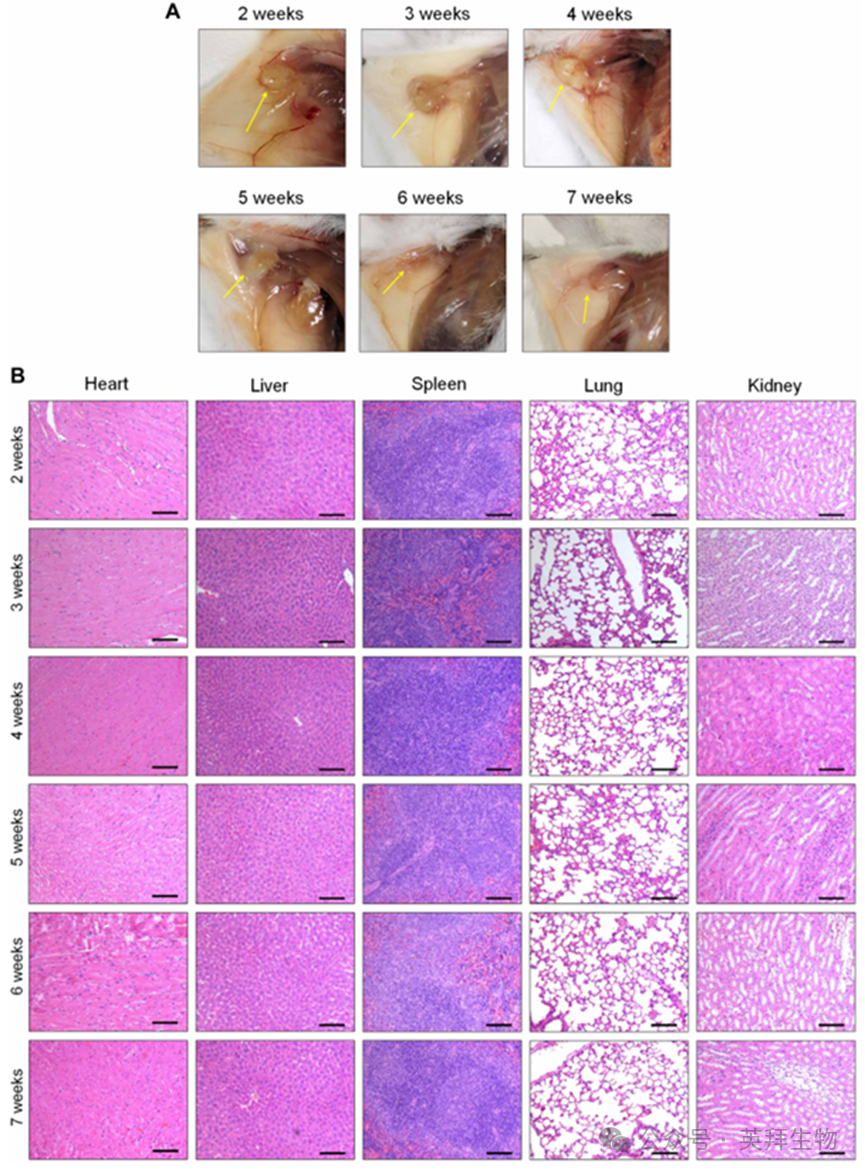
图8.COS的体内降解及其长期安全性
结论
综上所述,我们为更新当前基于TLS的抗肿瘤免疫疗法提供了新的视角和有前景的策略,同时也为改善免疫疗法的临床疗效提供了极具吸引力的选择方案。
参考文献
Wang F, Zeng Y, Yan M, Zhou Z, Feng L, Yang F, Zhao W, Hu Y. Self-transforming hydrogel mimicking tertiary lymph nodes to activate cGAS-STING pathway for enhanced antitumor immunotherapy. Sci Adv. 2026 Jan 9;12(2):eadz5078. doi: 10.1126/sciadv.adz5078. Epub 2026 Jan 9. PMID: 41512068; PMCID: PMC12787580.






