ERβ介导的circATP2B1和miR-204-3p信号轴促进透明细胞肾细胞癌侵袭
ERβ介导的circATP2B1和miR-204-3p信号轴促进透明细胞肾细胞癌侵袭
研究表明,雌激素受体β(ERβ)可影响透明细胞肾细胞癌(ccRCC)的进展。 然而,ERβ调节ccRCC进展的详细机制仍有待进一步阐明。近日,河北医科大学第二附属医院王晓路院长团队发表在《Cancer Research》 (IF=9.122)上的文章《ERβ-mediated alteration of circATP2B1 and miR-204-3p signaling promotes invasion of clear cell renal cell carcinoma》报告了ERβ介导的ccRCC进展的机制细节。他们发现,ERβ通过抑制circATP2B1的表达及通过直接结合其宿主基因ATP2B1的启动子区域增加ccRCC细胞侵袭。ERβ抑制circATP2B1表达导致miR-204-3p表达降低,纤连蛋白1(FN1)表达升高,进一步增强ccRCC细胞侵袭。在ccRCC小鼠模型中用shRNA靶向抑制ERβ或过表达circATP2B1可以部分逆转这一增强作用。作者还通过TCGA数据库中ccRCC患者生存数据表明,ERβ和FN1高表达患者的总体生存率更差,而miR-204-3p高表达患者的总体生存率更高。以上研究结果表明ERβ通过改变ERβ/ circATP2B1 / miR-204-3p / FN1轴的表达促进ccRCC细胞侵袭。
技术路线:
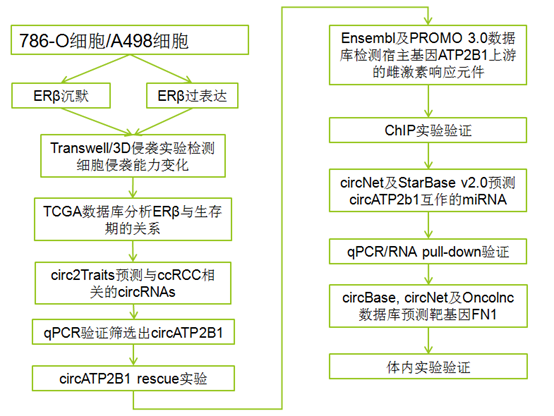
研究结果:
1. ERβ 促进ccRCC细胞侵袭
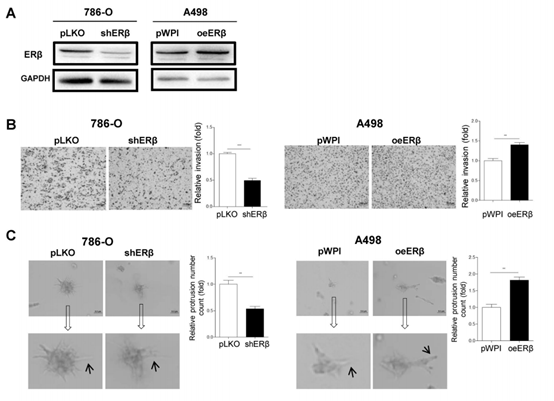
图1(A)Western blot方法验证786-O细胞中敲低的ERβ(左)和A498细胞中ERβ的过表达(右)。(B)使用ERβ-shRNA和pLKO转染的786-O细胞(左2张图像)和用ERβ-cDNA和pWPI转染的A498细胞进行腔室 - transwell侵袭测定。(C)使用ERβ-shRNA和pLKO转染的786-O细胞(左2张图像)和用ERβ-cDNA和pWPI转染的A498细胞进行3D侵袭实验。
2. 高表达的ERβ与ccRC预后差相关
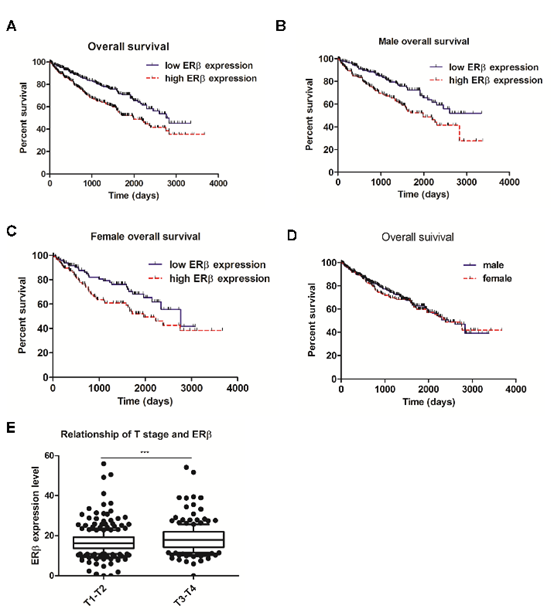
图2(A)基于TCGA数据库的分析表明较高水平的ERβ与较差的存活率有关。(B-C)生存曲线显示较高水平的ERβ与男性及女性RCC患者的生存率较低相关。(D)总生存率在男性和女性RCC患者中无显著性差异。(E)基于TCGA数据库的T分期分析显示,RCC组织高ERβ水平与更高的癌症分期相关。
3. ERβ通过调节circATP2B1表达增强RCC细胞侵袭
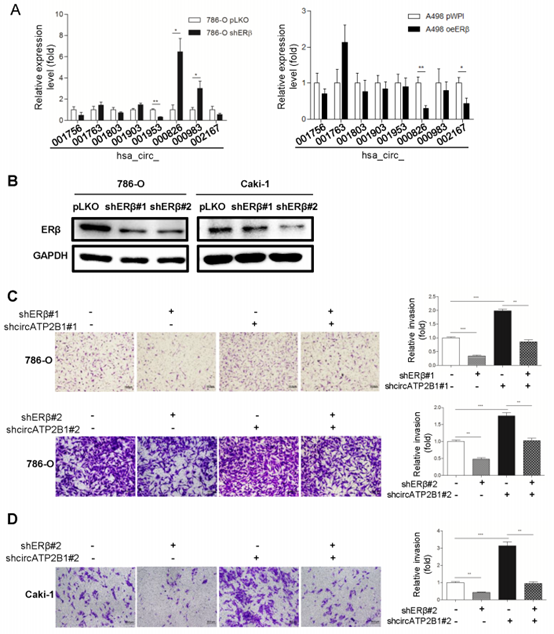
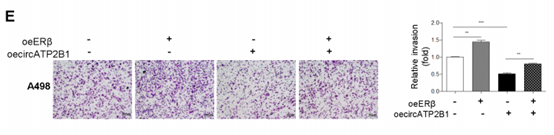
图3(A)在敲减ERβ(shERβ)及空载对照(pLKO)的786-O细胞以及过表达ERβ及空载对照(pWPI)的A498细胞中采用Real-time PCR筛选一组与ccRCC相关的circRNAs。(B)Western blot在786-O细胞及Caki-1细胞验证shERβ#1及shERβ#2的敲减效果。(C)转染或未转染shERβ#1/shcircATP2B1#1或shERβ#2/shcircATP2B1#2的786-O细胞的腔室 - transwell侵袭实验。(D)转染pLKO+pLVTHM, shERβ#2+pLVTHM, pLKO+shcircATP2B1#2, 或 shERβ#2+shcircATP2B1#2的Caki-1细胞的腔室-transwell侵袭实验。(E)过表达ERβ (oeERβ)或过表达circATP2B1(oecircATP2B1)的A498细胞的腔室-侵袭实验。
4. ERβ调节circATP2B1表达的机制解读
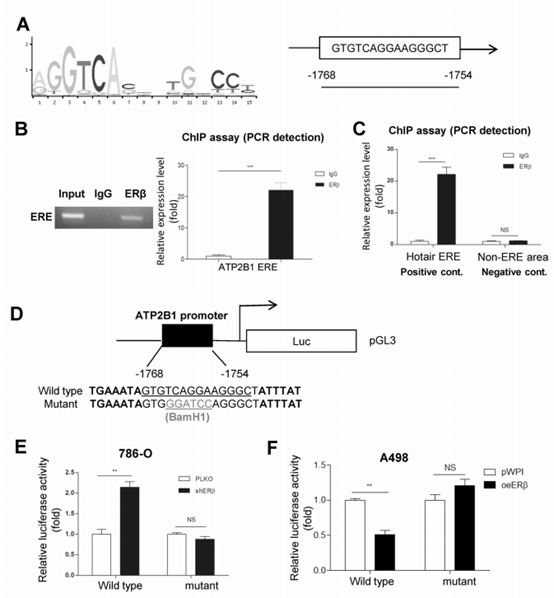
图4 (A)在ATP2B1上游2kb启动子区域存在一个雌激素响应元件(ERE)。(B)ChiP pull-down验证ERβ可以与推测的ERE结合。(C)lncRNA Hotair 启动子ERE作为阳性对照,以及距APT2B1 ERE上游约500bp的(-2268nt 到-2254nt)区间作为阴性对照做ChiP分析。(D-F)双荧光素酶报告基因实验验证ATP2B1启动子ERE与ERβ的结合。
5. ERβ通过改变circATP2B1 / miR-204-3p增强RCC细胞侵袭

图5(A)qPCR检测在A498细胞中敲除或过表达ERβ或circATP2B1后,miRNA的表达变化。(B)RNA pull-down分析检测circATP2B1与miRNA的结合。(C)786-O挽救实验结果显示sh-circATP2B1可以逆转ERβ敲减后引起的miR-204-3p的表达水平升高。(D)挽救实验结果显示oecircATP2B1可以逆转ERβ过表达后引起的miR-204-3p的表达水平降低。(E)circATP2B1影响miRNA-204-3p的稳定性。(F)腔室-transwell侵袭实验和3D侵袭实验分析786-O细胞转染pLKO+Ctl, shERβ#1+Ctl, pLKO+miR-204-3p inhibitor, 或shERβ#1+miR-204-3p inhibitor后的细胞侵袭情况.(G)腔室-transwell侵袭实验和3D侵袭实验分析转染pWPI+pLVTHM, oeERβ+pLVTHM, pWPI+oemiR-204-3p, oeERβ+oemiR-204-3p后A498细胞的侵袭情况。
6. ERβ-circATP2B1-miR204-3p通过改变FN1信号促进ccRCC侵袭
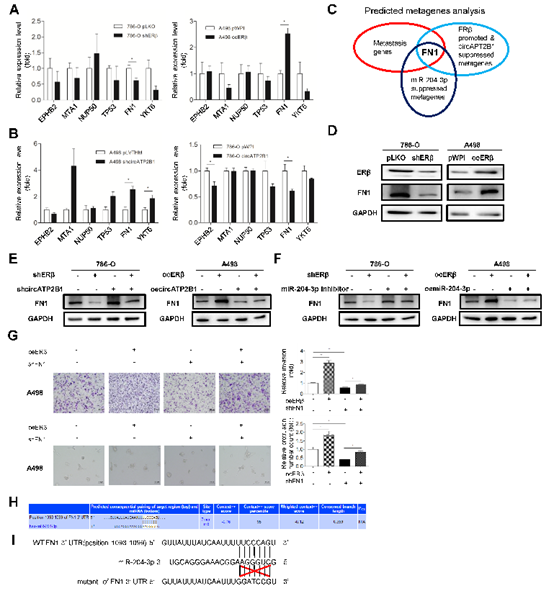


图6(A)qRT-PCR分析筛选786-O细胞中与ccRCC转移相关基因。(B)qRT-PCR分析筛选A498细胞中与ccRCC转移相关基因。(C)图表展示FN1可能是受ERβ、circATP2B1和miR-204-3p调控的RCC转移相关的基因。(D)ERβ可以上调786-O和A498细胞中FN1的表达。(E)Western blot分析分别转染pLKO+pLVTHM, shERβ#1+pLVTHM, pLKO+shcircATP2B1#1, 或 shERβ#1+shcircATP2B1#1的786-O细胞及转染pWPI+pWPI, oeERβ+pWPI, pWPI+oecircATP2B1, or oeERβ+oecircATP2B1的A498细胞的FN1的表达水平。(F)Western blot分析分别转染pLKO+Ctrl, shERβ#1+Ctrl, pLKO+miR-204-3p inhibitor, 或 shERβ#1+miR-204-3p inhibitor的786-O细胞及转染pWPI+pLVTHM, oeERβ+pLVTHM, pWPI+oemiR-204-3p, or oeERβ+oemiR-204-3p的A498细胞的FN1的表达水平。(G)腔室-transwell分析及3D侵袭实验分析786-O细胞转染pWPI+pLVTHM, oeERβ+pLVTHM, pWPI+shFN1, oe ERβ +shFN1后细胞侵袭情况。(H-J)数据库预测的FN1 3’UTR与miR-204-3p靶向结合并通过双荧光素酶报告基因验证。(K) 生存曲线验证高表达miR-204-3p的ccRCC患者总生存期较长。(L)具有高表达FN1的RCC患者预后较差。
7. 体内小鼠研究证实ERβ通过调节circATP2B1促进RCC转移
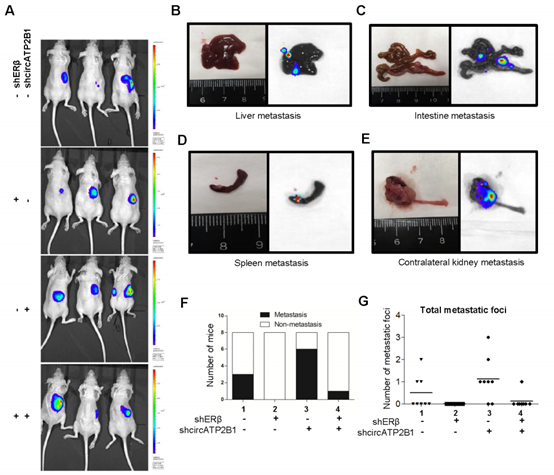
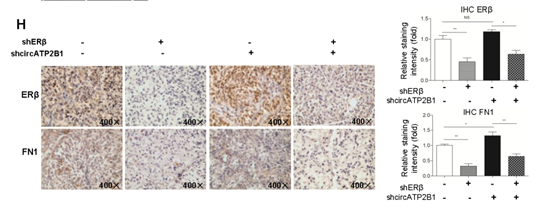
图7 (A)IVIS图像分析发现小鼠原位肿瘤模型出现远端转移。(B-E)肝、小肠、脾和左肾发现转移。(F)转移定量。(G)转移点定量。(H)IHC染色分析ERβ和FN1的表达。






