lncRNA OCC-1通过破坏HuR蛋白的稳定抑制结直肠癌细胞的生长[1]
OCC-1是结直肠癌中最早注释的lncRNA之一。然而,它的功能在很大程度上仍不为人所知。四川大学的研究人员研究发现OCC-1在结直肠癌中发挥致癌作用。在体内和体外试验中,敲除OCC-1可促进细胞生长,这在很大程度上是由于其抑制G0到G1和G1到S期细胞周期转变的能力。此外,过表达OCC-1可以抑制OCC-1敲除细胞的生长。癌症相关的RNA结合蛋白HuR (ELAVL1)可以结合并稳定成千上万的mRNA。OCC-1通过与HuR结合并破坏其稳定性而发挥作用。OCC-1增强了泛素E3连接酶β-TrCP1与HuR的结合,使HuR易受泛素化和降解的影响,从而降低HuR及其靶mRNA(包括与癌症癌细胞生长直接相关的mRNA)的表达水平。这些发现揭示了lncRNA OCC-1可以通过调节RNA结合蛋白HuR的稳定性,在转录后水平上调节大量mRNA的表达水平。
研究路线图:
研究结果:
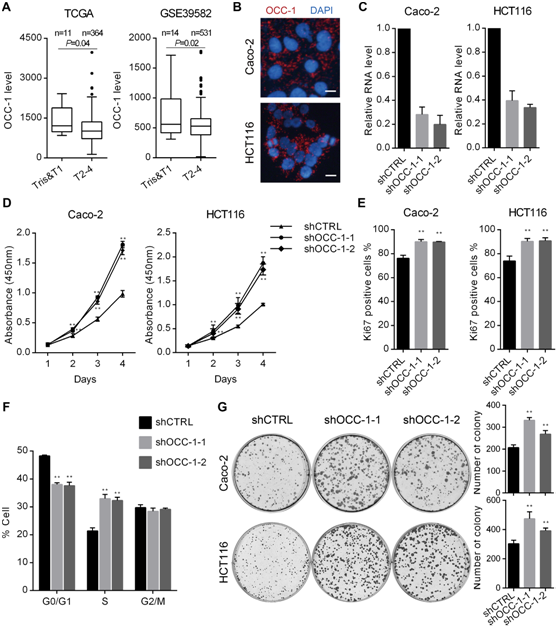
图1 OCC-1在结直肠癌中发挥致癌作用。(A)对两组独立的临床样本基因表达数据进行分析,发现在结直肠癌晚期肿瘤(T)期,OCC-1表达显著下调。(B) RNA FISH发现OCC-1在Caco-2和HCT116细胞中主要分布于细胞质。(C) RT-qPCR分析显示,在Caco-2和HCT116细胞中两个独立的shRNAs(RNA干扰片段)可有效降低OCC-1 RNA的水平。(D) CCK-8检测显示,在Caco-2和HCT116细胞中,OCC-1被敲除后细胞增殖显著增加。(E) Ki67染色显示,OCC-1敲除细胞中Ki67阳性增殖细胞的比例明显高于对照组。(F) FACS分析显示OCC-1敲除后,Caco-2细胞的细胞周期分布情况。(G)菌落形成实验表明,OCC-1敲除细胞比对照细胞形成更多的菌落。
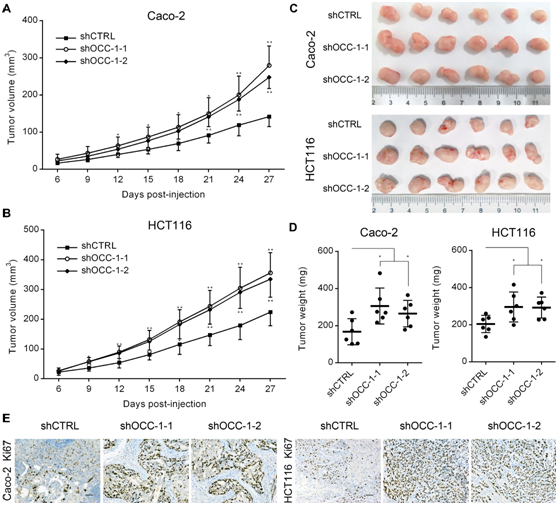
图2体内敲除OCC-1促进结直肠癌细胞的生长。通过皮下注射OCC-1敲除细胞到BALB/c裸鼠的两翼,进行成瘤实验研究。
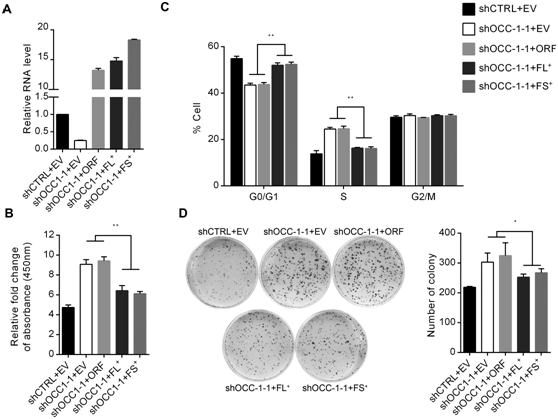
图3在OCC-1敲除的细胞中过表达OCC-1抑制细胞生长。
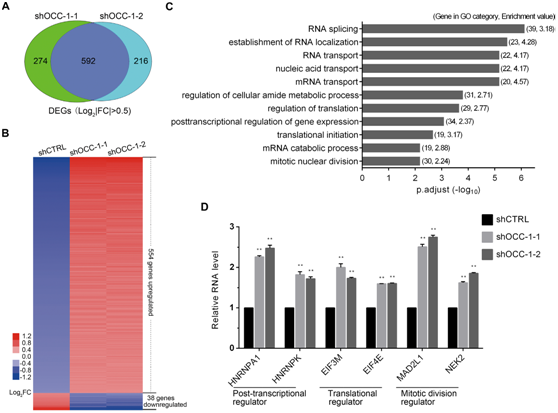
图4在Caco-2细胞系中,敲除OCC-1增加细胞生长相关基因的表达。
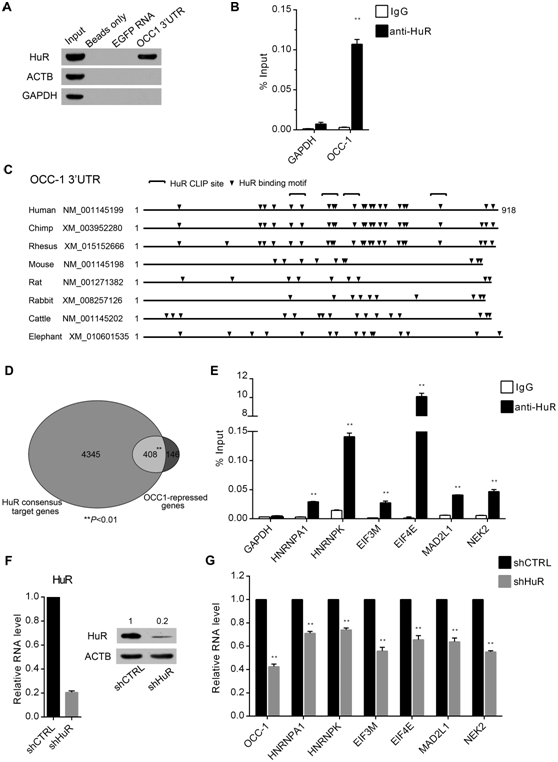
图5OCC-1和HuR蛋白的作用关系。(A) RNA pull-down实验和western blot证实HuR作为蛋白伴侣特异性结合OCC-1 3’UTR。EGFP RNA为RNA对照。ACTB和GAPDH是蛋白质对照。(B) RIP证实OCC-1与HuR在Caco-2细胞中的关系。GAPDH mRNA被用作non-HuR靶基因对照。(C) OCC-1型矫形器3’UTR的示意图显示了HuR的结合motifs。(D)维恩图展示了OCC-1抑制基因显著富集于早前的CLIP实验确定的HuR靶基因集合中。大约74%的OCC-1抑制基因在芯片分析中也是HuR靶基因。(E) RIP实验显示,6个被选中的OCC-1抑制基因Caco-2细胞中也与HuR发生了相互作用。(F) RT-qPCR(左)和western blot(右)结果显示靶向HuR的干扰片段显著降低HuR的mRNA和蛋白表达水平。(G) RT-qPCR分析显示,敲除HuR后,OCC-1和6个被选择的OCC-1抑制基因的表达都下调。
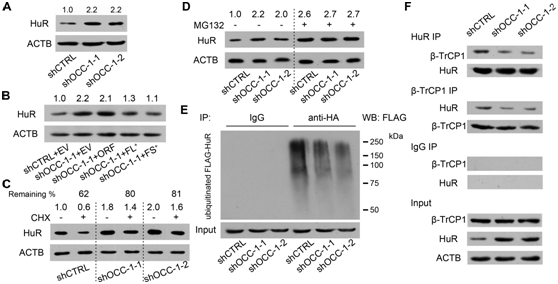
图6 OCC-1通过增强HuR与泛素E3连接酶β-TrCP1的结合,促进HuR的泛素化和降解。
1. Lan, Y., et al., Long noncoding RNA OCC-1 suppresses cell growth through destabilizing HuR protein in colorectal cancer. Nucleic Acids Res, 2018. 46(11): p. 5809-5821. (IF=11.561)






