S期富集lncRNA的泛癌分析可鉴定致癌因子和生物标志物
尽管近年来的研究使我们对长非编码RNA (lncRNAs)在癌症中的作用有了初步的了解,目前还没有找到与临床相关的lncRNA。2018年2月末,来自瑞典萨尔格学院的由医学生物化学和细胞生物学教授Chandrasekhar Kanduri领导的团队在Nature Communications(IF= 12.353)上发表了题为“PAN-cancer analysis of S-phase enriched lncRNAs identifies oncogenic drivers and biomarkers”的新成果。研究人员通过降低一种特定RNA分子的活性治疗患肺癌的小鼠,治愈率达到40%至50%。
该研究提供了一个基于S期相关的lncRNA中具有潜在预后价值的致癌因子或肿瘤标志物的综合性列表。本文利用新生RNA的捕获测序技术,鉴定了1145个在S期表达丰富的lncRNAs。其中,通过与TCGA数据库交叉分析筛选出至少在一种肿瘤类型中表达差异显著的570个lncRNAs。系统性临床调查14例泛癌资料,鉴定出了633个新型的的预后标志物。在几个癌症模型中,沉默顶层差异表达以及与临床相关的S期富集lncRNAs(主要检测了8个)会影响关键的癌细胞特征。在多种癌症类型中对SCAT7的功能与机制研究表明,它与hnRNPK/YBX1复合物相互作用,通过FGF/FGFR及其下游PI3K/AKT和MAPK通路调控肿瘤细胞的标志物。该研究了一种基于LNA反义寡核苷酸的治疗癌症细胞系和患者源性肿瘤(PDX)异种移植的策略。
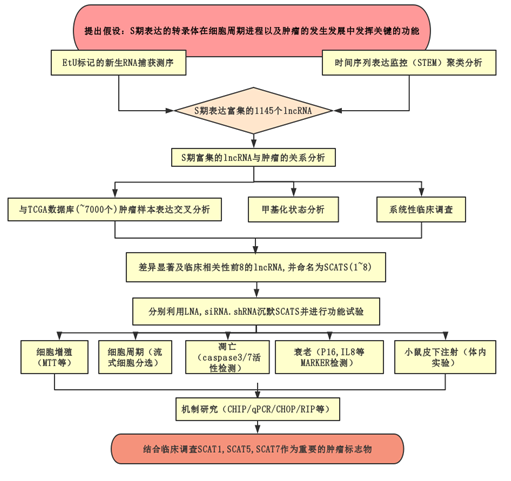
技术路线:
结果:
1.鉴定跨S期表达的lncRNA 及其在肿瘤中的差异表达
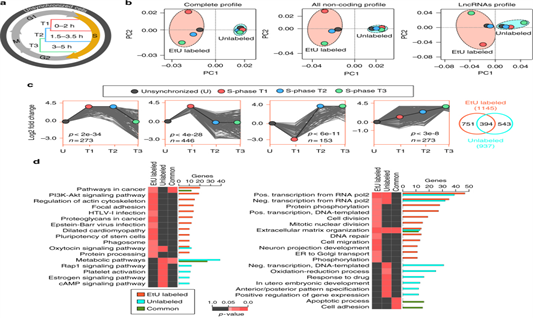
图1:利用新生RNA捕获测序鉴定S期表达的lncRNA。a. 新生RNA捕获在S期的三个不同时间点的细胞周期图。b. lnRNA的表达谱的主成分分析(PCA)。c.通过STEM聚类分析,S期的lncRNA显示了四种显著的时间模式。维恩图显示了EtU标记和未标记样本富集的lncRNA的交叉分析。d. S期富集的lncRNA附近的(< 50kb)蛋白编码基因分子信号通路分析(左图)和GO富集分析(右图)。
2. S期相关的lncRNAs展示出的后生性的变化以及表征为独立的预后标志物
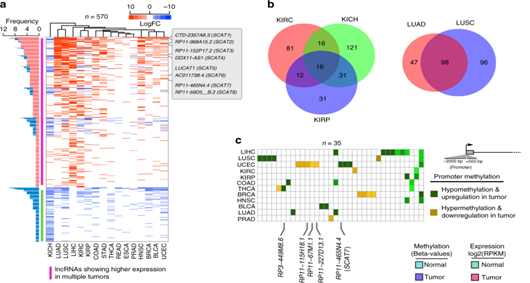
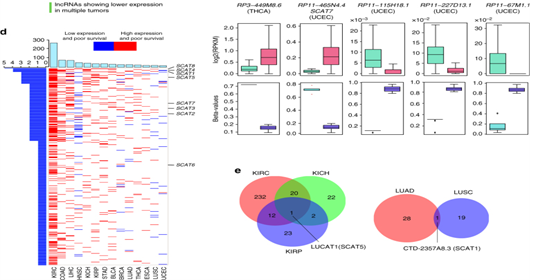
图2:使用泛癌TCGA数据集将S期相关的lncRNAs表征为致癌驱动因子和独立预后标志物。a.在至少一种肿瘤类型中(通过与TCGA数据库比对)存在显著差异的表达的S期相关的570个lncRNA。b.维恩图揭示了S期相关的lncRNA在不同类型的肾癌和肺癌中差异性表达交叉分析。c.抵抗启动子甲基化相关的S期lncRNA在不同癌症类型中差异表达状态。d.热图显示了基于二分法的520个S期lncRNA潜在独立预后价值。e.维恩图显示了s期lncRNA的数量,它们可以独立地预测不同类型的肾癌和肺癌的生存状况。
3. SCATs调控细胞周期进程与细胞凋亡
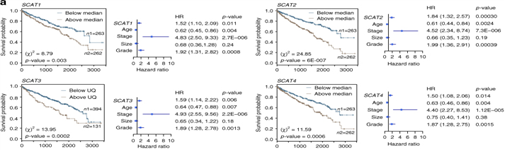
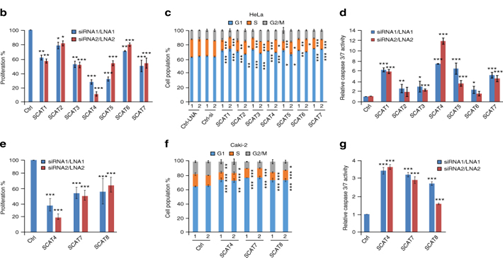
图3:临床相关性最高的S期lncRNA调控关键的肿瘤标志物。a.SCAT1-SCAT8的Kaplan-Meier图显示了KIRC患者的总体生存率。b,c,d.使用两种不同的LNAs或siRNAs敲低SCATs, SCATs沉默48小时后HeLa细胞的增殖能力,细胞周期以及caspase 3/7活性检测。e.Caki-2 (KIRC)细胞的MTT分析。f,g.Caki-2细胞用不同的LNAs或siRNA敲低后的细胞周期分布以及caspase 3/7活性。
4. SCAT1和SCAT5分别作为独立的预后指标
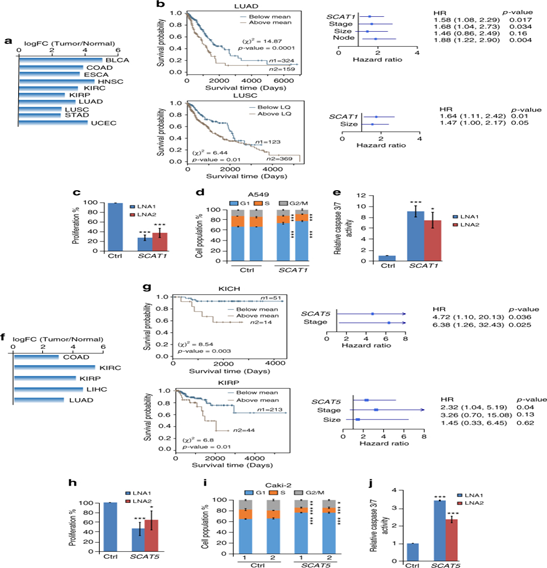
图4:SCAT1和SCAT5分别作为肺癌和肾源性癌症的致癌因素和预后指标。a.条形图显示了从TCGA数据库中获得的10种不同癌症类型中SCAT1的显著差异表达水平。b.SCAT1的Kaplan-Meier图揭示了LUAD和LUSC)型患者的总体生存率。c,d,e.敲低SCAT1的MTT细胞增殖分析,细胞周期状况以及caspase 3/7活性。f.条形图显示了SCAT5在从TCGA数据库中获得的5种不同癌症类型中显著的差异表达水平。g.SCAT5的Kaplan-Meier图显示了KICH和KIRP肾癌患者的总体生存率。h,I,j.对SCAT5沉默的Caki-2细胞系的MTT增殖分析,细胞周期分析以及caspase 3/7的活性。
5. SCAT7调节多种肿瘤细胞的标志物,下调SCAT7的表达诱导细胞衰老
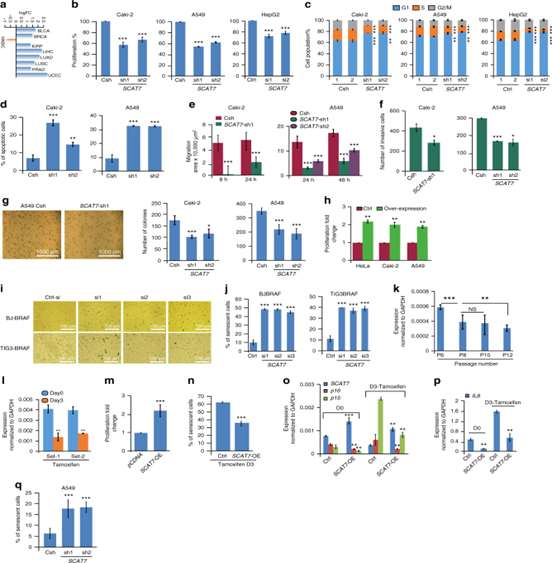
图5:SCAT7是肾脏、肺和肝癌的致癌因子。a.SCAT7在TCGA数据库中不同的癌症类型之间表达呈log2的倍数变化。b,c.敲低SCAT7的 Caki-2, A549,和HepG2细胞的MTT细胞增殖实验以及细胞的细胞周期分布。d,e,f.g.Caki-2和A549 中SCAT7沉默的48h后凋亡细胞的百分比以及细胞的迁移和Matrigel细胞侵袭实验以及软琼脂克隆形成实验。h.HeLa, Caki-2和A549细胞过表达SCAT7的MTT细胞增殖实验。I,j.β-半乳糖苷酶比色检测使用三种siRNAs沉默72h后。计量衰老细胞占整个细胞群的百分比。k.连续传代的BJ-BRAF细胞的SCAT7的qPCR。i. SCAT7在其莫西芬(200 nM)诱导的衰老第0天和第3天的BJ-BRAF细胞在一定时间间隔里的表达。m.过表达SCAT7的BJ-BRAF细胞用MTT法测定细胞增殖。n,o,p,q.检测接受他莫西芬治疗3天后的阳性衰老细胞的百分比并p16、p15(o)和IL8 (p)的表达。
6. SCAT7调控FGF/FGFR, PI3K/AKT, and Ras/MAPK等多种信号通路。
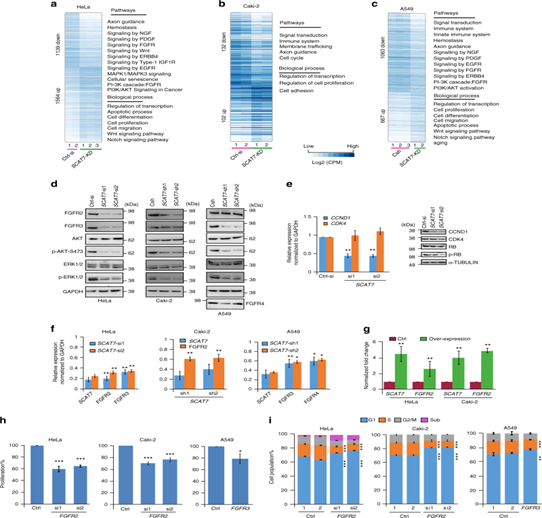
图6:SCAT7通过FGF信号通路调控细胞周期进展和细胞增殖。a – c,d.在HeLa (a)、Caki-2 (b)和A549 (c)细胞系中敲低SCAT7后,通过热图揭示了在相应分子通路和生物过程的上调和下调基因。Western blot检测蛋白水平。e.实时荧光定量qPCR(左面板)和Western blot(右面板)检测到CCND1的表达水平显著降低。f.qPCR验证分别利用siRNAs或shRNA敲低的SCAT7及其靶基因的表达水平,g.过表达SCAT7检测SCAT7及其靶基因FGFR2在HeLa和Caki-2细胞中的表达。h,iFGFR3沉默后进行MTT细胞增殖检测并检测细胞周期表达谱。
7. SCAT7/hnRNPK/YBX1复合体调控肿瘤标志物
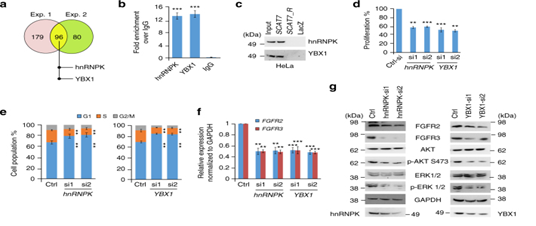
图7:SCAT7与hnRNPK和YBX1互作,调控细胞增殖和细胞周期进程。a.维恩图对HeLa细胞中的SCAT7相互作用的蛋白的交叉分析。b. RNA免疫印迹实验(RIP)后qPCR检测SCAT7。c.免疫印迹验证SCAT7与hnRNPK和YBX1的相互作用。d.转染两个靶向hnRNPK或YBX1的siRNA后进行细胞周期分析。e,f.检测FGFR2在敲低hnRNPK和YBX1的HeLa细胞中的表达。g.Western blot检测hnRNPK和YBX1沉默的HeLa细胞中标志物的表达。
8. SCAT7是肿瘤的潜在治疗靶点
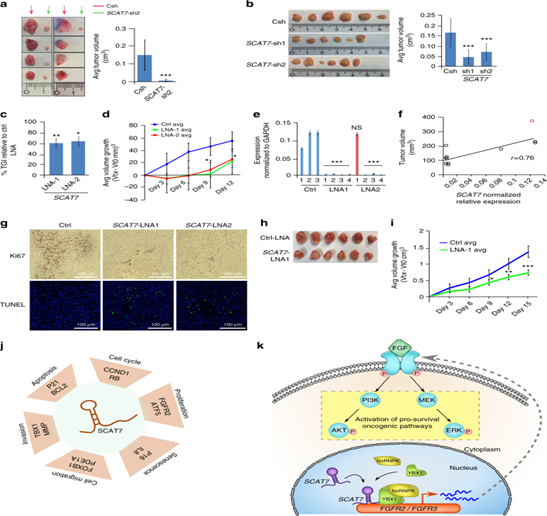
图8:SCAT7是不同类型的肿瘤潜在治疗靶点。a.在Balb / c裸鼠皮下注射1×106 Csh或SCAT7-sh2 786 - o细胞后8周检测肿瘤生长状况(每组n = 8)。b.在Balb / c裸鼠皮下注射1×106 Csh或SCAT7-sh1和SCAT7-sh2的 A549细胞8周后检测肿瘤生长状况(每组n = 6)。c.对Balb/c裸鼠进行4次皮下注射,检测肿瘤生长抑制(TGI)作用(每组n = 5)。e. qPCR检测Ctrl-LNA、SCAT7- LNA1、SCAT7- LNA2处理A549肿瘤后的表达SCAT7。f.散点图揭示体内SCAT7的表达与肿瘤体积的相关性。h.对NSG小鼠进行人源肿瘤异体移植模型(PDX), i.用SCAT7 LNAs处理的PDX模型的平均肿瘤生长体积。j, k模型描述SCAT7 (k)在FGF/FGFR信号通路的调控机制。
参考文献:Ali MM1, Akhade VS1, Kosalai ST1, Subhash S1, Statello L1, Meryet-Figuiere M1, Abrahamsson J2, Mondal T1, Kanduri C3. PAN-cancer analysis of S-phase enriched lncRNAs identifies oncogenic drivers and biomarkers. Nat Commun. 2018 Feb 28;9(1):883.






