与人类线粒体疾病相关的CO2敏感的tRNA修饰
由Tsutomu Suzuki带领的日本团队于2018年5月在Nature Communicatio n杂志(IF=12.35)发的一篇文章:一般认为,tRNAs修饰是稳定和静态的,并且他们的修饰频率几乎不被调控。研究发现,在5个物种的线粒体tRNAs中,N6 –苏氨酸氨基甲酰腺苷酸(t6A)主要发生在线粒体的第37号位置。这篇文章中发现:YRDC和OSGEPL1是形成t6A37不可或缺的组分,这主要是通过L-苏氨酸、ATP和CO2/碳酸氢盐作为底物来实现的。同时,在OSGEPL1基因敲除细胞中发现了呼吸系统缺陷,并且OSGEPL1基因敲除后能够阻碍线粒体翻译。在从MERRF样病人细胞中分离出突变的mt-tRNAs中发现t6A37低表达,这就说明缺乏t6A37会导致疾病的发生。t6A37的动力学表明CO2/碳酸氢盐的Km值非常高(31mM),这就是说明CO2/碳酸氢盐是t6A37形成的限速因子。与此一致的是还发现用没有加入碳酸氢盐的培养基培养的人细胞中分离的mt-tRNAs中的t6A37也是低表达。这些发现说明t6A37是由传感细胞内CO2/碳酸氢盐的浓度调节的。
技术路线:
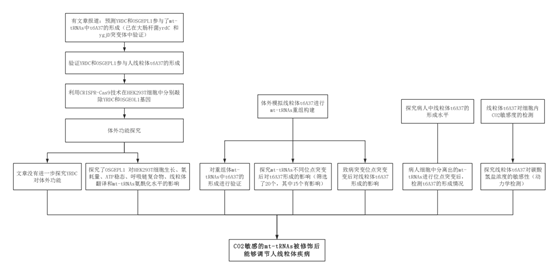
结果:
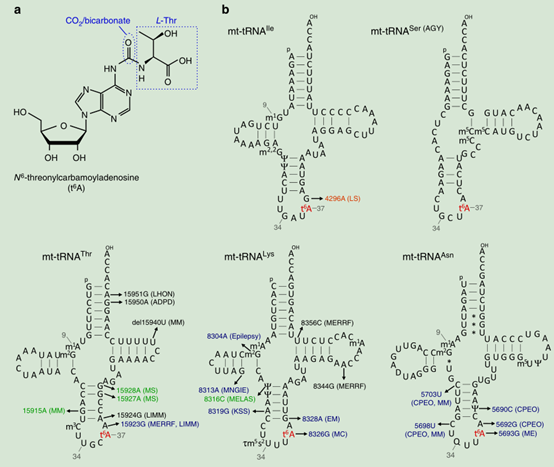
图1. 人mt-RNAs的t6A。a. tRNAs的化学结构。椭圆虚线代表CO2/碳酸氢盐,方形虚线代表L-丝氨酸。b. 5个带有t6A37的人mt-tRNAs的二级结构和转录后修饰位点。
1. YRDC参与线粒体t6A37的形成。
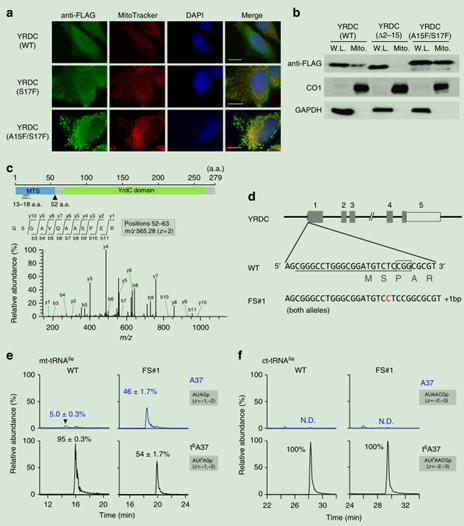
图2. a. Hela细胞中进行YRDC亚细胞定位,FLAG抗体进行免疫荧光染色。细胞核和染色质分别用DAPI(蓝色)和Mito Tracker(红色)。注:S17F、A15F/S17F (YRDC进行MTS区突变)。 b. WB方法在线粒体中,对YRDC进行定位。注:a.a. Δ2–15(YRDC进行N-末端突变)和A15F/S17F (YRDC进行MTS区突变), CO1(线粒体的marker)、GAPDH(细胞质的marker)。c. 确定YRDC在MTS上的切割位点。上:预测的MTS(蓝色)和大肠杆菌相同的保守区域(绿色)代表YRDC。白色和黑色箭头所指位置分别是Hela细胞中长和短YRDC亚型的多切割位点。中和下:CID光谱代表在52位点上短亚型切割位点的N-末端胰蛋白酶肽序列。CID的前体是m/z565.28。d.利用CRISPR-Cas9系统敲除YRDC基因。人YRDC基因和CRISPR-Cas9系统的插入位点(阴影部分代表编码区,打开的盒子部分代表外显子的非转录区域,线代表内含子,插入在WT YRDC的1号外显子)。划线部分是sgRNA的靶点序列。并产生了MTS突变的细胞系(FS#1)的序列,插入的C用红色表示。ef. 离子色谱图(XICs)分析通过从WT、FS#1细胞系分离的mt-tRNAIle和ct-tRNAIle中A37(top)和t6A37(bottom)的表达情况。
2. OSGEPL1参与线粒体t6A37的形成。
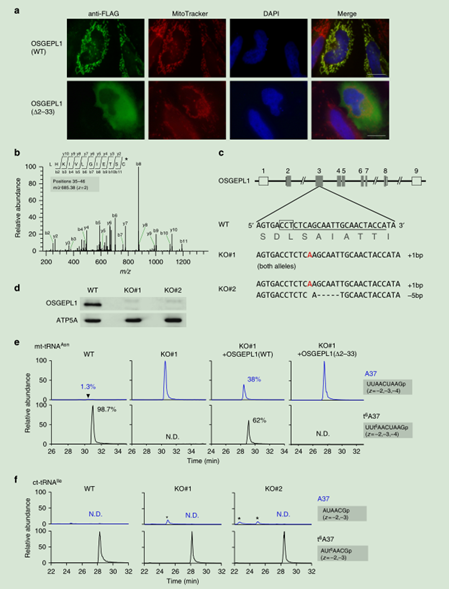
图3. OSGEPL1参与线粒体t6A37的形成。a. Hela细胞中进行OSGEPL1亚细胞定位,FLAG抗体进行免疫荧光染色。细胞核和染色质分别用DAPI(蓝色)和Mito Tracker(红色)。注:Δ2–33 (OSGEPL1进行MTS突变)。c. 确定OSGEPL1在MTS上的切割位点。CID光谱代表OSGEPL1从35位开始的N-末端多肽的序列。CID的前体是m/z685.38。c. 利用CRISPR-Cas9系统敲除OSGEPL1基因。人OSGEPL1基因和CRISPR-Cas9系统的插入位点(阴影部分代表编码区,打开的盒子部分代表外显子的非转录区域,线代表内含子,插入在WT OSGEPL1的3号外显子)。划线部分是sgRNA的靶点序列。并产生了MTS突变的细胞系(KO#1和KO#2)的序列,插入的A用红色表示,删除序列用虚线代表。d. WB检测OSGEPL1的敲除情况。ATP5A(线粒体marker作为control)。ef. 离子色谱图(XICs)分析通过从WT、KO#1、加入OSGEPL1的KO#1和加入突变OSGEPL1的 KO#1细胞系分离的mt-tRNAIle和ct-tRNAIle中A37(top)和t6A37(bottom)的表达情况。
3. OSGEPL1缺失导致线粒体功能紊乱。
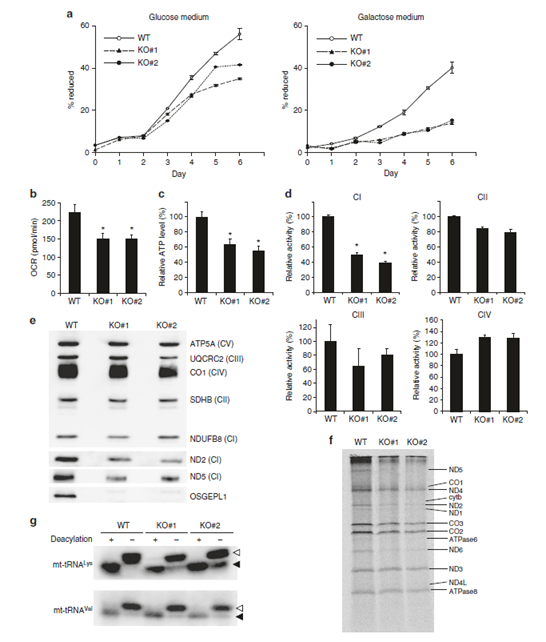
图4. a. WT, OSGEPL1 KO#1和OSGEPL1 KO#2细胞的生长曲线图,左:培养基加入葡萄糖作为基础C源,右:培养基中加入半乳糖培养作为基础C源。b. 痒耗率(COR)的测定。c. ATP稳态水平的检测。d. 呼吸链复合物I、II、III和IV(CI-IV)的检测。e. ND2和ND5(CI的亚单位)核NDUFB8(核编码CI亚单位)的稳态水平。f. 脉冲标记检测线粒体的翻译活性。g. 通过northern blot 检测mt-tRNAsLys中氨酰化水平。
4. 线粒体mt-tRNA的体外重组的鉴定和突变后导致线粒体疾病。
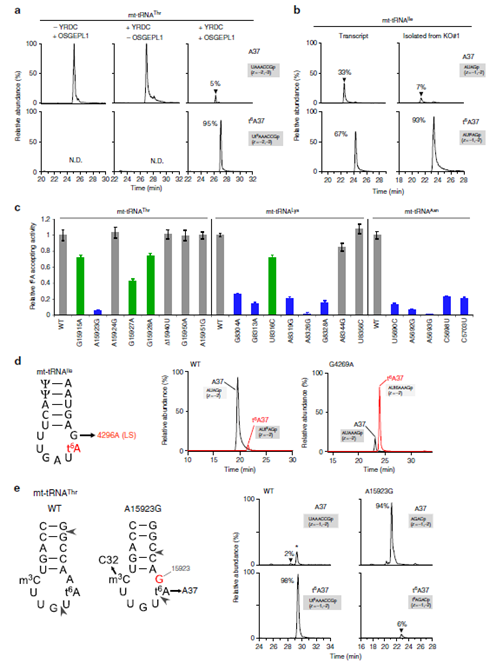
图5. a. mt-tRNAsThr中转录本t6A37体外形成(Thr (95%))(其他mt-tRNAs在补充材料中:Asn (98%)、Lys (95%)、Ile (67%)、Ser(AGY) (34%))。b. 左:mt-tRNAsIle中转录本t6A37的形成(Ile (67%));右:来自OSGEPL1-KO的t6A37修饰后。c. Thr, Lys和Asn各位点突变后对mt-tRNAs中t6A37形成的影响。d.mt-tRNAIle致病突变位点G8(G4296A)突变对线粒体t6A37形成的影响。e. 病人细胞中分离出的mt-tRNAThr 进行A15923突变后对线粒体t6A37形成情况。
5. 线粒体t6A37对体内的CO2比较敏感。

图6. 线粒体t6A37的形成对细胞内碳酸氢盐浓度很敏感。a. mt-tRNAThr 中t 6A37形成的动力学检测。b. 在非碳酸氢盐培养基培养的HEK293T细胞中t6A37发生修饰的水平。
结论:
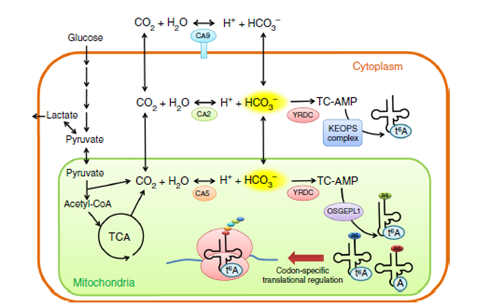
图7. 在细胞质和线粒体中t6A37的形成和碳酸氢盐的新陈代谢。线粒体中TCA循环产生的CO2通过碳酸酐酶5(CA5)形成碳酸氢盐 。此外,线粒体CO2通过碳酸酐酶2(CA2)转运到细胞质和水里。在低氧条件下, 碳酸酐酶9(CA9)通过HIF-1途径在细胞表面过度表达。CA9产生大量的细胞外碳酸氢盐。然后,细胞吸收细胞外碳酸氢盐,进一步中和乳酸盐并防止酸化,细胞质中的YRDC复合物和线粒体中的OSGEPL1复合物调节tRNA中t6A37的形成。在没有碳酸氢盐培养的条件下,两个tRNAs中的t6A37处于低修饰水平,跟低氧实体瘤一样,表明通过传感细胞内碳酸氢盐的转译调节。
参考文献:Huan Lin , Kenjyo Miyauchi, Tai Harada, Ryo Okita, Eri Takeshita, Hirofumi Komaki2, Kaoru Fujioka, Hideki Yagasaki, Yu-ichi Goto, Kaori Yanaka, Shinichi Nakagawa, Yuriko Sakaguchi1& Tsutomu Suzuki. CO2-sensitive tRNA modification associated with human mitochondrial disease. Nature communications. (2018) 9:1875.






