Exosome research: 外泌体介导的lncRUNX2-AS1从多发性骨髓瘤细胞到间充质干细胞的转移对成骨的抑制作用
多发性骨髓瘤(MM)的特征是间充质干细胞(MSC)的成骨能力降低。癌细胞和癌症基质细胞之间的交流是肿瘤进展的驱动因素。了解骨髓瘤-基质的相互作用对于开发可逆转骨疾病的有效策略至关重要。近日,发表在《Oncogene》(IF=6.854)上的文章《Exosome-mediated transfer of lncRUNX2-AS1 from multiple myeloma cells to MSCs contributes to osteogenesis》报道了外泌体在MM患者骨形成抑制中的作用。他们发现在骨髓瘤细胞中有生物活性的lncRNA RUNX2-AS1可以被包装到外泌体中并传递给MSC,从而抑制MSC的成骨。RUNX2的反义链RUNX2-AS1在MM患者的MSCs中富集。RUNX2-AS1能够在互补区域与RUNX2 前体mRNA形成RNA双链体,并通过降低剪接效率而转录抑制RUNX2表达,导致MSC的成骨潜能下降,体外小鼠模型施用外泌体分泌抑制剂GW4869可有效预骨丢失。
技术路线
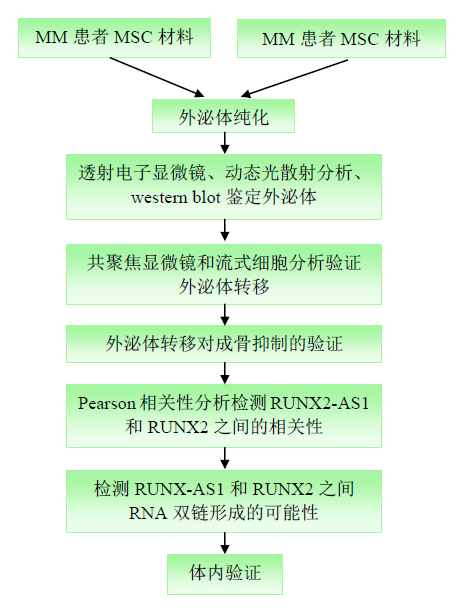
研究结果
1. MM细胞衍生的外泌体被转移至MSC。
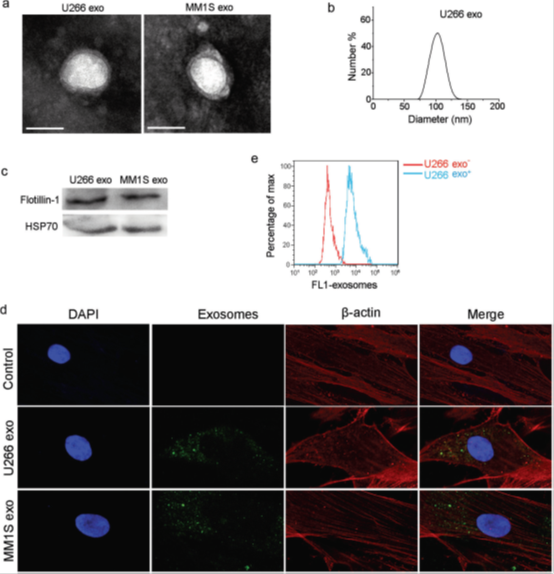
图1 来自人骨髓瘤细胞系(HMCL)的外泌体的表征
a. MM1S分泌的外泌体的典型TEM成像(Bar = 100nm)。b. 动态光散射测量U266分泌的外泌体。c. HSP70衍生的外泌体中HSP70和flotillin-1蛋白的典型western blot。d. 在缺乏(对照)或存在U266衍生的PKH67标记的外泌体的情况下培养BM-MSC 24小时。外泌体被BM-MSC摄取了,如共聚焦显微镜(原始放大倍数,×400)所示,DAPI(细胞核)和594缀合的抗肌动蛋白抗体对MSC进行染色。e. 用荧光标记的外泌体孵育后的MSC的流式细胞术分析。FL1荧光表明外泌体摄取。
2. MM衍生的外泌体在MSC成骨分化中的作用。
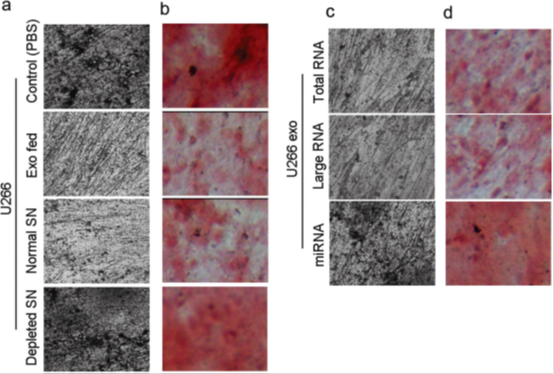
图2 U266衍生的外泌体对ND-MSCs1成骨分化的影响
a.b. 外泌体衍生自U266。外泌体分离后剩余的上清液。外泌体从含无外泌体的胎牛血清的培养基中培养48h的U266中分离。以U266的上清、从U266分泌的外泌体、外泌体缺失的上清或PBS培养一定时期的ND-MSCs1中矿化瘤的Von Kossa染色a和茜素红染色b。转染了从U266的外泌体中提取的总RNA,大RNA或小RNA的ND-MSCs1中矿化瘤的Von Kossa染色c和茜素红染色d。
3. 外泌体介导lncRNA RUNX2-AS1从MM细胞转移到MSC的成骨抑制作用。
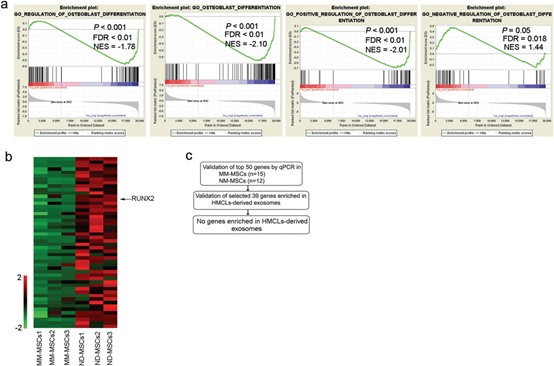
图3 参与外泌体介导的成骨分化减少的mRNA的鉴定
a. 特异性基线基因表达特征与成骨分化活性相关。典型GSEA图解说明:MM-MSC的转录物中参与成骨分化的正调控或负调控基因的丰度。FDR:错误发现率,NES标准丰度得分。b. MM-MSC和NDMSCs的基因表达谱。在关于成骨分化的基因组中的MM-MSC中下调(蓝色)的前50个基因。c. 特定样品中筛选失调基因的流程图。
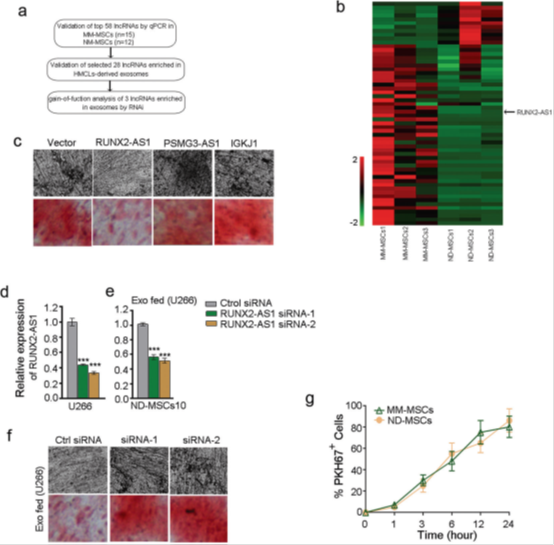
图4 外泌体lncRNA RUNX2-AS1及其对成骨分化影响的鉴定
a. 特定样品中筛选失调基因的流程图。b. 通过MM-MSC和ND-MSC的高通量测序数据进行的lncRNA分析的热图。c. 对照、RUNX2- AS1过表达、IGKJ1过表达、PSMG3-AS1过表达转染的ND-MSCs6、ND-MSCs7、ND-MSCs8或NDMSCs9中矿化瘤的Von Kossa 染色 and alizarin red 染色。d. 用RUNX2-AS1 siRNA或对照siRNA转染的U266中RUNX2-AS1的qPCR分析。e. 特定外泌体孵育后的MSC中RUNX2-AS1的qPCR分析。GAPDH作内参。f. 特定外泌体孵育48小时后ND-MSCs10中矿化瘤的Von Kossa染色和茜素红染色。g. 用荧光标记的外泌体孵育一定时间后的MM-MSC和ND-MSC的流式细胞分析。(值是平均值±SD,* P <0.05,** P <0.01,*** P <0.001。)
4. RUNX2-AS1负调控RUNX2表达。
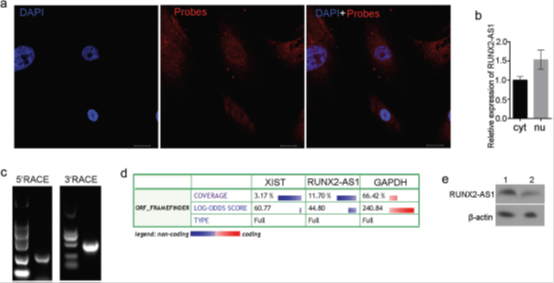
图5 lncRNA RUNX2-AS1的特征,RUNX2-AS1在MSCs中细胞核和细胞质位置
a. MSC中的RUNX2-AS1的RNA FISH测定。比例尺,20微米。b. qPCR检测RUNX2-AS1在细胞质和细胞核中的分布。GAPDH作内参。c. 5'-RACE和3'-RACE巢式PCR产物的凝胶电泳。d. 使用有编码能力的计算器(http://cpc.cbi.pku.edu.cn/)预测由RUNX2-AS1编码的蛋白质。FrameFinder的ORF覆盖率:预测的ORF覆盖率是良好ORF质量的指标。LOG-ODDS SCORE是预测的ORF质量的指标,分数越高,质量越好。ORF类型是预测的ORF的完整性,其指示ORF是否以起始密码子开始并以框内终止密码子结束。e. 用于MSC中的RUNX2-AS1体外转录的链特异性RNA探针的Northern blot分析。1:MM-MSCs2,2:ND-MSCs12。β-肌动蛋白用作对照。
5. RUNX2-AS1与RUNX2形成RNA双链体并阻断其剪接。
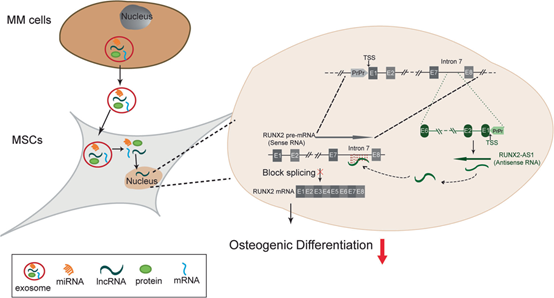
图6 通过外泌体转移RUNX2-AS1使MSC成骨分化降低的机制示意图
lncRNA RUNX2-AS1可以包装到外泌体中并从骨髓瘤细胞中分泌,转移到MSC。在MM-MSC中,RUNX2-AS1通过干扰其剪接来降低RUNX2的表达,导致MM-MSC的成骨分化减少。该示意图还显示了RUNX2-AS1与RUNX2前体mRNA及RNA:RNA的相互作用区域。框代表外显子。RUNX2外显子是灰色的;RUNX2-AS1外显子是绿色的。内含子表示为线。RUNX2前体mRNA和RUNX2-AS1相互作用以红色虚线表示。长灰色箭头和绿色箭头分别表示有义RNA(RUNX2前mRNA)和反义RNA(RUNX2-AS1)的方向。PrPr:近端启动子,TSS:转录起始位点。
6. 外泌体介导的体内成骨分化减少的作用。
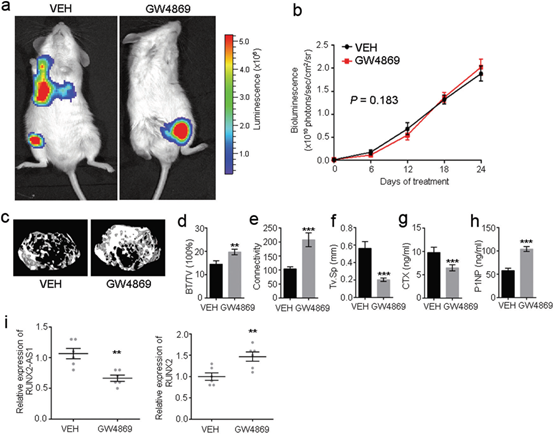
图7 体内外泌体介导的成骨分化减少的影响
a. 在用U266-luc +细胞静脉注射并用GW4869或空白对照处理后原位异种移植的NPG小鼠的典型全身生物发光图像。b. 通过无创生物发光成像监测肿瘤发展。数据表示为平均值±SD(n = 6 /组)。c. 来自空白处理组和GW4869处理组的股骨的微电脑断层扫描分析。在远端股骨的干涉图的典型微CT图像显示空白处理的小鼠中的小梁结构丧失,但是在GW4869处理的小鼠中没有。图中显示了骨小梁的体积(d),连通性(e)和骨小梁分离(f)的骨参数。与空白处理的小鼠相比,GW4869显著改变了血清中的骨转换标志物,增加了P1NP(g)(骨形成标志物)的水平,同时降低了CTX(h)(骨吸收标志物)的水平。(值是平均值±SD,* P <0.05,** P <0.01,*** P <0.001,相对于载体对照)。i GW4869处理小鼠或对照小鼠的MSC衍生的RUNX2-AS1和RUNX2的qPCR检测。
结论
研究结果表明外源性lncRUNX2-AS1通过独特的外泌体lncRUNX2-AS1 / RUNX2途径在成骨分化中从MM细胞向MSC转移中发挥关键作用。外泌体lncRNA RUNX2-AS1可能成为MM骨病变的潜在治疗靶点。






