巨噬细胞来源的外泌体中miRNA的转移诱导胰腺癌产生耐药性
吉西他滨是首个用以治疗胰腺导管腺癌(PDAC)的药物,其主要通过终止DNA复制来抑制细胞生长而发挥作用。PDAC以其对吉西他滨的耐药性而闻名。近来,肿瘤相关的巨噬细胞(TAM)被证明与吉西他滨的抗药性有关。然而,这一过程的确切机制仍不清楚。利用PDAC小鼠模型和电子显微镜分析,作者发现TAM分泌90nm大小的小泡,这些小泡被癌细胞选择性地内化,从而使TAM与肿瘤微环境发生联系。将人工dsDNA片段转染到小鼠腹腔巨噬细胞,并对小鼠进行注射使其产生PDAC,结果显示原发性肿瘤和肝转移肿瘤组织中dsDNA片段浓度比正常组织相比高4倍。这些巨噬细胞来源的外泌体(MDE)显著降低PDAC细胞对吉西他滨的敏感性。这种效应是由MDE中miR-365的转移所介导的。miR-365通过上调三磷酸盐和诱导胞嘧啶核苷酶脱氨霉而降低吉西他滨的激活。TAM中miR-365的转移诱导PDAC小鼠对吉西他滨的抗药性, 当使用miR-365拮抗剂则恢复对吉他西滨的敏感性。缺乏外泌体分泌能力的Rab27 a/b缺陷小鼠对吉西他滨的反应显著好于野生型小鼠。这些结果表明MDE是PDAC中吉西他滨耐药性的关键调控因子,阻断miR-365可以增强吉西他滨对癌细胞的作用。
技术路线
研究结果
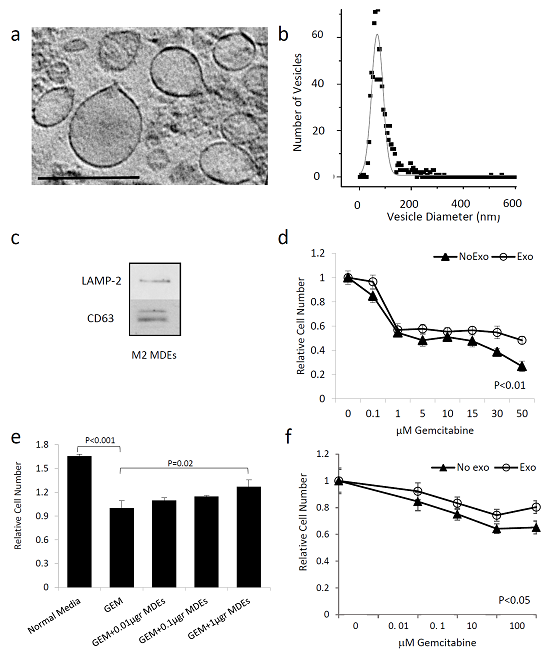
图1 巨噬细胞来源的外泌体(MDE)的鉴定及其对细胞耐吉西他滨(GEM)的影响。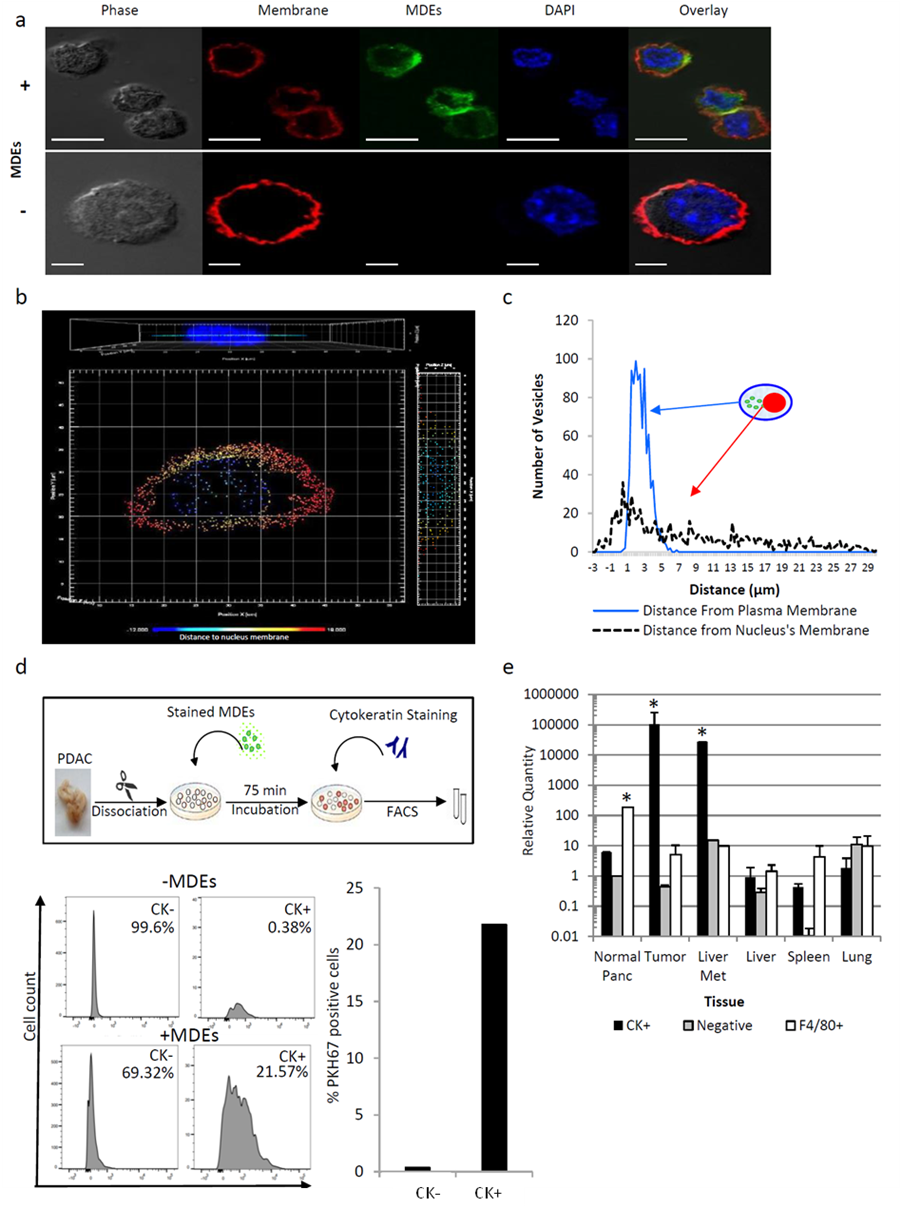
图2 巨噬细胞来源的外泌体(MDE)的分离。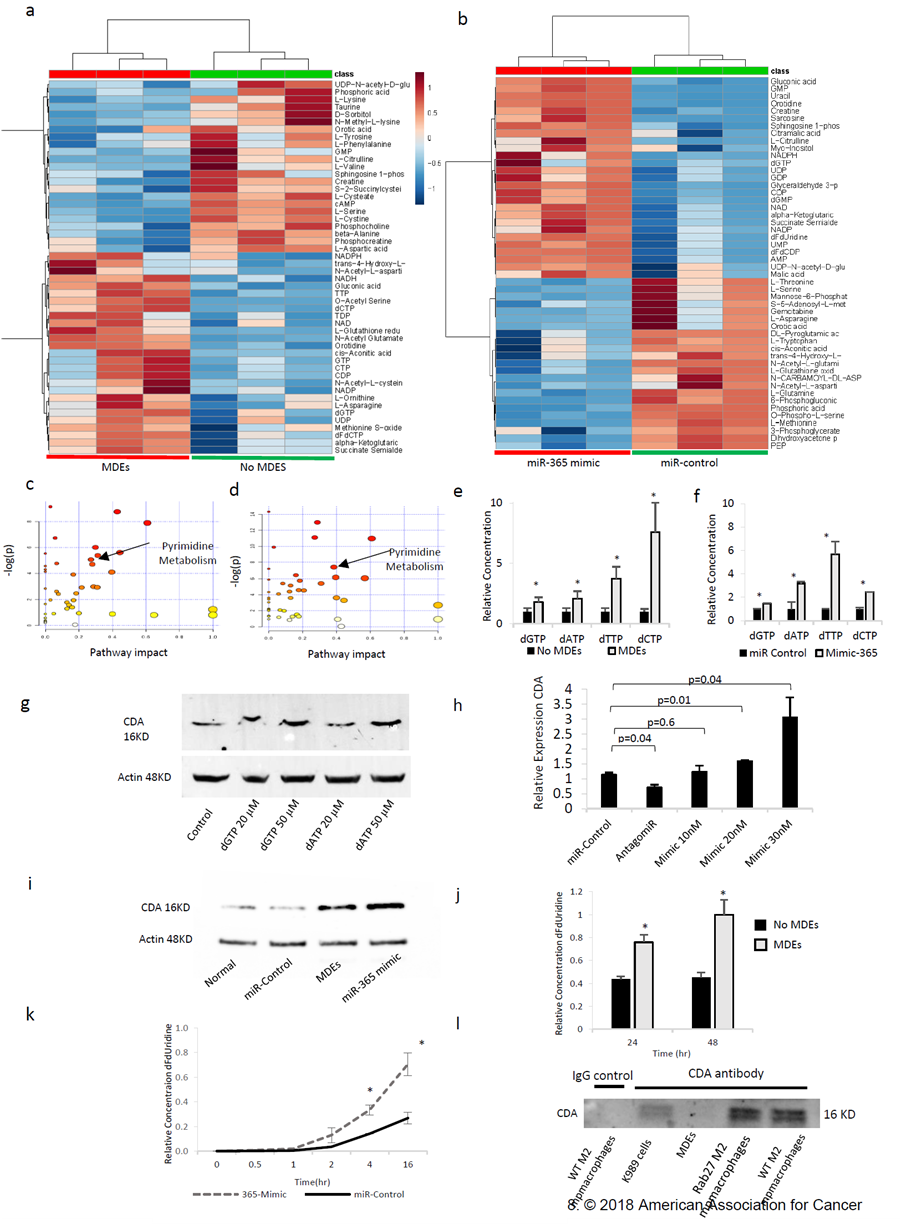
图3 外泌体中miR-365的转移诱导吉西他滨耐药性。
图4 巨噬细胞来源的外泌体(MDE)和miR-365调节嘧啶合成和CDA表达。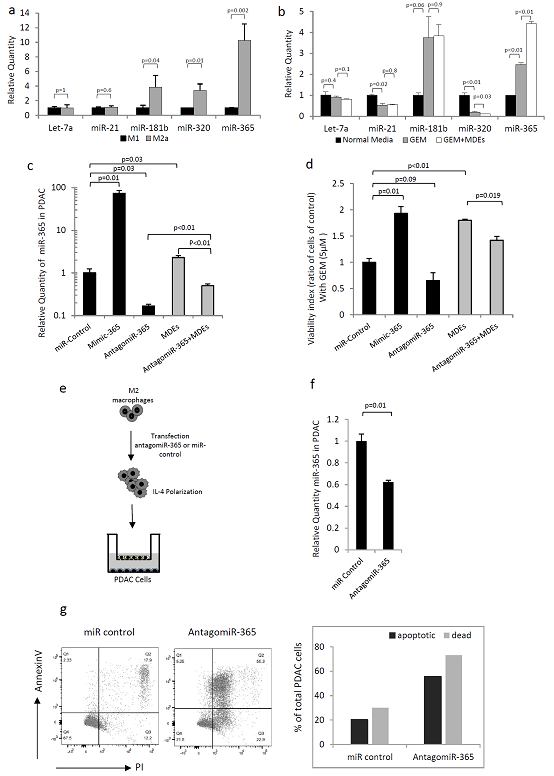
图5 巨噬细胞来源的外泌体和在体内的吉西他滨耐药性。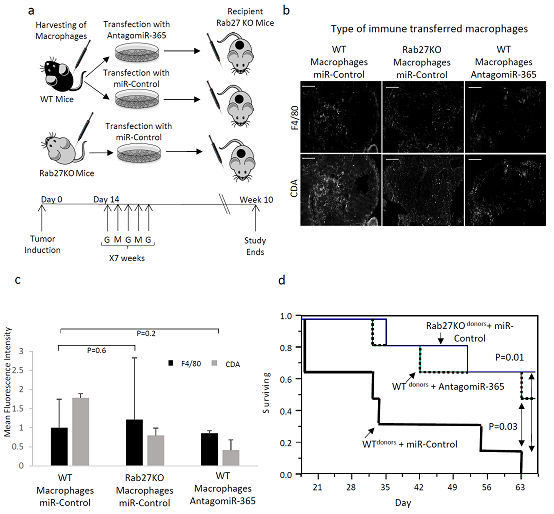
图6 miR-365拮抗剂挽救实验。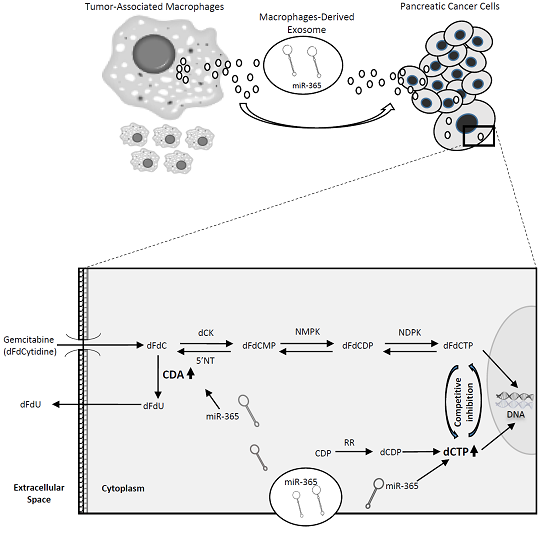
图7 肿瘤相关巨噬细胞诱导吉西他滨耐药的机制图
参考文献:Binenbaum, Y., et al., Transfer of miRNA in macrophages-derived exosomes induces drug resistance of pancreatic adenocarcinoma. Cancer Res, 2018. (IF=9.130)






